潰瘍性結腸炎患者對英夫利昔單抗原發性失應答的腸道黏膜基因篩選
楊 想, 吳 鶯
(江蘇大學附屬醫院 消化內科, 江蘇 鎮江, 212000)
潰瘍性結腸炎(UC)是一種發病原因尚不明確的慢性腸道非特異性炎癥,屬于炎癥性腸病(IBD)之一[1], 主流治療方式為藥物治療。英夫利西單抗(IFX)是一種抗腫瘤壞死因子(TNF)-α單克隆抗體(簡稱抗TNF-α單抗),可通過阻斷組織和血液循環中的TNF-α與TNF-α受體結合,從而使T細胞和巨噬細胞的凋亡被誘導激活以降低炎癥水平,已被廣泛應用于UC的臨床治療中[2]。但并非所有患者都對這種治療有反應,治療后第8~12周即3個療程IFX治療后仍未達到黏膜愈合為原發性失應答[3], 目前約有30%患者存在原發性無應答[4]; 此外,第1年約有13%的初始應答者在維持治療期間疾病復發,即繼發性失應答,而且隨著時間的推移,失去應答的患者不斷增多(40%~60%)[4]。對藥物的失應答不僅會延誤患者的治療,還會增加患者的治療成本和副反應發生風險。治療成本分析研究[5]提示,抗TNF-α藥物失應答是IBD患者治療成本增加的主要驅動因素。因此,使用預測性生物標記物來協助選擇治療藥物可能是必要的[6]。本研究挖掘GEO數據庫中IFX治療UC相關基因芯片進行生物信息學分析,尋找差異表達基因(DEGs)進行富集分析,并篩選出與UC患者對IFX原發性失應答相關的關鍵基因,現將結果報告如下。
1 資料與方法
1.1 數據來源
于GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/)下載GSE12251、GSE14580、GSE23597數據集的基因芯片。基因芯片中,治療后第8周對IFX原發性失應答的UC患者腸黏膜組織樣本為實驗組,治療后第8周對IFX應答的UC患者的腸黏膜組織樣本為對照組。GSE12251包括治療后第8周對IFX應答的UC患者12例,原發性失應答患者11例; GSE14580包括治療后第8周對IFX應答的UC患者8例,原發性失應答患者16例; GSE23597包括治療后第8周對IFX應答的UC患者27例,原發性失應答患者7例。
1.2 差異基因篩選與可視化
應用GEO2R在線工具軟件對GSE12251、GSE14580、GSE23597數據集樣本進行分組并分析DEGs, 以P<0.05、|log2FC|≥1(FC指差異倍數,即fold change)為條件篩選得到上調、下調基因,并進行數據集基因可視化展示。
1.3 功能富集分析
注釋、可視化和綜合發現數據庫(David, Version 6.8, http://david.ncifcrf.gov)是一個集成了生物數據和分析工具的在線生物信息數據庫,為使用者提供的生物信息包括全面的基因和蛋白質功能注釋信息。為了分析相關DEGs的功能,本研究利用David在線數據庫進行生物學分析,設定P<0.05及錯誤發現率(FDR)<0.05為差異具有統計學意義。
1.4 蛋白互相作用網絡分析及核心基因(Hub基因)的篩選
將篩選得到的DEGs導入String在線數據庫(https://string-db.org/), 設定最小互作評分為0.4分,構建蛋白質互相作用(PPI)網絡圖。采用Cytoscape3.8.0軟件對結果進一步進行可視化展示。利用Cytoscape插件MCODE獲得有顯著相互作用的功能模塊,設置參數為MCODE scores>7、Degree cutoff=2、Node score cutoff=0.2、K-score=2、Max. depth=100。利用cytoHubba插件的MCC算法篩選出得分最高的前20個基因作為關鍵基因。
1.5 對IFX治療原發性失應答的UC患者的潛在治療藥物篩選
藥物-基因相互作用數據庫(DGIdb, http://dgidb.org/)是一個整合了來自組織和展示論文、數據庫和網絡資源的藥物-基因相互作用和基因可藥性信息的數據庫。DGIdb將30個不同來源的內容標準化,包含藥物查詢、藥物-基因相互作用等更詳細的信息。將Hub基因列表上傳至DGIdb數據庫基因清單窗口框,尋找基因-藥物作用關系,得到PubMed id列表、相互作用類型和得分等結果數據,根據所得到的結果數據篩選潛在治療藥物[7]。
2 結 果
2.1 對IFX原發性失應答的UC患者的DEGs標識
應用GEO2R軟件對GSE12251、GSE14580、GSE23597數據集進行篩選,根據篩選條件,在火山圖中將篩選得到的差異有統計學意義的表達基因用不同顏色展示,并鑒定出DEGs(GSE12251中為454個, GSE14580中為1 173個, GSE23597中為726個),見圖1A、圖1B、圖1C[藍點、紅點分別代表下調、上調且符合篩選條件(P<0.05和|log2FC|>1)的DEGs, 黑點代表不符合篩選條件的DEGs]。3個數據集之間的重疊部分包含143個基因(上調基因10個,下調基因133個),見圖1D。

A: GSE12251的DEGs火山圖譜(應答與失應答); B: GSE14580的DEGs火山圖譜(應答與失應答); C: GSE23597的DEGs火山圖譜(應答與失應答); D: 各數據集共表達的VENN圖(紫色、紅色、綠色的圓分別代表GSE12251、GSE14580、GSE23597數據集,重疊部分代表共表達的DEGs)。圖1 各數據集DEGs表達火山圖及其共表達的VENN圖
2.2 DEGs的基因本體論(GO)富集分析和京都基因與基因組百科全書(KEGG)分析
為了分析DEGs的生物學分類,應用David軟件進行功能和途徑富集分析,并利用Metascape在線分析網站對DEGs進行GO分析和KEGG分析。GO分析結果顯示: ① 生物過程(BP), DEGs主要富集于炎癥反應、信號轉導和免疫反應等; ② 細胞組成(CC), DEGs 主要富集于質膜、細胞外區域和細胞外空間等; ③ 分子功能(MF), DEGs富集于細胞因子活性和受體活性。KEGG分析結果提示, DEGs富集于細胞因子-細胞因子受體相互作用、破骨細胞分化、Toll樣受體(TLR)信號通路、Jak-STAT信號通路、TNF信號通路、IBD等。見表1、表2。

表1 GO分析結果
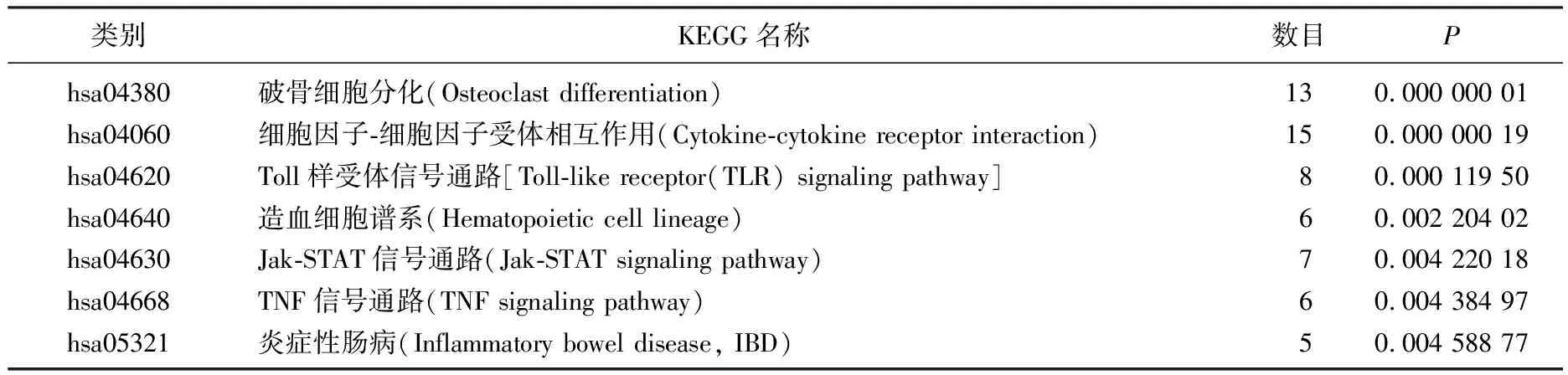
表2 KEGG分析結果
2.3 PPI分析
構建DEGs的PPI網絡(見圖2A), 并使用Cytoscape軟件獲得重要的模塊(見圖2B、圖2C)。應用cytoHubba插件的MCC算法篩選出20個關鍵基因:CXCL8、CXCL10、IL6、IL1β、TLR2、TLR8、CCL4、CXCR2、TLR1、PTPRC、CSF3、SELL、SELE、PTGS2、FCGR2A、C5AR1、IL1α、TREM1、FPR2、IL6R。關鍵基因的相互作用模塊見圖3。
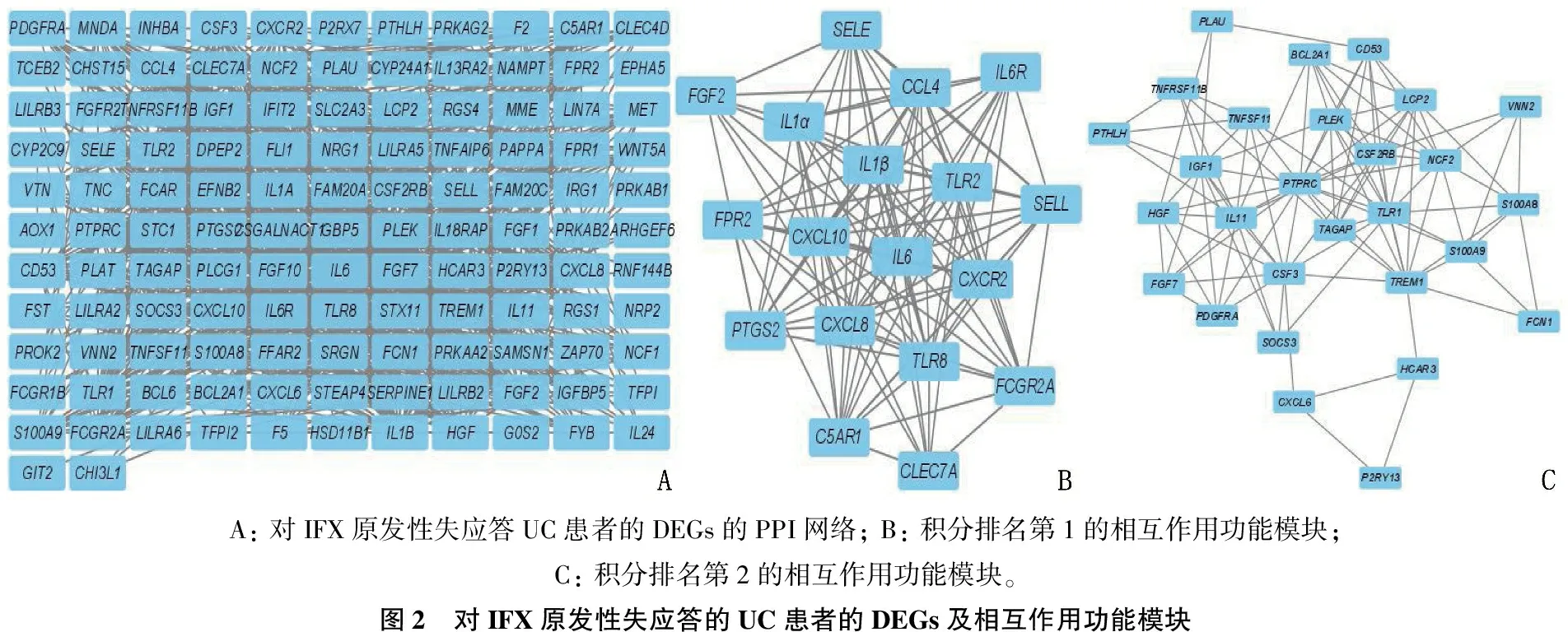
A: 對IFX原發性失應答UC患者的DEGs的PPI網絡; B: 積分排名第1的相互作用功能模塊; C: 積分排名第2的相互作用功能模塊。圖2 對IFX原發性失應答的UC患者的DEGs及相互作用功能模塊
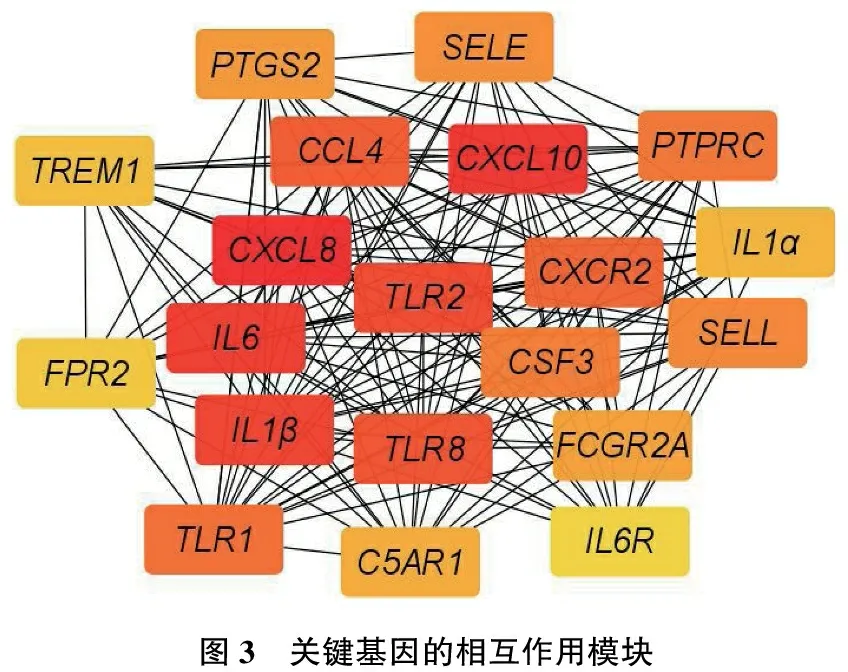
圖3 關鍵基因的相互作用模塊
2.4 對IFX治療原發性失應答的UC患者的潛在治療藥物篩選結果
將PPI網絡中篩選出的20個關鍵基因導入DGIdb數據庫尋找相關潛在藥物,得分排名前3的藥物分別為薩利魯單抗(sarilumab)、阿伐可泮(avacopan)、托拉利單抗(tomaralimab), 其或許在未來可作為對IFX治療原發性失應答UC患者的備選藥物。
3 討 論
本研究整合了GSE14580、GSE12251、GSE23597這3個微陣列數據集,利用GEO2R在線分析工具篩選出143個共同的DEGs, 并進行GO和KEGG富集分析來尋找DEGs之間的相互作用。GO功能注釋表明,對IFX原發性失應答的DEGs是主要存在于質膜的細胞學組分,介導細胞因子活性和受體活性的生物學功能,參與炎癥反應、免疫反應、信號轉導、細胞對脂多糖的反應等生物學過程,說明基因表達失調在UC患者對IFX是否應答中有著重要作用。
KEGG分析發現,對IFX原發性失應答的UC患者的DEGs與TLR通路、TNF信號通路以及Jak-STAT信號通路等密切相關,相關研究[8]表明這3個通路的基因多態性與抗TNF治療的應答相關。TLR通路是啟動IBD炎癥反應的重要通路,也是炎癥通路中的一個重要調節器[9-10], 對IFX原發性失應答的UC患者所有TLR對固有細胞因子反應持續降低,且與應答者相比,其在TLR刺激下細胞因子產生的倍數變化更小; 此外,與TLR激活后的應答者相比,原發性失應答者的IL-10水平較低,這可以解釋為何這些患者使用IFX治療無法控制炎癥[11]。研究[12]表明,參與TLR通路從而激活核因子κB(NFκB)的基因、調節TNF-α信號傳導的基因是預測患者對抗TNF治療反應的重要因素,這也提示了調節TNF信號和TNF合成的基因是抗TNF治療效果的重要預測因素。JAK-STAT通路的基因變異與IBD風險增加相關, JAK-STAT通路蛋白負責介導許多IBD相關細胞因子的受體信號,這些細胞因子參與調節腸道通透性,從而進一步引起腸道上皮的損傷[13], 而嚴重的腸道損傷會導致患者體內的抗TNF-α藥物通過潰爛的腸黏膜丟失[14], 這可能解釋了JAK-STAT通路為何與IFX治療原發性失應答密切相關。此外, JAK-STAT抑制劑如托法替尼目前已被用于常規治療失敗和(或)對其他生物制劑失去反應性的UC患者[15]。
本研究應用Cytoscape軟件篩選出20個關鍵基因,其中CXCL8即白細胞介素-8(IL-8), 具有預測UC對IFX的反應性的潛力。IFX原發性失應答的UC患者血清IL-8水平下降相較于IFX應答的UC患者更不明顯[16], 且原發性失應答患者的基線IL-8水平較高[17]。另一項針對IFX失應答的CD患者的研究[18]顯示,失應答患者單核細胞的CXCL8 mRNA是上調的。白細胞介素-6(IL-6)是一種多效性細胞因子,參與多種生物學過程,包括腫瘤發生、造血、炎癥和免疫系統調節[19-20]。研究[21]報道,患有嚴重IBD的患者或小鼠模型更可能有更高的血清IL-6水平。白細胞介素-1β(IL-1β)作為強效促炎細胞因子,可誘導前列腺素合成、中性粒細胞流入和激活、T細胞激活和細胞因子產生、B細胞激活和抗體產生以及成纖維細胞增殖和膠原蛋白產生[22]。IL-6及IL-1β基因高表達被證明與UC患者對IFX治療原發性失應答有關,這可能是此類患者潛在的治療目標[12]; 此外,治療過程中血清IL-6水平降低可作為UC患者對IFX治療應答的預測指標[16]。TLR2為TLR家族成員,其通過識別病原相關的分子模式及某些內源性配體,引發信號轉導并導致炎癥介質的釋放,在天然免疫防御中起重要作用并最終激活獲得性免疫系統。與對IFX應答的UC患者相比,對IFX失應答的UC患者血液中TLR2表達升高[23]。TLR2中的2個單核苷酸多態性(SNP)位點(rs4696480和rs11938228)與IFX治療UC患者的反應性相關[12]。目前雖無明確的研究結果證明PTPRC與IFX治療UC反應的關系,但其表達被認為與類風濕關節炎(RA)的抗TNF-α治療反應相關[24]。髓系細胞觸發受體-1(TREM-1)會加重結腸炎癥,而抑制體內TREM-1可通過調節自噬和內質網應激減輕結腸炎[25]。國外已有多項研究[26-28]證明,對IFX原發性或繼發性失應答的UC患者,早期TREM1表達會升高。IBD患者的CD14+單核細胞的TREM1高表達時,抗TNF反應必需的Fcγ受體和自噬通路的活性降低[29], 從而影響抗TNF反應。CXCL10、TLR8、CCL4、CXCR2、TLR1、PTPRC、CSF3、SELL、SELE、PTGS2、FCGR2A、C5AR1、IL1α、FPR2、IL6R基因在UC患者IFX原發性失應答中的作用尚不清楚,有待進一步研究。
薩利魯單抗是一種靶向結合白細胞介素-6受體(IL-6R)的人源化單克隆抗體,抑制該受體介導的炎性信號,在既往接受1種或多種疾病修飾抗風濕藥物治療效果欠佳的中度至重度活動性RA成人患者的治療中取得了較好的療效[30]。早期IL-6高水平在UC患者對IFX繼發性失應答中起到了提示作用[16], 薩利魯單抗可阻斷IL-6與其受體的結合,中斷細胞因子介導的炎癥信號,從而抑制炎癥進展,而托拉利單抗是一種人源化TLR2 IgG4單克隆抗體,對IL-6也存在持續抑制作用[31], 這2種藥物均可通過抑制IL-6的生物作用抑制炎癥反應,未來或可成為UC的治療藥物。阿伐可泮是選擇性補體C5a受體抑制劑,C5a能夠調節IL-6、IL-8等促炎介質的表達[32]。阿伐可泮在抗中性粒細胞胞漿抗體(ANCA)相關血管炎的治療中取得了進展[33-34], 且補體C5a受體抑制劑可以預防IBD老鼠模型腸道炎癥的產生[35]。阿伐可泮可以抑制IL-6、IL-1β、TNF-α的產生,并促進抗炎因子IL-10、TGF-β的生成[36], 而IL-6、IL-1β、TNF-α、IL-10及TGF-β均在IBD的發生發展中發揮重要作用,故阿伐可泮未來或可成為UC的潛在治療藥物。
本研究從GEO數據庫獲取對IFX治療失應答UC患者的相關數據集,篩選出143個DEGs, 對DEGs進行GO和KEGG功能分析并進行PPI網絡構建,篩選出排名前20位的關鍵基因。應用DGIdb數據庫對關鍵基因進行分析發現,薩利魯單抗、阿伐可泮、托拉利單抗是對IFX失應答的UC患者可能的有效治療藥物,為UC的進一步臨床研究提供了新的視角。

