運動疲勞小鼠皮層-紋狀體突觸可塑性受損的機制研究
馬 婧,陳慧敏,張凌韜,劉曉莉,喬德才
運動疲勞(exercise-induced fatigue,EF)在競技運動中普遍存在,它不僅嚴重影響運動員運動技能的執行,并且影響運動員的注意力和信息處理等認知功能(閆東旭等,2019)。長期運動疲勞導致神經肌肉功能下降,從而增加運動員的損傷風險(郭浩等,2021),并可能對其身心健康造成嚴重危害。因此,探究運動疲勞的中樞調控機制至關重要,但目前運動疲勞的發生或維持機制尚未被完全揭示。
皮層-紋狀體突觸可塑性被認為是隨意運動、運動技巧性學習以及習慣性行為的細胞機制(Di Filippo et al.,2009),運動技巧性學習能夠使人腦的突觸可塑性發生變化(劉展,2020;任占兵等,2019)。皮層-紋狀體突觸可塑性能夠調節基底神經節環路的功能,從而調控運動。其主要有兩種表現形式,即長時程增強(long-term potentiation,LTP)和長時程抑 制(long-term depression,LTD)。紋狀體同時接受皮層和丘腦的Glu能神經投射,以及黑質的DA能神經投射(Kreitzer et al.,2008;Kuhlmann et al.,2021),因此,皮層-紋狀體突觸可塑性同時受Glu能系統和DA能系統的調控。研究證實,皮層-紋狀體通路LTP依賴于通過NMDA受體內流的Ca2+,以及NMDA受體和多巴胺1型受體(dopamine 1 receptor,D1R)的共同激活(Chepkova et al.,2012,2013)。而皮層-紋狀體通路LTD依賴于通過L型Ca2+通道內流的Ca2+,以及代謝型谷氨酸1型受體(metabotropic glutamate receptor 1,mGluR1)、多巴胺2型受體(dopamine 2 receptor,D2R)和大麻素1型(cannabinoid 1,CB1)受體的共同激活(Chepkova et al.,2012;Gubellini et al.,2004)。研究發現,運動能夠影響多巴胺能信號通路,增強多巴胺能系統的功能(馮俊鵬等,2019),并且多種運動功能障礙都與皮層-紋狀體的突觸可塑性異常有關,如亨廷頓舞蹈病(Huntington’s disease,HD)、帕金森病(Parkinson’s disease,PD)和肌張力障礙(dystonia)等模式動物都表現出皮層-紋狀體通路的LTP和/或LTD受損(時凱旋 等,2021;Ghiglieri et al.,2019;Nouhi et al.,2017;Peterson et al.,2010)。運動疲勞后小鼠也會出現動作不協調、遲緩僵硬等行為表現,但鮮見關于運動疲勞后皮層-紋狀體突觸可塑性的變化研究。
前期利用場電位和膜片鉗技術研究發現,小鼠運動疲勞后皮層-紋狀體的LTP和LTD均受損,紋狀體中型棘狀神經元(medium spiny neurons,MSNs)自發型興奮性突觸后電流(spontaneous excitatory postsynaptic currents,sEPSCs)的幅度不變,但sEPSCs的頻率升高,雙脈沖反應比值(paired-pulse ratio,PPR)降低,NMDA/AMPA電流比值降低(Ma et al.,2018)。這些結果表明,小鼠運動疲勞后皮層-紋狀體通路的雙向突觸可塑性受損,突觸前Glu釋放的概率升高,AMPA受體的功能不變,但NMDA受體的功能降低。
由于皮層-紋狀體突觸可塑性受Glu能系統和DA能系統的雙重調控,因此,在前期研究發現運動疲勞小鼠皮層-紋狀體突觸可塑性受損的基礎上,本研究從Glu能系統和DA能系統入手,分別采用高效液相色譜分析(high performance liquid chromatography,HPLC)和免疫印跡(Western Blot)技術,檢測紋狀體腦區Glu、DA的濃度,以及Glu受體和DA受體的表達含量,以期進一步揭示小鼠運動疲勞后皮層-紋狀體突觸可塑性受損的分子機制。
1 材料與方法
1.1 實驗動物與分組
2月齡雄性C57BL/6小鼠(北京維通利華實驗動物技術有限公司)分籠飼養,自由進食飲水,自然光照,室溫(22±2)℃,相對濕度(50±10)%。小鼠適應性飼養3天后,隨機分為對照組(Control,n=24)和運動疲勞組(EF,n=26)。
1.2 運動疲勞小鼠模型的建立
運動疲勞小鼠模型的創建方法同前期研究(馬婧等,2018)。首先,對小鼠進行連續3天的適應性跑臺訓練,15 min/天,跑臺速度為10 m/min。檢測每只小鼠的最大運動速度,檢測方法:小鼠以5 m/min的速度熱身運動3 min后,將速度提高至10 m/min運動1 min,隨后速度提高1 m/min,直到小鼠跟不上跑臺速度,持續退落至跑臺后方,該速度即為小鼠的最大運動速度。其次,進行連續7天的重復力竭跑臺運動:以5 m/min的速度熱身運動3 min后,將跑臺速度設定為小鼠最大運動速度的85%,以此速度使小鼠持續運動至力竭。力竭的判定標準:小鼠不能維持預定速度,長期滯留于跑道后方不動,使用手連續觸碰驅趕仍無效,并伴有呼吸急促、腹臥跑臺、垂頭不起等行為表現。Control小鼠暴露在相同的環境中,但不進行跑臺運動。
1.3 高效液相色譜分析實驗
1.3.1 小鼠紋狀體勻漿樣品制備
小鼠運動疲勞建模完成后即刻,對小鼠腹腔注射水合氯醛(400 mg/kg)麻醉處死。冰浴中快速分離雙側紋狀體,以1∶10(組織質量/高氯酸體積)的體積比加入0.1 N的高氯酸,冰浴中勻漿,4℃14 000 r/min離心15 min后取上清液,用0.22 μm的濾膜過濾,再次4℃14 000 r/min離心15 min后取上清液,置于-80℃冰箱中保存待測。
1.3.2 柱前衍生熒光檢測法測定Glu濃度
稱取Glu標準品,利用0.1 N的高氯酸溶解分別配制濃度為10、1、0.1、0.01、0.001 μmol/L的Glu標準溶液。配制流動相A(0.1 mol/L磷酸二氫鉀溶液,pH 6.6)和流動相B(40%純甲醇)溶液,真空抽濾,超聲波震蕩脫氣。首先進行儀器管道的清洗,設定流動相的速度為1 mL/min,排空管內的氣體。調節流速為0.1~0.2 mL/min,連接色譜柱(QU-3C18-15021)和熒光檢測器(RF-20A),柱溫箱溫度設定為25℃,熒光檢測器的激發波長設為357 nm,發射波長設為455 nm。吸取20 μl的標準品溶液/樣品勻漿液,加入10 μl鄰苯二甲醛(OPA)衍生試劑和10 μl Na2CO3緩沖液,充分混勻后靜置30 s,微量進樣針抽取20 μl進樣到HPLC系統中檢測。
利用Glu標準品的不同濃度(10、1、0.1、0.01、0.001μmol/L)及色譜中對應的峰面積,設標準品濃度為橫坐標x,峰面積為縱坐標y,計算得到Glu的標準曲線方程。將小鼠紋狀體勻漿液色譜圖中與標準品具有相同保留時間(±0.1 s)的色譜峰的峰面積帶入標準曲線,從而計算小鼠紋狀體勻漿液中的Glu濃度。
1.3.3 電化學檢測法測定DA濃度
稱取DA標準品,利用0.1 N的高氯酸溶解,分別配制成10、1、0.1、0.01、0.001 μmol/L 的標準液。流動相 A:將0.09 mol/L二水合磷酸二氫鈉溶液、0.001 7 mol/L辛烷基磺酸鈉、0.05 mol/L一水合檸檬酸和50 μmol/L的EDTA混合后,利用磷酸將其pH調至3.0。流動相B:純甲醇(10%恒流洗脫),使用前經0.22 μm有機膜過濾,超聲波震蕩脫氣,設置流動相的速度為0.2 mL/min。采用QU-3C18-15021色譜柱,柱溫箱溫度設定為30℃,工作電壓0.52 V,靈敏度為0.1 nA。微量進樣針抽取20 μl的標準品溶液/樣品勻漿液進樣到HPLC系統中進行檢測。
利用DA標準品的不同濃度(10、1、0.1、0.01、0.001μmol/L)及色譜中對應的峰面積,設標準品濃度為橫坐標x,峰面積為縱坐標y,計算得到DA的標準曲線方程。將小鼠紋狀體勻漿液色譜圖中與標準品具有相同保留時間(±0.1 s)的色譜峰的峰面積,帶入標準曲線,從而計算小鼠紋狀體勻漿液中的DA濃度
1.4 免疫印跡實驗
小鼠運動疲勞建模完成后即刻,對小鼠腹腔注射水合氯醛(400 mg/kg)麻醉處死。冰浴中快速分離紋狀體,利用膜蛋白提取試劑盒提取紋狀體膜蛋白。將蛋白質樣品置于95℃下,煮沸5 min,使蛋白變性。濃縮膠恒壓80 V電泳約30 min,待樣品進入分離膠后,恒壓110 V電泳約100 min。4℃恒流0.25 A的條件下,采用濕轉法轉膜3 h。隨后用5%脫脂奶粉-TBST室溫下封閉PVDF膜1 h。TBST洗3次,每次10 min。加入2.5%脫脂奶粉-TBST配置的各一抗溶液,4℃孵育過夜。TBST洗3次,每次10 min。5%脫脂奶粉-TBST配置辣根過氧化物酶標記的山羊抗兔二抗(1∶10 000,Sigma,R4880)室溫孵育1 h。TBST洗3次,每次10 min(馬婧等,2018)。利用化學發光法進行顯影定影,Quantity One軟件掃描目的蛋白以及內參的灰度值,將Control小鼠中目的蛋白與內參的比值標準化為100%,EF以與Control小鼠的比值表示。
目的蛋白和內參的一抗濃度及型號信息如下:GluR1,1∶1 000,Abcam ab109450;GluR2,1∶1 000,Abcam ab52932;mGluR1,1∶1 000,CST 12551S;D1R,1∶1 000,Abcam ab81296;D2R,1∶1 000,Millipore AB5084P;β-actin,1∶10 000,Sigma A2066)。
1.5 數據處理
所有數據均以Mean±SEM表示。利用Student’s t-test分析組間差異。雙側*P<0.05定義為有統計學差異,**P<0.01為差異顯著,***P<0.001為差異極顯著。
2 結果
2.1 運動疲勞后小鼠紋狀體Glu能系統的變化
2.1.1 紋狀體Glu含量的變化
Glu標準品和小鼠紋狀體勻漿液的色譜圖如圖1所示。根據Glu標準品濃度(橫坐標x)和對應的色譜圖中峰面積(縱坐標y),計算得到Glu的標準曲線方程:y=369 845x+1 406 929(R2=0.978 3)。統計結果顯示,與Control小鼠相比,EF小鼠紋狀體Glu的濃度增加[Control:(8.86±1.57)×10-6mol/L,n=7;EF:(14.23±1.33)×10-6mol/L,n=7;Student’s t-test,P<0.05;圖2],表明小鼠運動疲勞后紋狀體腦區Glu的含量增加。這與前期研究利用膜片鉗技術發現的運動疲勞后小鼠紋狀體突觸前Glu的釋放概率升高結果一致(Ma et al.,2018)。
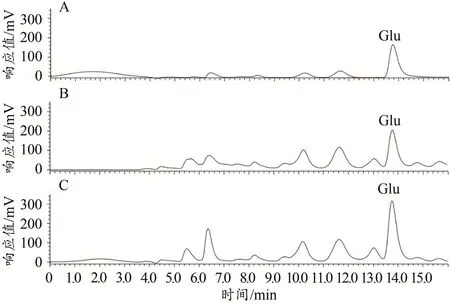
圖1 Glu標準品和紋狀體勻漿液的高效液相色譜圖Figure 1.The HPLC Chromatograms of Glu Standards and Striatal Homogenates
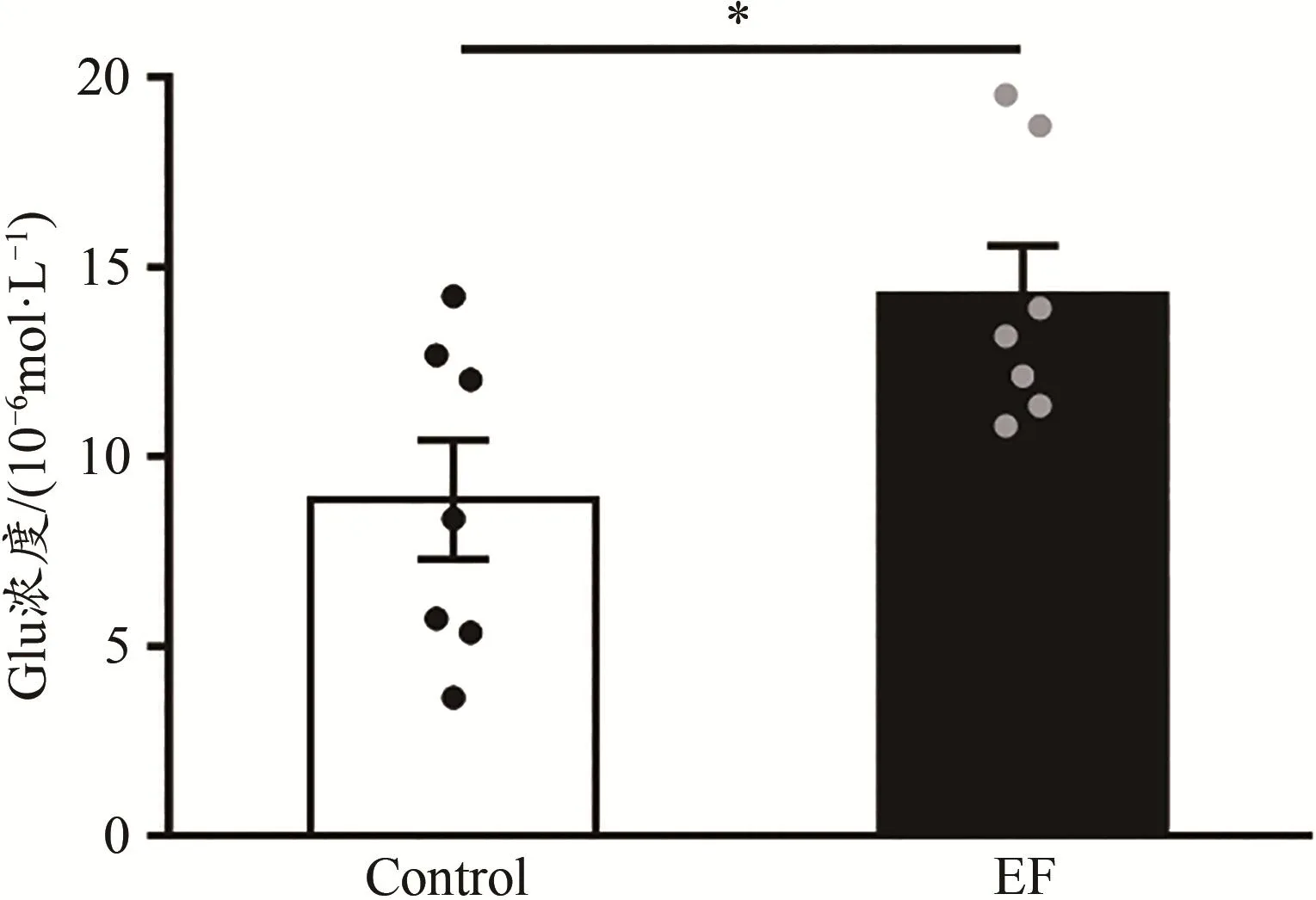
圖2 運動疲勞組與對照組小鼠紋狀體Glu的濃度對比Figure 2.Comparison of Striatal Glu Concentration between EF and Control Mice
2.1.2 紋狀體Glu受體表達含量的變化
2.1.2.1 紋狀體AMPA受體表達含量的變化
AMPA受體是離子通道型Glu受體的一種,介導哺乳動物大腦中的快速興奮性突觸傳遞。AMPA受體在紋狀體腦區表達豐富,GluR1亞基和GluR2亞基是紋狀體AMPA受體的主要組成亞基,在MSNs和中間神經元中廣泛存在(Mao et al.,2013)。
利用Western Blot技術,檢測紋狀體膜蛋白中GluR1亞基和GluR2亞基的表達含量。結果顯示,EF小鼠紋狀體GluR1的表達含量與Control小鼠相比無差異[Control:(100.00±10.60)%,n=6;EF:(98.85±8.90)%,n=7;Student’s t-test,P>0.05;圖3A、圖3B],GluR2的表達也正常[Control:(100.00±5.07)%,n=7;EF:(98.93±4.57)%,n=7;Student’s t-test,P>0.05;圖3C、圖3D]。EF小鼠紋狀體GluR1亞基和GluR2亞基的表達正常,提示,運動疲勞不影響紋狀體AMPA受體的表達。
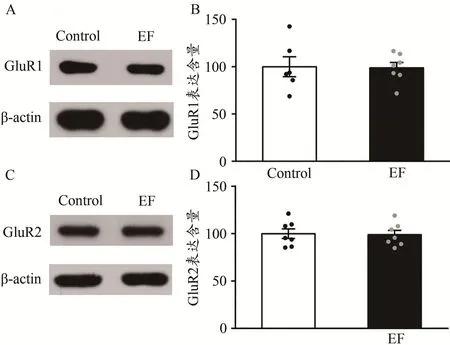
圖3 運動疲勞組與對照組小鼠紋狀體GluR1、GluR2的蛋白表達比較Figure 3.Comparison of Expression of GluR1 and GluR2 in Striatum between EF and Control Mice
2.1.2.2 紋狀體mGluR1表達含量的變化
mGluR1為代謝型Glu受體的一種,已有研究證實,皮層-紋狀體LTD依賴于mGluR1(Gubellini et al.,2001)。因此,為了檢測mGluR1是否參與運動疲勞對小鼠皮層-紋狀體LTD的損害,利用Western Blot技術檢測了紋狀體mGluR1的表達含量。結果顯示,EF小鼠紋狀體膜蛋白中mGluR1的含 量 顯 著降低[Control:(100.00±9.88)% ,n=6;EF:(47.27±8.90)%,n=7;Student’s t-test,P<0.01;圖4]。提示,小鼠運動疲勞后紋狀體mGluR1的表達下調,mGluR1的表達下調貢獻于運動疲勞對小鼠皮層-紋狀體LTD的損害。
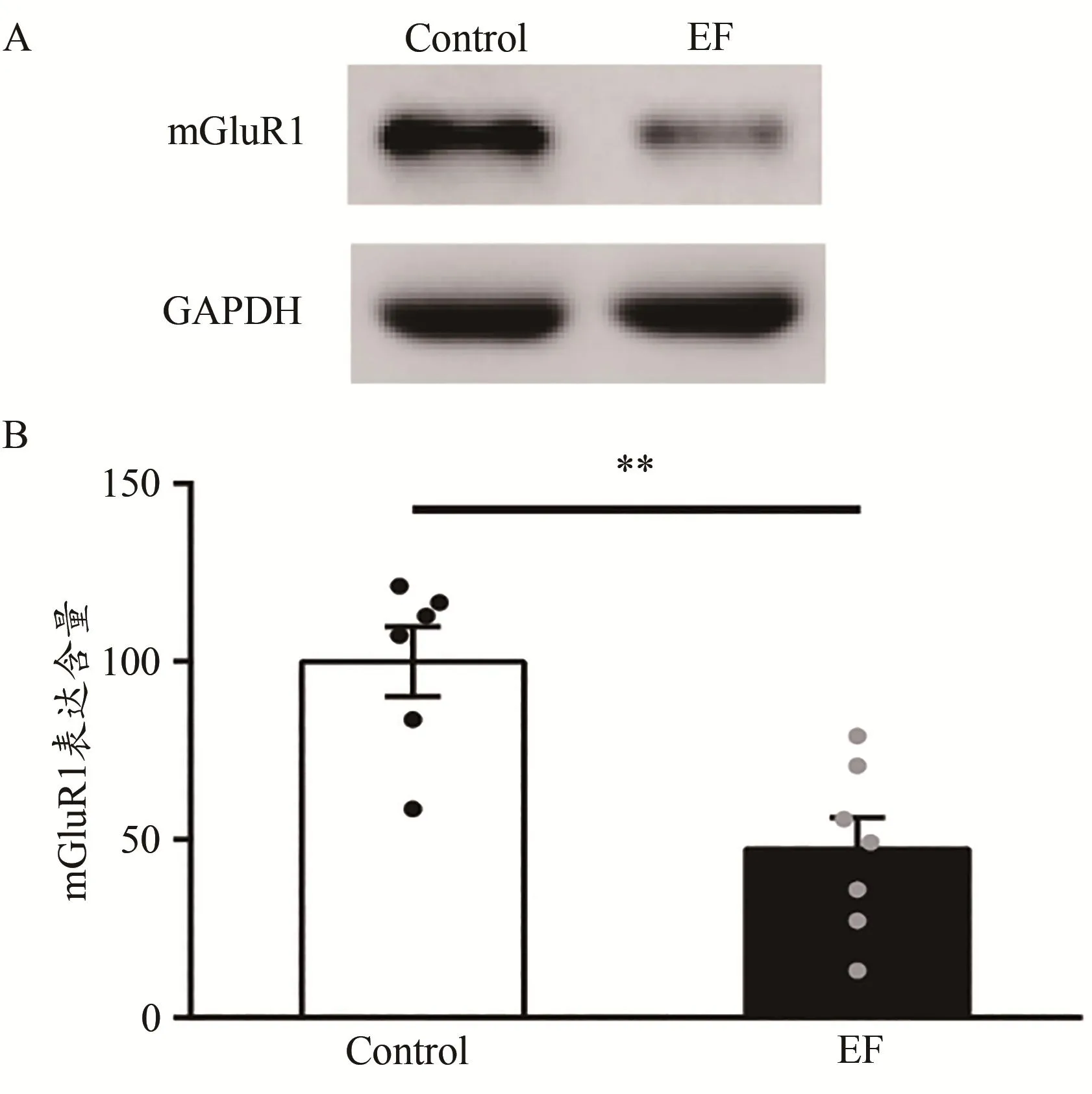
圖4 運動疲勞組與對照組小鼠紋狀體mGluR1的蛋白表達比較Figure 4.Comparison of Expression of mGluR1 in Striatum between EF and Control Mice
2.2 運動疲勞后小鼠紋狀體DA能系統的變化
除了Glu能系統,皮層-紋狀體突觸可塑性也受DA能系統的調控。激活紋狀體DA能系統對于自主運動以及誘導皮層-紋狀體突觸可塑性均為必需(Centonze et al.,2003)。因此,為了探究運動疲勞是否還通過影響DA能系統,進而影響皮層-紋狀體突觸可塑性,本研究對運動疲勞后小鼠紋狀體DA能系統的變化也進行了探究。
2.2.1 紋狀體DA含量的變化
DA標準品和小鼠紋狀體勻漿液的色譜圖如圖5所示。根據DA標準品的濃度(橫坐標x)和對應的色譜圖中峰面積(縱坐標y),計算得到DA的標準曲線方程:y=114 473x+248 273(R2=0.948 3)。結果顯示,與Control小鼠相比,EF小鼠紋狀體DA的濃度顯著降低[Control:(6.76±0.88)×10-6mol/L,n=5;EF:(2.36±0.90)×10-6mol/L,n=5;Student’s t-test,P<0.01;圖6],表明小鼠運動疲勞后紋狀體DA的含量降低。
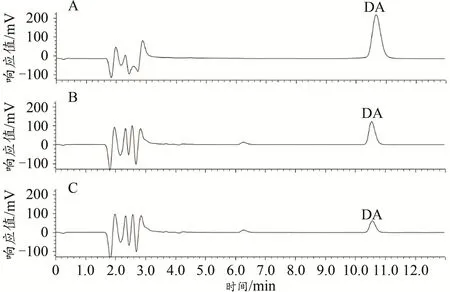
圖5 DA標準品和紋狀體勻漿液的高效液相色譜圖Figure 5.The HPLC Chromatograms of DAStandards and Striatal Homogenates
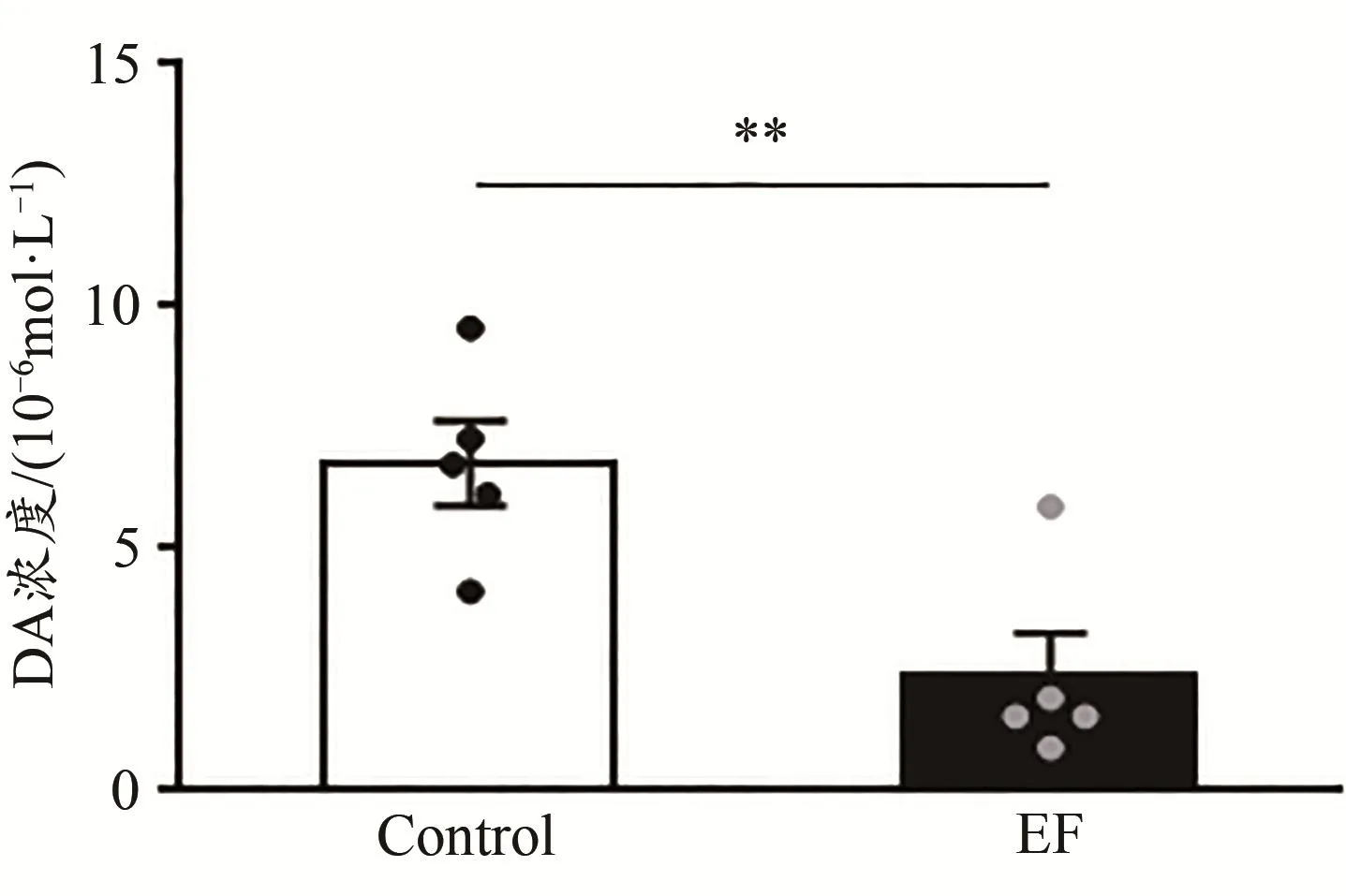
圖6 運動疲勞組與對照組小鼠紋狀體DA的濃度對比Figure 6.Comparison of Striatal DAConcentration between EF and Control Mice
2.2.2 紋狀體DA受體表達含量的變化
紋狀體中DA受體主要有兩種類型,即D1R和D2R,兩者具有不同的作用。其中,D1R位于直接通路的MSNs中,對于誘導皮層-紋狀體LTP為必需,而D2R位于間接通路的MSNs中,對于誘導皮層-紋狀體LTD為必需(Calabresi et al.,2019)。
采用Western Blot技術,檢測兩組小鼠紋狀體膜蛋白中D1R和D2R的表達含量。統計顯示,EF小鼠紋狀體D1R的表達含量顯著降低[Control:(100.00±2.44)%,n=6;EF:(60.46±5.85)% ,n=7;Student’s t-test,P<0.001;圖7A、圖7B]。并且,EF小鼠D2R的表達含量也顯著降低[Control:(100.00±5.45)%,n=6;EF:(54.70±7.85)%,n=7;Student’s t-test,P<0.001;圖7C、圖7D]。提示,小鼠運動疲勞后紋狀體D1R、D2R的表達均下調,D1R的表達下調可能與皮層-紋狀體LTP受損有關,而D2R的表達下調可能與皮層-紋狀體LTD受損有關。
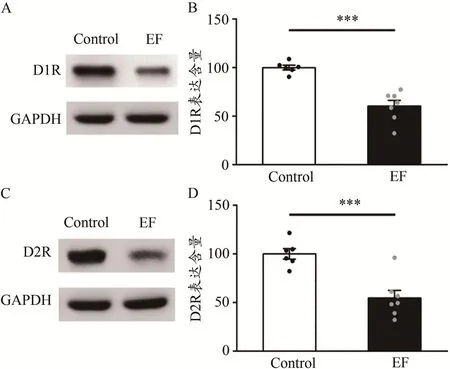
圖7 運動疲勞組與對照組小鼠紋狀體D1R、D2R的蛋白表達比較Figure 7.Comparison of Expression of D1R and D2R in Striatum between EF and Control Mice
3 討論
3.1 Glu能系統在運動疲勞損害皮層-紋狀體突觸可塑性中的作用
前期研究發現,EF小鼠MSNs的sEPSC頻率升高、PPR降低,兩者一致表明,小鼠運動疲勞后紋狀體突觸前Glu的釋放概率升高(Ma et al.,2018)。本研究采用HPLC技術進一步檢測紋狀體Glu的濃度,發現小鼠運動疲勞后紋狀體Glu的濃度升高。運動疲勞后,小鼠紋狀體Glu的含量以及釋放增多,提示,紋狀體接受來自皮層椎體神經元的興奮性Glu能神經投射增強。本研究認為,運動疲勞造成紋狀體Glu能神經投射增強,可能形成天花板效應,已經使突觸強度達到了飽和,因此給予皮層重復高頻刺激時,無法使突觸強度再進一步增強,從而抑制了皮層-紋狀體LTP的形成,這可能是運動疲勞后小鼠皮層-紋狀體LTP受損的分子機制之一。而且,紋狀體Glu能神經投射增強,Glu的過度累積也可能是直接導致皮層-紋狀體LTD受損的機制之一。
AMPA受體是紋狀體腦區介導快速興奮性突觸傳遞的一種離子通道型Glu受體(陳艷清等,2020)。采用Western Blot檢測紋狀體AMPA受體GluR1亞基和GluR2亞基的表達含量,發現EF小鼠紋狀體GluR1亞基和GluR2亞基的表達含量均正常,運動疲勞不影響紋狀體AMPA受體的表達。前期膜片鉗實驗結果顯示,EF小鼠sEPSCs的幅度正常(Ma et al.,2018)。由于記錄的sEPSCs為AMPA受體介導的突觸后電流,因此sEPSCs的幅度正常表示小鼠運動疲勞后紋狀體AMPA受體的功能正常。結合這兩項實驗結果,運動疲勞后紋狀體AMPA受體的表達含量和功能均未見改變,表明小鼠運動疲勞后皮層-紋狀體突觸可塑性的異常并非是由于AMPA受體異常導致的。
NMDA受體是另一種離子通道型Glu受體,NMDA受體的激活,以及通過NMDA受體內流的Ca2+對于誘導皮層-紋狀體 LTP為必需(Kuhlmann et al.,2021;Shen et al.,2008)。前期實驗結果顯示,EF小鼠紋狀體NMDA/AMPA電流比值降低,提示,小鼠運動疲勞后紋狀體NMDA受體的功能下調(Ma et al.,2018)。NMDA受體的功能下調使內流的Ca2+較少,胞內Ca2+較低,不足以成功誘導LTP,這可能是運動疲勞損害皮層-紋狀體通路LTP的另一個原因。
mGluR1是一種代謝型Glu受體,皮層-紋狀體LTD依賴于mGluR1。本研究采用Western Blot檢測mGluR1的表達含量,發現EF小鼠紋狀體mGluR1的表達含量顯著降低。皮層椎體神經元釋放的Glu與紋狀體MSNs突觸后膜上的mGluR1結合,激活G蛋白,與通過L型Ca2+通道內流的Ca2+兩者共同作用,促使磷脂酰肌醇在磷脂酶C的作用下,經過一系列級聯反應,合成內源性大麻素2-AG(張凌韜等,2018)。釋放到突觸間隙后,2-AG逆行回突觸前膜,與突觸前膜上的內源性大麻素受體——CB1受體結合,激活CB1受體,繼而通過下游一系列分子的作用,最終減少突觸前Glu的釋放,形成內源性大麻素依賴的LTD(endocannabinoid-dependent LTD,eCB-LTD)(Robbe et al.,2002),這就是皮層-紋狀體eCB-LTD的形成過程。內源性大麻素2-AG的合成依賴于mGluR1。因此,本研究認為,運動疲勞后小鼠紋狀體mGluR1的表達下調造成內源性大麻素2-AG的合成減少,從而不利于突觸前Glu釋放的減少,使皮層-紋狀體LTD受損。前期研究發現,EF小鼠紋狀體CB1受體的表達上調(馬婧等2018),這可能是機體對于Glu過度積累、LTD受損做出的一種代償反應。
3.2 DA能系統在運動疲勞損害皮層-紋狀體突觸可塑性中的作用
除了接受來自皮層的Glu能神經投射,紋狀體還接受來自黑質的DA能神經投射(王炳蔚等,2016)。黑質DA神經元釋放DA,與紋狀體MSNs突觸后膜上的D1R和D2R結合。在背內側紋狀體微量注射D1R和D2R的拮抗劑,能夠顯著損害運動學習行為,提示,DA能系統在直接和間接通路上的調節作用為必需(Diao et al.,2021)。DA與D1R結合,激活D1R對于誘導皮層-紋狀體LTP為必需。使用D1R的拮抗劑或者D1R被敲除的小鼠紋狀體均不能成功誘導出 LTP(Kerr et al.,2001;Lovinger et al.,2003)。激活D1R后能夠增強環磷酸腺苷和蛋白激酶A的活性,從而促進LTP的產生(Miranda-Barrientos et al.,2014)。DA與D2R結合,激活D2R對于誘導皮層-紋狀體LTD為必需(Kreitzer et al.,2007)。DA能系統異常能夠損害皮層-紋狀體突觸可塑性。例如,在PD模式動物中,紋狀體DA能神經投射的缺失導致紋狀體LTP和LTD的雙向受損(Calabresi et al.,2007)。
為了探究運動疲勞后小鼠皮層-紋狀體LTP和LTD的受損,是否與DA能系統異常有關,本研究對運動疲勞后小鼠紋狀體的DA能系統進行了檢測。實驗結果顯示,EF小鼠紋狀體DA的濃度降低,D1R和D2R的表達含量也降低,提示,小鼠運動疲勞后紋狀體接受的DA能神經投射減少。這與侯莉娟等(2018)采用免疫組織化學染色觀察到的大鼠運動疲勞后D1R和D2R蛋白表達下調的結果一致。小鼠運動疲勞后,紋狀體接受的DA能神經投射減少,DA的含量降低,D1R的表達下調,可能是導致皮層-紋狀體LTP受損的分子機制之一;而紋狀體DA的含量降低,D2R的表達下調,可能是導致皮層-紋狀體LTD受損的分子機制之一。
李科等(2019)利用光遺傳技術激活DA能系統改善大鼠運動疲勞后紋狀體α和β頻段震蕩的異常,證實DA能系統在調控運動疲勞中發揮重要作用。前期研究發現,小鼠運動疲勞后MSNs的內在膜特性不變、突觸前Glu的釋放增多、NMDA受體的功能下調(Ma et al.,2018)。本研究進一步發現,小鼠運動疲勞后紋狀體DA能神經投射減少。這與已有研究報道的DA能神經投射缺失不影響紋狀體MSNs的內在膜特性,但是卻增加皮層-紋狀體突觸終末的Glu濃度和釋放(Calabresi et al.,1993;Lindefors et al.,1990),以及下調NMDA受體的功能(Steiner et al.,2010)相一致。提示,在正常的生理狀況下,內源的DA能神經投射對Glu能突觸傳遞起著負向的調節作用(余鋒 等,2020;Pisani et al.,2005)。因此,本研究認為,運動疲勞導致小鼠紋狀體DA能神經投射減少,DA含量降低,D1R和D2R的表達降低,DA能系統功能下調,進而引起紋狀體Glu的濃度和釋放增多、NMDA受體的功能降低,從而損害了小鼠皮層-紋狀體通路的LTP和LTD,造成了小鼠的運動功能障礙。
4 結論
探討小鼠運動疲勞后皮層-紋狀體突觸可塑性受損的神經分子機制,發現小鼠運動疲勞后紋狀體Glu能系統出現異常,具體表現為Glu的含量增多,mGluR1的表達下調;小鼠運動疲勞后紋狀體DA能神經投射減少,DA能系統的功能下調,具體表現為DA的含量降低,D1R和D2R的表達下調。Glu能系統和DA能系統的雙重異常可能是導致小鼠運動疲勞后皮層-紋狀體突觸可塑性受損的原因之一。

