腔隙性腦梗死腦白質病變與腦微出血的相關性研究
李萬春, 孟晏莉, 單志愿
腦小血管疾病病理進程包括腦白質病變(white matter lesion,WML)和腦微出血(cerebral microbleeds,CMBs)兩個方面,目前研究普遍認為WML和CMBs均可引發腔隙性腦梗死(lacunar infarction,LI),二者在缺血性卒中患者中的發病率分別為25%和27%[1]。基礎研究表明,WML和CMBs的發生與血腦屏障損傷密切相關,嚴重WML和CMBs是造成LI的重要原因,WML和CMBs的出現可導致病情迅速進展,引起認知功能障礙,并最終導致患者死亡等不良預后[2]。但對于WML和CMBs在LI患者發病中的相互關系卻少有研究,鑒于此,本研究通過對LI患者臨床資料進行回顧性分析,分析不同CMBs嚴重程度患者的臨床特點,并探討LI患者WML與CMBs合并發病的相關因素,旨在為臨床早期判斷和防治提供理論依據,現將結果報道如下。
1 材料和方法
1.1 一般資料 選取2017年1月-2019年5月期間在本院就診的129例LI患者作為研究對象,129例患者中男性68例,女性61例,年齡30~94歲,平均年齡(57.34±13.07)歲。患者均接受頭部MRI和頸動脈超聲檢查,結果符合《中國急性缺血性腦卒中預防和治療指南》[3]中有關LI的診斷標準。排除急性期腦梗死、腦出血、腦腫瘤者或合并有腦外傷、精神疾病以及其他原因所致的非血管性腦白質病變者;排除合并有器官功能衰竭、中毒、感染、惡性腫瘤、代謝綜合征等嚴重內科疾病者。
1.2 方 法
1.2.1 資料收集 收集129例患者基本資料和實驗室指標水平,基本資料包括年齡、性別、體重指數、煙酒飲酒史及合并基礎疾病。實驗室指標包括高密度脂蛋白(high-density lipoprotein,HDL-C)、低密度脂蛋白(low-density lipoprotein,LDL-C)、高敏C反應蛋白(high sensitivity C-reactive protein,hs-CRP)及同型半胱氨酸(homocysteine,Hcy)。
1.2.2 WML病情評估 患者均接受MRI檢查,根據MRI檢查結果,根據腦白質病變評分量表(white matter lesion scale,WMLs),即Fazekas分級標準對患者病情程度進行評估。該量表評估包括腦室周圍病變和深部白質病變兩個方面,其中腦室周圍病變評分標準:無高信號病灶為0分;帽狀或鉛筆狀薄性病變為1分;病變部位顯示光滑暈圈為2分(見圖1);病變周圍強度不規整,并向白質深部延伸為3分。深部白質病變評分標準:無高強度信號為0分;斑點樣病變為1分;病灶有融合表現為2分;病灶呈大面積融合為3分。將兩部分評分相加即為WML病情評分。

圖1 顱內多發點狀、片狀脫髓鞘,部分融合;圖2 顱內白質多發點片狀脫髓鞘并多發微出血灶
1.2.3 CMBs病情評估 根據MRI檢查結果對CMBs嚴重程度進行分級,病灶判斷依據MRI梯度回波T2*成像上直徑2~10 mm類圓形或圓形信號缺失區或減低區。無CMBs病灶為0級;1~5個病灶為1級;6~10個病灶為2級(見圖2);>10個病灶為3級,根據CMBs分級將患者分為無出血組(0級,n=20)、輕度組(1級,n=60)、中度組(2級,n=37)及重度組(3級,n=12)。
1.2.4 頸動脈硬化評估 采用彩色多普勒超聲系統測定頸動脈內膜中層厚度(carotid intima media thickness,CIMT),以頸總動脈、頸動脈分叉處、頸內動脈和頸外動脈3次測量結果平均值為CIMT標準值,根據同側頸動脈血管內單個動脈粥樣硬化斑塊的最大厚度之和進行頸動脈斑塊積分評定,<1.2 mm為0分;1.2~2.0 mm為1分;2.1~4.0 mm為2分;單個斑塊CIMT>4 mm則為3分。
2 結 果
2.1 不同病情程度患者基本資料比較 不同CMBs病情程度患者年齡和高血壓合并癥發生情況比較,差異有統計學意義(P<0.05)(見表1)。
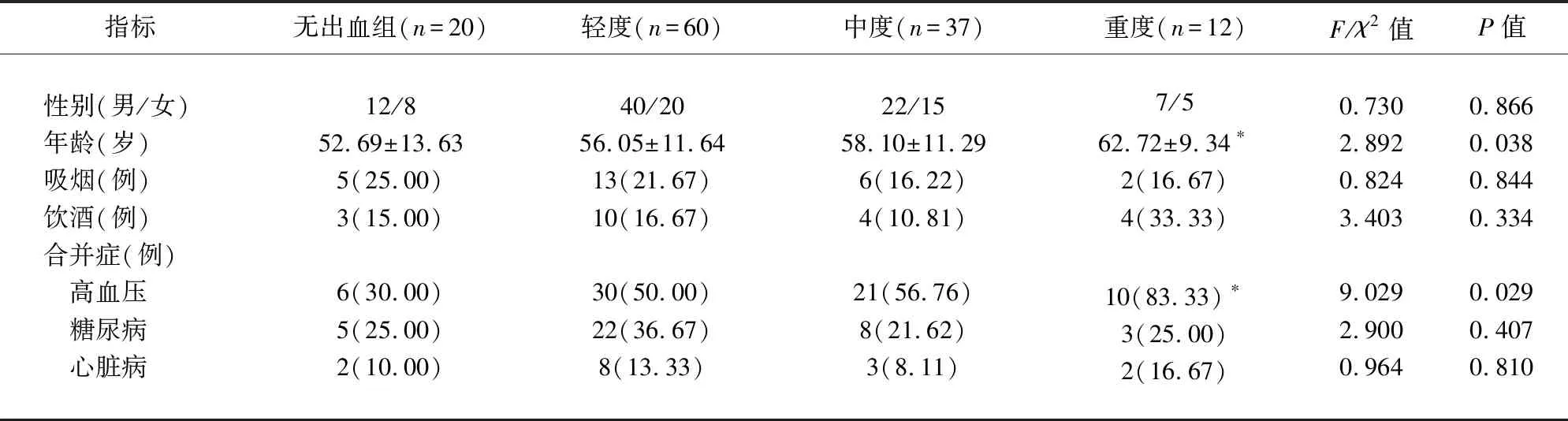
表1 不同病情程度患者基本資料比較
2.2 不同病情程度患者實驗室指標比較 不同CMBs病情程度患者血清HDL-C、LDL-C、hs-CRP、Hcy、CIMT及頸動脈斑塊積分水平比較,差異均有統計學意義(P<0.05)(見表2)。

表2 不同病情程度患者實驗室指標比較
2.3 不同CMBs分級與WMLs評分相關性分析 LI合并WML無CMBs患者與伴有CMBs患者WMLs評分比較,差異具有統計學意義(P<0.05);不同CMBs分級患者WMLs評分差異亦有統計學意義(P<0.05)(見表3)。

表3 不同病情程度患者WMLs評分[M(Q1,Q3)]
2.4 LI患者WML與CMBs合并發病的危險因素分析 129例患者中,無WML和CMBs患者12例,占比9.30%,合并單純WML患者8例,合并單純CMBs患者26例,而WML與CMBs合并發病患者83例,占比70.94%。經Logistic回歸分析,年齡、高血壓、HDL-C、Hcy及CIMT是影響LI患者WML與CMBs合并發病的獨立危險因素(P<0.05)(見表4)。
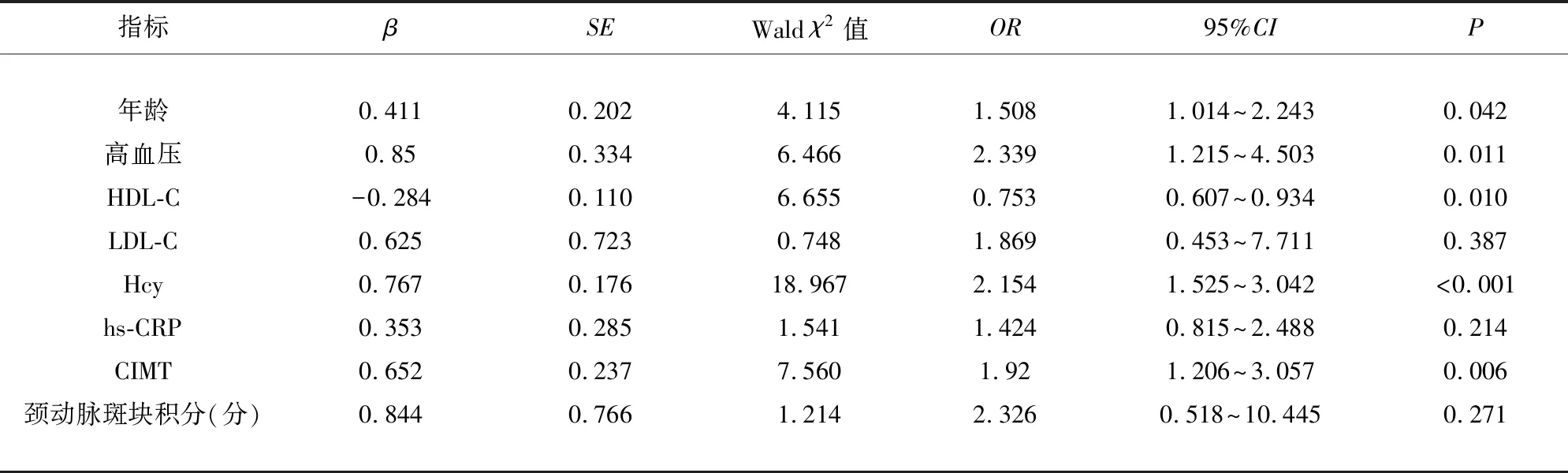
表4 LI患者WML與CMBs合并發病的危險因素分析
3 討 論
本次研究結果顯示,不同CMBs病情程度患者年齡、合并高血壓、頸動脈斑塊積分及CIMT水平存在顯著差異。高齡、高血壓病史作為影響腦血管疾病發生及疾病嚴重程度的重要影響因素,在既往的臨床研究中已得到普遍認可,并且有研究認為,對于中老年人群來說,年齡每增加10歲其發生腦小血管病變的風險可增加2~3倍[4]。髓磷脂和卵磷脂水平是構成腦白質髓鞘的重要蛋白,其水平隨著年齡增長而逐漸降低,因而隨著年齡增長,腦小血管病變風險逐漸增加。而高血壓作為諸多疾病發生的高危因素,也被證實在并發CMBs患者中收縮壓、舒張壓均顯著增高[5],這與本研究結果一致。張東等人通過Meta分析發現,運動期間收縮壓達到峰值水平是導致WML存在的決定性因素,持續高水平的收縮壓或舒張壓增高會影響WML病情進展,導致CMBs的發生,尤其是70歲以上患者在此情況下的表現最突出[6]。頸動脈斑塊積分和CIMT水平的變化可以客觀反映出患者頸動脈粥樣硬化的程度。WML包含缺血性和非缺血性改變,目前認為缺血性WML在臨床較為常見,主要與腦小血管壁損傷和腦血流灌注低下等基礎病歷變化有關。張偉等人通過對不同部位WML患者進行觀察發現,WML患者的頸動脈斑塊積分明顯高于正常人群,其中穩定斑塊積分在腦室周圍以及深部白質部位評分均呈增高特點,而不穩定斑塊積分以深部白質部位呈顯著增高改變,由此表明動脈粥樣硬化斑塊與WML發生密切相關,受斑塊性質的影響可能導致腦白質的病變部位和嚴重程度有所不同[7,8]。
CMBs和WML作為腦小血管病的常見病理改變,在腦血管疾病患者中均有較高的檢出率,也常共同發生。本次研究的129例患者中,無WML和腦微血管病變患者僅12例,占比9.30%,在發生腦小血管病變患者中,單純WML患者8例,單純腦微血管病變患者26例,而WML合并CMBs患者83例,占比70.94%。整體分析顯示,在LI患者中CMBs程度與WML程度兩者呈正相關,有學者認為,微血管病變是CMBs和WML發生的共同基礎[9],暫未發現有明確的發病先后的特點,這也是患者中存在單純CMBs和單純WML的原因。目前我國對于腦小血管病變的研究大多集中于單一病變患者,對于WML合并CMBs患者的研究較少。本研究通過對合并發病患者進行Logistic回歸分析顯示,除年齡、高血壓、CIMT等影響因素意外,HDL-C水平降低和Hcy水平增高成為合并發病的獨立危險因素。高水平收縮壓被認為是導致微小血管破裂出血的主要原因,其機制與血管內皮損傷、腦小動脈玻璃樣和纖維化病變所致的血管平滑肌細胞、彈力纖維大量丟失有關[10~12],因此相比WML,高水平收縮壓更容易造成CMBs的發生,成為WML合并CMBs的獨立危險因素。而HDL-C作為一種抗動脈硬化的血漿脂蛋白,臨床已普遍證實其水平與動脈管腔狹窄程度呈負相關,嚴重腦動脈硬化則可顯著增加患者腦微血管病變的發病風險。另外,Hcy作為甲硫氨酸循環代謝過程中的中間產物,其主要作用在于參與人體腎上腺素、膽堿、肉堿等多種物質的代謝過程,當人體代謝功能發生異常時,Hcy則會在血液中大量積累,甚至發展為高Hcy血癥。目前研究已證實,Hcy可作為急性LI的獨立診斷指標[13,14]。最新的研究結果表明,血Hcy水平與WML、CMBs呈正相關[15],這也提示Hcy水平異常可能成為WML和CMBs合并發病的早期信號,這對指導臨床早期干預具有實際的指導意義。因而,整合相關臨床檢測指標對于評估患者腦小血管病變程度及其發展趨勢具有可行性,但建立有效的預測模型不僅需要多中心大樣本研究,同時還需要明確WML、CMBs以及兩者共病在臨床表現中的差異性并進行分類研究。
綜上,LI患者WML嚴重程度與CMBs程度呈正相關,年齡增長、高血壓史、收縮壓高、低水平HDL-C、高水平Hcy以及CIMT增加是影響LI患者WMLs合并CMBs的危險因素。

