糙皮側耳對培養料中木質纖維素的降解研究
劉 芹,胡素娟,崔 筱,康源春,張玉亭,孔維麗
(河南省農業科學院 植物營養與資源環境研究所,河南 鄭州 450002)
我國是農業大國,秸稈資源豐富,對秸稈的綜合利用有利于減少農村面源污染,促進社會可持續發展[1]。秸稈的主要成分是木質纖維素(纖維素、木質素、半纖維素),其結構復雜堅固,難以破壞,傳統的化學處理工藝復雜且易造成環境污染[2]。利用農作物秸稈培養食用菌,不僅可以實現農林副產物的無害化、減量化、資源化利用,還可以收獲優質的蛋白質,具有較好的經濟效益和生態效益。
玉米產量在我國糧食作物中居第3位,僅次于稻、麥,該作物主要分布于黃淮海、東北和西南山區。玉米芯約占玉米產量的21%,是一種產量巨大的農副產品,來源廣泛,價廉易得[3]。目前,玉米芯除少部分用于制備糠醛、木糖醇外,絕大部分被直接燃燒或隨意堆置,造成資源浪費和環境污染。玉米芯組織均勻、硬度適宜、吸水性強,可用于黑木耳、雙孢蘑菇、糙皮側耳、杏鮑菇等食用菌的栽培[2-4]。糙皮側耳(Pleurotus ostreatus)年產量居世界食用菌產量的前列[5],具有豐富的營養(如蛋白質、礦物質和維生素),顯著的抗氧化、抗病毒、提高免疫力等生物活性,深受消費者的青睞[6]。糙皮側耳易于栽培,可以在各種農業副產物(玉米芯、秸稈、稻草等)上生長,其年產量在世界范圍內持續快速增長[2]。在生長發育過程中,糙皮側耳可以通過分泌多種胞外酶如纖維素酶、木聚糖酶、漆酶等將培養料中的木質纖維素進行降解,使其變成相對簡單的營養物質,以利于糙皮側耳的吸收利用[7]。
本研究以玉米芯為主料栽培糙皮側耳,檢測了糙皮側耳在不同生長期間對培養料中木質纖維素的降解以及相關降解酶的活性變化,并采用掃描和透射電子顯微鏡對培養料的微觀結構變化進行了觀察,旨在為研究糙皮側耳的營養生理,以及提高培養料的利用率、減少農業面源污染提供理論支撐。
1 材料和方法
1.1 供試菌株
糙皮側耳(Pleurotus ostreatus)由河南省食用菌種質資源庫提供。
1.2 培養料配方
玉米芯84%,麩皮10%,石灰5%,尿素1%,含水量68%。
1.3 試劑與儀器
玉米芯、麩皮、石灰、尿素購自本地農貿市場;羧甲基纖維素鈉(CMC-Na)、樺木木聚糖、ABTS和藜蘆醇購自美國Sigma公司;檸檬酸、硫酸錳、DNS試劑購自國藥集團化學試劑有限公司。BSA124S-CW天平(美國Sartorius公司)、D3024R高速冷凍離心機(美國Scilogex公司)、高速組織搗碎機(美國Cole-Parmer公司)、普析GWB-1純水儀(北京普析通用儀器有限責任公司)、PS-60AL超聲儀(深圳市雷德邦電子有限公司)、電熱鼓風干燥箱(龍口市先科儀器公司)、UV-2550紫外-可見分光光度儀(美國Lab Tech公司)。
1.4 糙皮側耳的栽培和取樣
根據以往的報道[8-9],制備糙皮側耳栽培用的發酵培養料。按照河南省地方標準《平菇發酵料栽培技術規程》(DB 41/T 1211─2016)進行糙皮側耳的栽培。分別在糙皮側耳菌絲萌發(T1)、發菌中期(T2)、發菌末期(T3)、現蕾期(T4)、子實體采收(T5,子實體七成熟)5個時期進行取樣。在每個生長時期各隨機選取9個不同的栽培袋,將其中的培養料揉碎,混合均勻后作為1個代表性的樣品,每個時期設3個重復。
1.5 培養料木質素、纖維素、半纖維素含量的測定
取在50 ℃下烘干的培養料樣品,按照中華人民共和國農業行業標準NY/T 3494─2019《農業生物質原料纖維素、半纖維素、木質素測定》進行木質素、纖維素、半纖維素含量的測定。
1.6 培養料木質素、纖維素、半纖維素的結構表征
1.6.1 培養料木質素、纖維素、半纖維素的單糖組成分析 根據張瑞[10]的方法進行木質素、纖維素、半纖維素組分的分離和提取,各組分的單糖組成分析通過裝備有Dionex ICS-5000 HPIC系統的離子交換層析儀進行[11]。對樣品(5.0 mg)采用2 mol/L的三氟乙酸在110 ℃下水解4 h,用甲醇去除三氟乙酸后,將水解產物溶于蒸餾水中;然后以12000 r/min的轉速離心5 min,收集水解液,經0.22 μm尼 龍 膜(MSI, Westborough, MA, USA)過濾后進樣。進樣體積10 μL,進樣方式為自動進樣。色譜柱為Dionex CarboPac PA-200陰離子交換柱(3 mm×250 mm),洗脫液為1 mmol/L NaOH,洗脫速度為0.45 mL/min。柱溫為30 ℃。與L-阿拉伯糖(Ara)、D-半乳糖(Gal)、D-葡萄糖(Glu)、D-木糖(Xyl)、D-甘露糖(Man)、葡萄糖醛酸(Glua)和半乳糖醛酸(Gala)標準品的保留時間比較進行單糖組分鑒定,并根據各吸收峰的峰面積計算各組分的質量分數。
1.6.2 培養料木質素、纖維素、半纖維素組分的分子量測定 木質素、纖維素、半纖維素分子量分布采用高效凝膠色譜(High performance gel permeation chromatography,HPGPC)進行檢測。將樣品上樣到配備有TSK-GEL G3000 SWXL凝膠色譜柱(300 mm×7.8 mm,柱溫35.0 ℃±0.1 ℃)的Agilent 1100高效液相色譜儀(Agilent, Santa Clara, CA, USA), 采 用0.05 mol/L的NaH2PO4-Na2HPO4緩沖液(pH 6.7,加0.05% NaN3)洗脫,流速為0.5 mL/min,洗脫峰采用示差折光檢測器檢測。參試樣品的分子量根據多糖標準品的分子量(738、5800、1.22×104、2.37×104、4.80×104、1.00×105、1.86×105、3.80×105和8.53×105Da)和保留時間進行計算[12]。
1.7 木質纖維素酶活力的檢測
1.7.1 粗酶液的制備 稱取培養料樣品10 g,加入5倍體積的蒸餾水,冰浴抽提2 h后進行勻漿,在4℃下以10000 r/min離心15 min,收集上清液作為粗酶樣品,用于酶活力的測定。
1.7.2 木質素過氧化物酶(LiP)活性的測定 在0.4 mL酶液中加入0.2 mL 10 mmol/L藜蘆醇溶液、0.4 mL 0.25 mol/L酒石酸緩沖液(pH值3.0),混勻,加入20 μL 20 mmol/L H2O2溶液,然后啟動反應,以未加H2O2溶液的反應體系為對照,檢測在波長310 nm處5 min前后反應液吸光值的變化[13]。將酶活力單位(U)定義為每分鐘每毫升反應體系轉化1 μmol藜蘆醇所需的酶量。
1.7.3 錳過氧化物酶(MnP)活性的測定 在0.2 mL酶液中加入0.8 mL 10 mmol/L MnSO4溶液,混勻,再加入20 μL 20 mmol/L H2O2溶液,然后啟動反應,以未加H2O2溶液的反應體系為對照,檢測在波長290 nm處5 min前后反應液吸光值的變化[14]。將酶活力單位(U)定義為每分鐘每毫升反應體系中將1 μmol Mn2+轉化為Mn3+所需要的酶量。
1.7.4 漆酶(Laccase)活性的測定 在10 μL酶液中加入190 μL 1 mmol/L ABTS溶液(pH值4.6),在30 ℃下反應10 min;再加入300 μL 5%三氯乙酸終止反應,測定在波長405 nm處的吸光值[15]。對照組采用10 μL加熱失活的酶液,其余條件相同。將酶活力單位(U)定義為每分鐘每毫升反應體系產生1個吸光值所需要的酶量。
1.7.5 木聚糖酶(Xylanase)活性的測定 在1 mL酶液中加入1 mL 1%的木聚糖溶液,在50 ℃下反應10 min;再加入2 mL DNS試劑,沸水浴10 min;取出立即冷卻,加蒸餾水定容至10 mL,測定波長520 nm處的吸光值[16]。還原糖含量根據木糖的標準曲線進行計算。將酶活力單位(U)定義為每分鐘每毫升反應體系產生1 μmol木糖所需要的酶量。
1.7.6 纖維素酶(Cellulase)活性的測定 在0.25 mL酶液中加入0.75 mL 1%的CMC-Na溶液,在50 ℃下反應10 min;再加入0.75 mL DNS試劑,沸水浴10 min;取出立即冷卻,加蒸餾水定容至10 mL,測定波長520 nm處的吸光值[17]。還原糖含量根據葡萄糖的標準曲線進行計算。將酶活力單位(U)定義為每分鐘每毫升反應體系產生1 μmol葡萄糖所需要的酶量。
1.8 電鏡觀察分析
1.8.1 掃描電鏡分析 取材固定:隨機選取培養料中的玉米芯顆粒,切取組織面積不超過3 mm2,迅速投入電鏡固定液固定。將固定好的樣品采用0.1 mol/L磷酸緩沖液(pH值7.0)漂洗4次,每次20 min。在用1%鋨酸后固定2 h后,再用雙蒸水漂洗樣品2次,每次15 min。將樣品采用不同濃度(30%、50%、70%、80%、90%、95%、100%、100%)的乙醇進行逐級脫水,每次15 min;再用乙酸異戊酯脫水15 min。樣品經二氧化碳臨界點干燥、噴金后,用Hitachi S3000 N掃描電子顯微鏡(日本經營電子電氣公司)觀察采圖[5]。
1.8.2 透射電鏡分析 后固定:將1.8.1節中固定好的樣品放入用0.1 mol/L磷酸緩沖液(pH值7.0)配制的1%鋨酸中在避光、室溫下進行后固定7 h。經磷酸緩沖液漂洗后,將樣品用不同濃度(30%、50%、70%、80%、95%、100%、100%)的 乙 醇 進行逐級脫水,每次1.0 h;然后用無水乙醇∶丙酮=3∶1的混合液脫水0.5 h;用無水乙醇∶丙酮=1∶1脫水0.5 h;用無水乙醇∶丙酮=1∶3脫水0.5 h;最后用丙酮脫水1.0 h。滲透包埋:先用丙酮∶812包埋劑=3∶1在37 ℃下包埋2~4 h;用丙酮∶812包埋劑=1∶1在37 ℃下滲透過夜;再用丙酮∶812包埋劑=1∶3在37 ℃下包埋2~4 h;最后用純812包埋劑在37 ℃下包埋5~8 h;將純812包埋劑倒入包埋板,將樣品插入包埋板后于37 ℃烤箱過夜。聚合:將包埋板放于60 ℃烤箱聚合48 h,取出樹脂塊備用。超薄切片:將樹脂塊于超薄切片機上進行超薄(60~80 nm)切片,用150目方華膜銅網撈片。染色:將銅網于2%醋酸鈾飽和酒精溶液中避光染色8 min;用70%酒精清洗3次;用超純水清洗3次;用2.6%枸櫞酸鉛溶液避二氧化碳染色8 min;最后用超純水清洗3次,用濾紙稍吸干。將銅網切片放入銅網盒內在室溫下干燥過夜[5]。在Hitachi H-7500透射電子顯微鏡(日本經營電子電氣公司)下觀察,采集圖像進行分析。
1.9 數據統計與分析
所有實驗均設3個重復,數據以平均數±標準差(SD)表示。采用IBM SPSS統計軟件(Version 20; IBM Institute, Armonk, New York, USA)進行單因素方差分析, P<0.05表示具有顯著性差異。
2 結果與分析
2.1 培養料中纖維素、半纖維素和木質素含量的變化
分別對糙皮側耳菌絲萌發(T1)、發菌中期(T2)、發菌末期(T3)、現蕾(T4)、子實體采收(T5)5個階段糙皮側耳培養料中的木質纖維素含量進行檢測,結果如圖1所示。隨著糙皮側耳的生長,纖維素、半纖維素、木質素的含量均顯著降低,從T1到T5,三者的含量分別下降了9.21%、21.25%和3.95%,半纖維素含量的下降趨勢最為明顯。
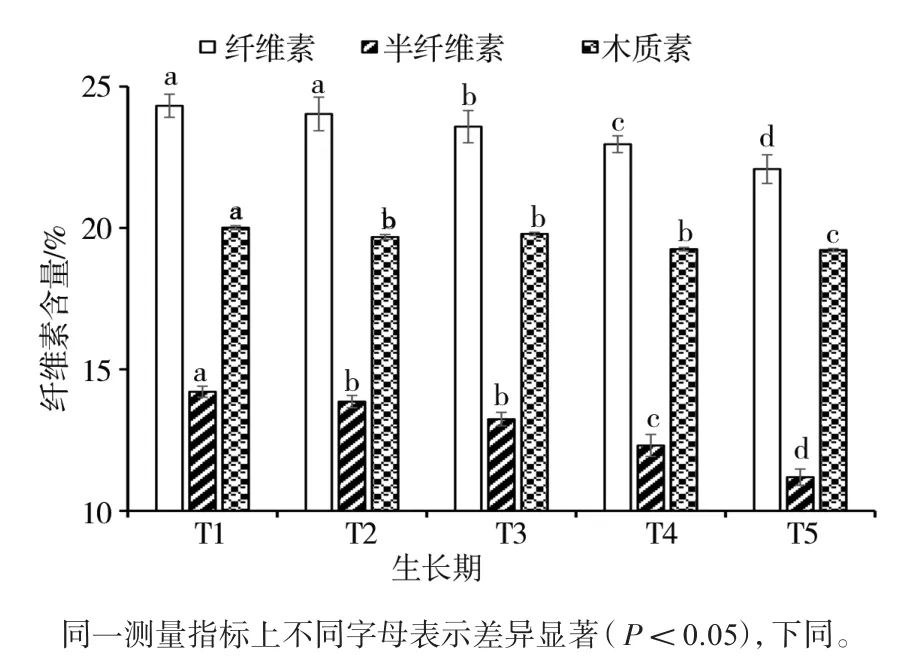
圖1 在糙皮側耳不同生長時期培養料中纖維素、半纖維素和木質素含量的變化
2.2 培養料中木質纖維素降解酶活性的變化
如圖2所示,在糙皮側耳生長前期,培養料中的纖維素酶活性較低;但隨著糙皮側耳的生長,培養料中的纖維素酶活性不斷增加,且在子實體采收期(T5)達到高峰(3.37 U/mL)。與纖維素酶活性的變化趨勢相似,隨著糙皮側耳的生長,培養料中的木聚糖酶活性不斷增加,并在采收期(T5)達到高峰(4.17 U/mL)。但是,隨著糙皮側耳的生長,培養料中漆酶活性呈現先升后降的變化趨勢,在發菌末期(T3)達到峰值(3.38 U/mL),此后呈不斷下降的趨勢。培養料中的MnP活性變化與漆酶類似,隨糙皮側耳的生長而不斷增加,并在發菌末期(T3)達到最高值(1.62 U/mL)。培養料中的LiP活性較低,與菌絲萌發期(T1)相比,LiP的活性在發菌中期(T2)時上升,隨后逐漸下降,但在采收期(T5)又有所增加。
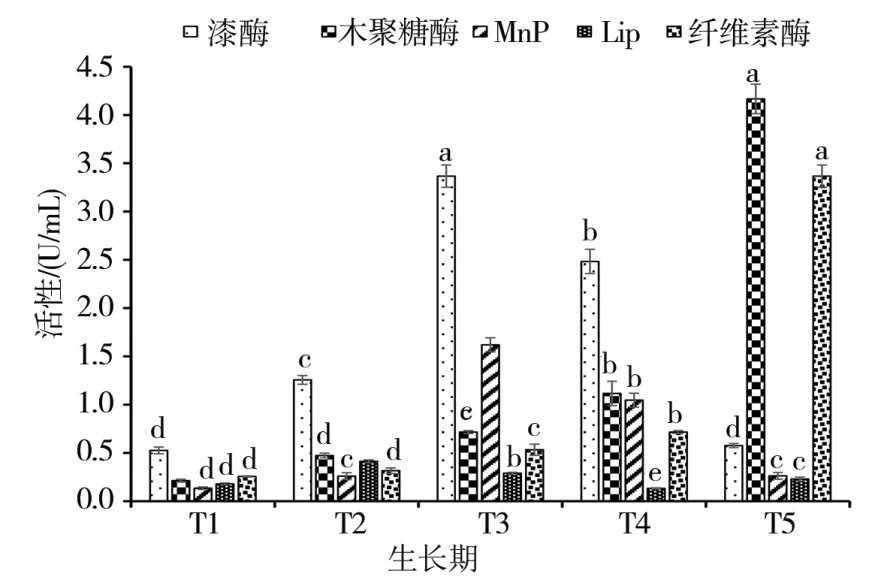
圖2 在糙皮側耳不同生長時期培養料中木質纖維素降解酶活性的變化
2.3 培養料中纖維素、半纖維素和木質素組分的結構表征
表1~表3顯示了在糙皮側耳不同生長時期培養料中纖維素、半纖維素和木質素組分中單糖的組成變化。結果表明,纖維素中的單糖主要是Glu,還有微量的Xyl、Man、Gal和Ara,這可能是由于該分離提取的纖維素含有微量的半纖維素。纖維素中的Glu含量隨糙皮側耳的生長而逐漸降低(81.06%~73.60%)。半纖維素中的主要單糖是Xyl(64.30%~73.21%)和Ara(11.02%~14.70%),且 兩者的含量均在采收期(T5)最低。在糙皮側耳5個生長時期的培養料木質素中均檢測到Glu和Xyl,在現蕾期(T4)兩者的含量最高,而且與其他4個時期相比,在現蕾期(T4)和子實體采收期(T5)的木質素中新出現了Ara和Gal這2種單糖。
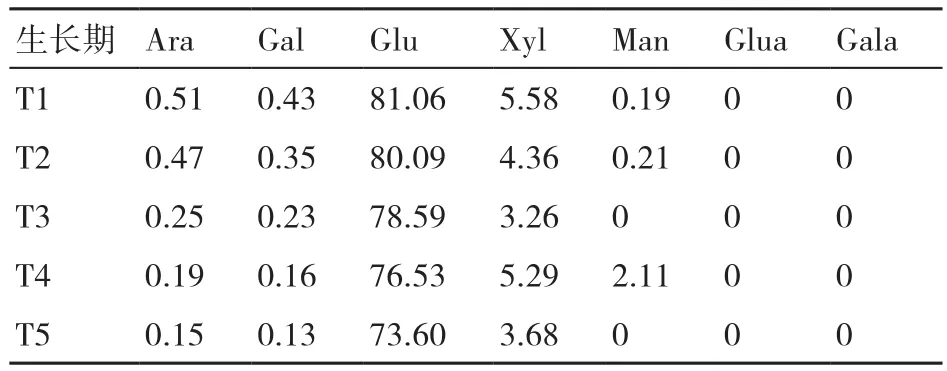
表1 在糙皮側耳不同生長時期培養料中纖維素組分的單糖含量 %

表2 在糙皮側耳不同生長時期培養料中半纖維素組分的單糖含量 %

表3 在糙皮側耳不同生長時期培養料中木質素組分的單糖含量 %
從培養料中提取的纖維素、半纖維素和木質素組分的分子量分布變化如表4~表6所示。纖維素Mn的變化表現為T4>T1>T2>T3>T5,Mw表 現為T1>T2>T4>T3>T5,D表現為T1>T2>T3>T4>T5;半纖維素Mn的變化表現為T1>T2>T4>T3>T5,即隨著糙皮側耳的生長而不斷下降,Mw表現為T2>T1>T4>T3>T5,D表現為T5>T4>T2>T3>T1;纖維素和半纖維素的Mn和Mw均在子實體采收期最低。木質素的Mn變化表現為T4>T1>T5>T2>T3,Mw表現為T4>T5>T1>T2>T3,均在菌絲生長期(T2和T3)最低,在現蕾期(T4)最高。
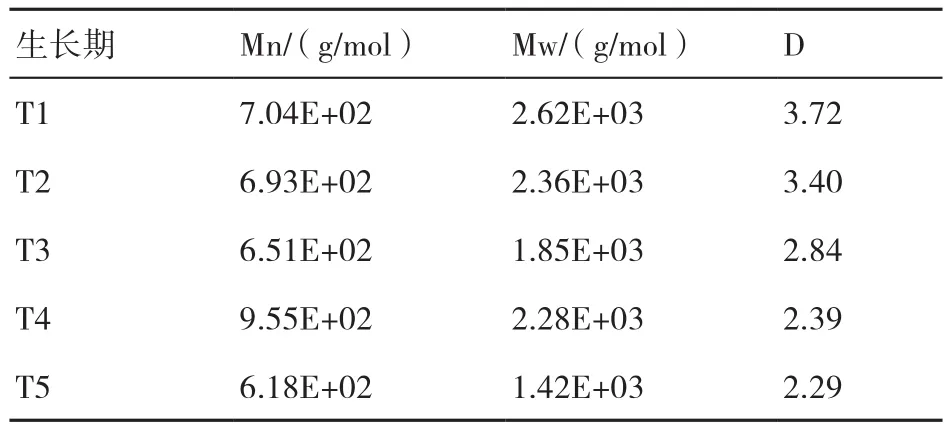
表4 在糙皮側耳不同生長時期培養料中纖維素組分的重均相對分子質量(Mw)、數均相對分子質量(Mn)和分散度(D)

表5 在糙皮側耳不同生長時期培養料中半纖維素組分的重均相對分子質量(Mw)、數均相對分子質量(Mn)和分散度(D)
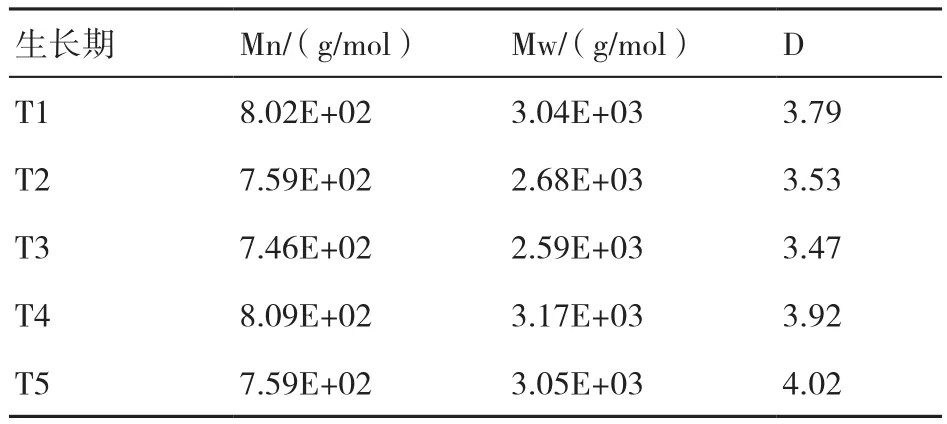
表6 在糙皮側耳不同生長時期培養料中木質素的重均相對分子質量(Mw)、數均相對分子質量(Mn)和分散度(D)
2.4 掃描電鏡觀察
采用掃描電鏡觀察在糙皮側耳生長過程中培養料中玉米芯組織的縱切面(圖3a~圖3j)和橫切面(圖3k~圖3t)的形態學變化。從中可以看出,在糙皮側耳菌絲剛萌發(T1)時,玉米芯維管集聚,其橫截面呈不規則圓形且結構清晰,維管內由上至下布滿微孔(圖3a、圖3b);管徑較粗且厚實,纖維表面光滑,管與管之間相切排列,界限清晰,結構緊密(圖3k、圖3l)。這些維管的結構特征有利于植物對空氣、水分和養分的吸收及交換利用。隨著糙皮側耳的生長,玉米芯維管明顯變得表面粗糙、孔洞多、結構疏松、質地松散,并且其中的糙皮側耳菌絲明顯增多(圖3c~圖3j和圖3m~圖3t)。尤其是在糙皮側耳子實體采收期(T5),玉米芯的維管遭到明顯腐蝕和破壞,其橫切面的圓形管壁變薄甚至塌陷,壁上微孔無法辨識(圖3i、圖3j);管徑變細,相互交錯且界限模糊,維管結構嚴重受損,且中間布滿了糙皮側耳菌絲(圖3s、圖3t)。這可能是由于糙皮側耳菌絲將維管壁上的木質纖維素降解并吸收利用,從而導致維管結構被嚴重破壞。

圖3 掃描電鏡觀察糙皮側耳不同生長時期培養料中玉米芯的顯微形態學變化
2.5 透射電鏡觀察
采用透射電鏡觀察糙皮側耳生長過程中玉米芯組織的超微結構變化。從圖4a~圖4c可以看出,糙皮側耳菌絲剛萌發時(T1)培養料中的玉米芯細胞形狀規則,排列緊密;細胞壁結構較為完整,表面平滑。隨著糙皮側耳菌絲的生長,玉米芯細胞形狀逐漸變得無規則,甚至完全被破壞(圖4d~圖4l)。圖中淺色部分為發生降解的細胞壁,深色部分是未降解的細胞壁。隨著糙皮側耳的生長,玉米芯細胞壁逐漸透明或消失,說明其結構明顯被降解并出現斷裂。從圖4h、圖4i可以看出,糙皮側耳菌絲可以進入細胞壁的內部,進而降解其中的物質。這可能是因為糙皮側耳菌絲優先分泌的木質素降解酶(漆酶、MnP)降解了玉米芯細胞壁上的木質素,引起其結構的破壞,從而使得糙皮側耳菌絲可以進入到細胞壁內部,通過分泌纖維素酶和木聚糖酶使其中的纖維素和半纖維素發生降解并開始被菌體利用。尤其是在糙皮側耳子實體采收期(T5),玉米芯內集聚了大量的糙皮側耳菌絲,細胞之間結合松弛且排列紊亂,骨架結構遭到嚴重破壞(圖4m~圖4o)。

圖4 透射電鏡觀察糙皮側耳不同生長時期培養料中玉米芯的超微結構變化
3 討論與結論
糙皮側耳適應性強,可以廣泛利用農林副產物(木屑、玉米芯、麥麩和甘蔗渣等)作為培養料進行人工栽培[2]。糙皮側耳作為木腐型真菌,可以分泌木質纖維素降解酶(Cellulase、Xylanase、Laccase、MnP和LiP等)來降解培養料中的木質纖維素(纖維素、半纖維素和木質素),以獲取生長所需的碳源[18-19]。因此,隨著糙皮側耳的生長,培養料中纖維素和半纖維素的比例顯著降低,尤其是在采收子實體時,其降解程度分別達到9.21%和21.25%。纖維素和半纖維素在相關的降解酶的作用下轉化為小分子糖,可以為糙皮側耳菌絲和子實體的生長提供碳源[20]。與半纖維素和纖維素相比,木質素含量的降低程度較低(3.95%),類似的結果也出現在白靈側耳(Pleurotus tuoliensis)[20]和鳳尾菇(Pleurotus pulmonarius)[21]的栽培上。這一現象可以通過白腐真菌對木質纖維素生物質的降解特性來解釋。植物組織的纖維素和半纖維素被木質素緊密包圍,形成一種天然的抗降解的屏障,起到保護纖維素和半纖維素的作用,使其不易被微生物破壞[22]。即使少量木質素被降解,纖維素和半纖維素的可接觸性也大大提高,有利于發生進一步的酶解和脫聚,因此纖維素和半纖維素的降解程度較高[23]。HPAEC-PAD的檢測結果顯示,培養料中的纖維素主要是由Glu組成的,半纖維素主要是由Xyl和Ara組成的,隨著糙皮側耳的生長,纖維素中的Glu含量以及半纖維素中的Xyl含量逐漸降低,并且在子實體采收期達到最低值。同時纖維素和半纖維素的分子量也在子實體采收期最小,這進一步說明糙皮側耳對兩者進行了顯著降解。而木質素的單糖主要是由Glu和Xyl組成的,且其含量在現蕾期達到峰值,說明在這個時期木質素的結構發生了某種顯著的變化。而各組分的總含量遠遠低于100%,是因為在木質素的結構中糖單元的含量較苯丙烷結構低得多,而HPAEC-PAD檢測只能對其中的糖單元進行測定。同時木質素的分子量在發菌期間較低,在現蕾期最大,其可能的原因是糙皮側耳在發菌過程中菌絲大量利用培養料中的木質素組分,使得木質素發生部分降解,降解后的木質素在現蕾期發生結構重組,從而導致木質素分子量上調[10]。
糙皮側耳可以分泌大量的氧化酶和水解酶如Cellulase、Xylanase、Laccase、LiP和MnP以 降 解培養料中的大分子物質,滿足生長所需,這些酶活性的變化可以反映糙皮側耳利用木質纖維素的規律。木質素降解酶類如漆酶和MnP的活性隨糙皮側耳生長而快速升高并最先達到最大值,這表明木質素可能較先發生降解[12]。這一現象在香菇(Lentinula edodes)[24]、巴西蘑菇(Agaricus blazei)[25]、灰樹花(Grifola frondosa)[26]等食用菌上也有發生。當菌絲萌發時,作為糙皮側耳主要碳源的纖維素在培養料中的含量為24.32%。因此,較高的纖維素酶活性有利于降解培養料中的纖維素,以提供糙皮側耳生長所需的碳源。纖維素酶的活性隨糙皮側耳栽培時間的延長而逐漸升高,并于子實體采收期達到最高,說明這一階段培養料中的纖維素大量被降解,這與四孢蘑菇(Agaricus campestris)[27]栽培基質的降解特性相似。半纖維素也可以為糙皮側耳的生長提供一定的碳源,培養料中的半纖維素含量約為14.21%。木聚糖酶是水解半纖維素的主要酶,其活性隨糙皮側耳的生長而不斷升高,這有利于菌絲細胞降解培養料中的半纖維素組分,最大程度地利用培養料中的碳源,這與人們對雙孢蘑菇(Agaricus bisporus)[27]、榆耳(Gloeostereum incarnatum)[24]等食用菌的研究結果相似。
玉米芯是培養料中的主要成分(84%),其結構的變化可以間接反映栽培糙皮側耳過程中培養料的結構變化。SEM結果顯示,栽培糙皮側耳后玉米芯的結構松散、孔洞較多、表面粗糙,維管部分被消化并出現斷裂,維管之間結合松弛且排列紊亂。結合TEM可以發現,玉米芯細胞骨架結構遭到破壞,細胞壁結構模糊,其中含有的物質(纖維素、半纖維素和木質素)逐漸透明或消失。玉米芯微觀結構的變化印證了培養料化學組分的變化。這說明糙皮側耳通過分泌各種木質纖維素降解酶,大幅降解玉米芯中的木質纖維素(纖維素、半纖維素和木質素)為小分子物質并被自身吸收利用。
根據以上結果,筆者推測糙皮側耳優先利用培養料中的葡萄糖、氨基酸等小分子物質,然后分泌木質素降解酶(Laccase和MnP)降解培養料中的木質素組分,木質素結構的被破壞使糙皮側耳菌絲得以進入木質纖維素內部,并開始分泌Cellulase和Xylanase以降解纖維素和半纖維素,從而滿足其生長所需。
本文對糙皮側耳生長過程中培養料中木質纖維素及相關降解酶的活性變化進行了研究,所獲得的研究結果可以為提高糙皮側耳的生產力和培養料的利用率,減少由工農業生產中的副產物造成的潛在環境污染提供理論支撐。

