中藥松弛膏聯合運動康復對關節攣縮大鼠關節纖維化ROM 及炎癥反應的研究
苗田雨,帕麗達·買買提?,努爾比亞·克其克,王寧寧,李晶晶,史凌云,夏熱帕·阿不都拉,阿斯古麗·圖爾蓀,
(1.新疆醫科大學護理學院,烏魯木齊 830000;2.新疆醫科大學第一附屬醫院護理部,烏魯木齊 830000)
關節攣縮(joint contracture)是臨床上一種常見的慢性關節疾病,常伴隨關節僵硬、畸形、功能受損等癥狀,是神經肌肉疾病與骨關節疾病的常見并發癥[1]。其癥狀為伴隨關節主動或被動活動范圍的喪失[2],臨床上表現為患者關節活動度(range of motion,ROM)下降,持續的主動及被動活動范圍受限[3]及步態異常等功能障礙[4],嚴重影響患者日常生活自理能力(activity of daily living,ADL)。關節攣縮可分為神經源性攣縮、關節源性攣縮與肌肉源性攣縮[5],其中關節纖維化(arthrofibrosis)在關節攣縮形成中起到重要作用[6]。在纖維化過程中,白細胞介素(interleukin,IL)6(IL-6)和17(IL-17)及轉化生長因子-β1(transforming growth factor-β1,TGFβ1)引起的細胞因子失衡起關鍵作用[7-9]。細胞外基質的大量沉積是纖維化的病理特點之一[10],炎癥細胞分泌細胞趨化因子,使細胞外基質過度沉積[11],TGF-β1 信號傳導也參與細胞外基質的發育、遷移和沉積[12],促使細胞外基質合成增加,最終關節囊內形成纖維化瘢痕組織以及纖維粘連。關節纖維化主要采用藥物干預、物理干預以及外科干預等綜合康復方法,致力于恢復關節的病理結構,改善關節活動度[13]。然而,目前大多關節纖維化的治療效果不佳。在本課題組的前期研究中發現,中藥松弛膏外敷結合西醫康復護理療法能有效改善患者的下肢關節活動度[14],減輕炎癥反應[15],但其改善病理變化的機制尚不清楚。本研究通過采用中藥松弛膏聯合跑臺運動干預的綜合康復干預方法,探討其對關節攣縮關節纖維化大鼠中ROM、IL-6、IL-17 和 TGF-β1 表達的影響。
1 材料和方法
1.1 實驗動物
44 只6~8 周齡,SPF 級,體重為180~220 g 的雄性Wistar 大鼠,購自新疆醫科大學實驗動物中心[SCXK(新)2018-0003],實驗場所為新疆醫科大學實驗動物中心屏障環境動物實驗室[SYXK(新)2019-0004],飼養室照度150~200 lx,室溫控制在18℃~22℃,相對濕度:50%±10%。動物房進行嚴格消毒,正常晝夜交替節律。本實驗已通過新疆醫科大學第一附屬醫院倫理委員會的審核(20200326-03),并按實驗動物使用的3R 原則給予實驗動物人道的關懷。
1.2 主要試劑與儀器
本課題組研制的中藥松弛膏(專利號2018114781048),由多種具有消炎退腫、解痙祛風、止痛活血作用的動物油及中草藥成分組成,該藥物每500 g 由原料亞麻籽20 g、沒藥20 g、葫蘆巴20 g、羊乳香20 g、藥蜀葵子20 g、洋甘菊20 g、秋水仙20 g、馬油200 g 和牛骨髓200 g 組成。其具有副作用小、對機體無創傷、使用便捷的特點,對消腫抗炎、軟筋生肌、潤膚防腐、化膿愈傷有積極作用。
義齒聚托聚合物自凝牙托粉(上海貝瓊齒材有限公司);義齒聚托聚合物自凝牙托水(上海貝瓊齒材有限公司);蘇木素(Sigma 公司,美國);伊紅(國藥集團化學試劑公司);IL-6 試劑盒(江萊生物);IL-17 試劑盒(江萊生物);TGF-β1 試劑盒(江萊生物);戊巴比妥鈉(默克公司,德國);0.9%生理鹽水(利爾康醫療科技);碘伏(利爾康醫療科技)。
FT-200 型動物跑步機(成都泰盟軟件有限公司);0.8 mm 帶螺紋定制骨牽引針(天津希翼器械公司);骨科電鉆(鹽城奧瑞公司);冰凍切片機(LEICA 公司,德國);液氮罐(烏魯木齊制氧廠);手持式組織勻漿機(PRO Scientific 公司,法國);超聲波破碎儀(寧波新芝);普通光學顯微鏡(尼康公司,美國);電子天平(PL403)(Mettler Toledo 公司,美國);精密電子天平(Sartorius 公司,德國);超低溫冰箱(994)(Thermo Scientific 公司,美國);臺式低溫冷凍高速離心機(Thermo Scientifict 公司,美國)。
1.3 實驗方法
1.3.1 模型制備方法
按照Nagai 等[16]法,復制本次課題所需的關節攣縮模型,具體步驟如下:采用隨機數字表法將44只大鼠分為正常對照組(normal control group,NC組)8 只和模型組36 只。取模型組36 只大鼠,腹腔注射3%戊巴比妥鈉(3 mg/kg)深度麻醉后將左后肢剃毛并消毒;分別在股骨和脛骨1/2 和1/3 處進針,將0.8 mm 帶螺紋的克氏針垂直穿過但未穿破內側皮膚,再將外露的克氏針剪至超出皮膚約1.8 cm;用量角器使股骨和脛骨夾角固定于45°,用無菌軟鐵絲連接股骨和脛骨外露的克氏針;將自凝牙托粉和自凝牙托水按比例混合,包裹軟鐵絲和外露的克氏針。固定結束后對所有大鼠進行X 線拍攝(如圖1),36 只大鼠固定成功。復制關節攣縮模型3 周后,隨機抽取2 只大鼠,處死大鼠后剝離關節囊滑膜,進行蘇木精-伊紅(hematoxylin-eosin,HE)染色,判斷已發生攣縮,拆除固定裝置,發現2 只大鼠骨折,最終32 只大鼠制模成功。
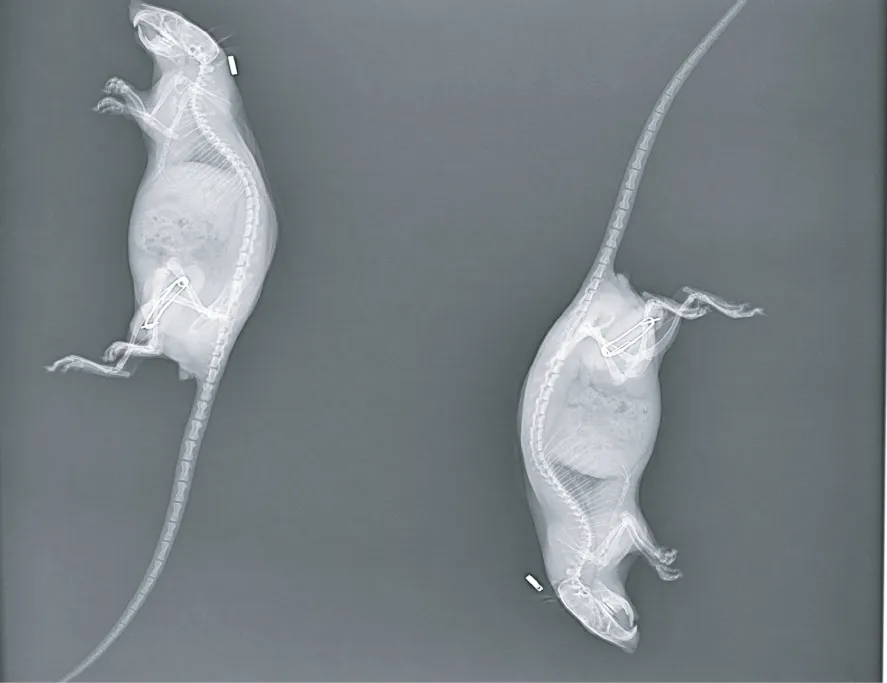
圖1 復制關節攣縮模型后大鼠X 線拍攝Figure 1 After the joint contracture model was reproduced,the rats were photography by X-ray
1.3.2 HE 染色驗證模型制備是否成功
常規包埋切片,脫蠟、脫二甲苯、返藍、染色、封片,在光學顯微鏡下觀察切片形態并記錄。
1.3.3 干預方法
采用隨機數字表法將32 只大鼠分為模型對照組(model control group,MC 組)、中藥松弛膏干預組(songchi ointment intervention group,SC 組)、跑臺運動干預組(running platform exercise intervention group,RE 組)、中藥松弛膏+跑臺運動干預組(songchi ointment+running platform exercise intervention group,SR 組)。
(1)MC 組:去除固定裝置后,不給予特殊干預;(2)SC 組:去除固定裝置后,在造模側膝關節周圍涂抹中藥松弛膏約18 g 并采用指揉法按摩3 min,每日1 次,1 周6 次,共6 周;(3)RE 組:將大鼠置于跑步機上,結合已有文獻報道[15],將速度設定在1 km/h,每次20 min,每日1 次,1 周6 次,共6 周;(4)SR 組:先按照運動康復干預組的方法進行跑臺訓練,訓練結束后按照中藥松弛膏干預組的方法進行藥物涂抹與按摩,每日1 次,1 周6 次,共6 周。
1.3.4 ROM 的測量
分別于取出固定裝置后、干預42 d 后對所有大鼠進行X 片拍攝,給每只大鼠腹腔注射3%的戊巴比妥鈉(3 mg/kg)進行深度麻醉,右側臥位置于X片機臺上并左后肢踝關節懸掛0.5 N 砝碼固定以保證每一只大鼠受力均勻,砝碼必須與大鼠正中線平行懸掛,避免接觸任何物品,以保證每一只大鼠均使用同等大小的拉力,X 光下拍攝股骨與脛骨夾角,并用Image J 軟件測量大鼠左膝關節ROM。
1.3.5 ELISA 檢測IL-6、IL-17、TGF-β1 含量
干預42 d 后進行取材,取材前24 h 禁食不禁水,腹腔注射3%的戊巴比妥鈉麻醉后,采大鼠腹主動脈血室溫靜置2 h 后以3000 r/min 離心10 min 并抽取上清液置于-80℃冰箱內;取各組大鼠血清樣本,根據試劑盒說明書要求處理樣本后,采用酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測各組大鼠血清中IL-6 及IL-17 含量;取大鼠滑膜組織液,由于大鼠滑膜組織液量極少,不足以達到檢測的最低樣本量,因此添加滅菌用水稀釋至10%,采用ELISA 檢測試劑盒檢測TGF-β1含量。
ELISA 檢測方法:按照ELISA 試劑盒說明書檢測,從室溫平衡60 min 后的鋁箔袋中取出所需板條;配置標準液;標準品孔、樣品孔內分別加入標準品、待測樣本50 μL,空白孔不加;每孔加入50 μL的抗體工作液后孵育;洗滌后每孔加入辣根過氧化物酶(HRP)標記的檢測抗體100 μL;加酶后孵育加終止液,讀取吸光度,制作標準曲線。
1.4 統計學方法
采用SPSS 26.0 軟件(美國IBM 公司)進行統計分析。經正態性檢驗和方差齊性檢驗后,服從正態分布的計量資料用平均數±標準差()表示,多組間均數比較采用單因素方差分析,兩組間比較采用組間t檢驗,檢驗水準取α=0.05,P<0.05 為有統計學意義。實驗分析圖使用 Graphpad prism 9.02 繪制。
2 結果
2.1 干預前、模型制備后HE 染色驗證結果
模型制備3 周后,通過HE 染色觀察大鼠關節囊滑膜發現,大量炎性細胞浸潤,纖維組織排列紊亂,滑膜內壁可見增厚萎縮等改變,復制大鼠關節攣縮模型成功(如圖2)。
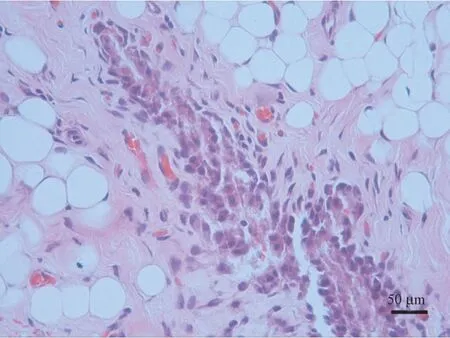
圖2 模型制備后大鼠關節囊滑膜組織HE 染色觀察(滑膜)Figure 2 Observation of synovial tissue of rat joint capsule after model preparation(Synovial membrane)
2.2 各組大鼠左膝關節ROM 比較
取出固定裝置后、實驗干預前NC 組和模型組大鼠ROM 比較(見表1):與NC 組大鼠ROM(113.35±6.56)°相比,模型組大鼠ROM(97.59±7.99)°明顯下降,差異具有統計學意義(t=4.861,P<0.05),故復制大鼠關節攣縮模型成功。
表1 正常對照組與模型組在取出固定裝置后、實驗干預前ROM 比較(°,)Table 1 Comparison of ROM between normal control group and model group after removal of fixed device and before experimental intervention
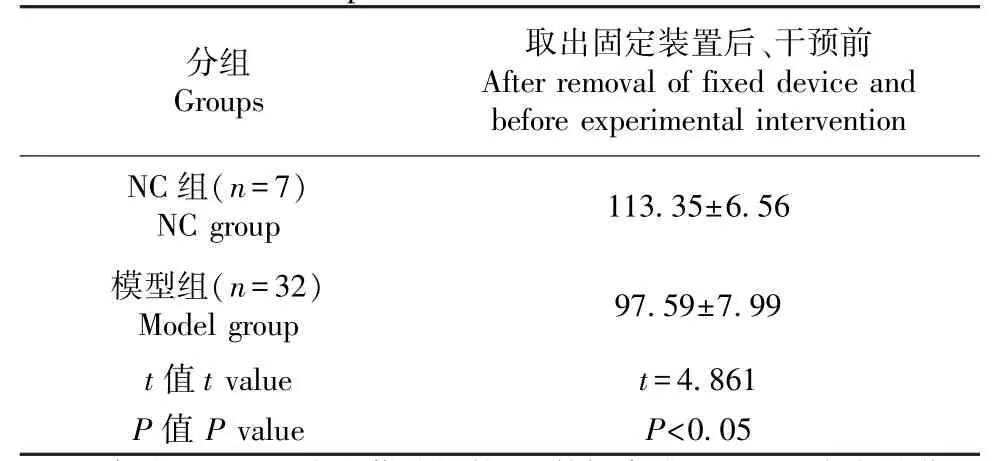
表1 正常對照組與模型組在取出固定裝置后、實驗干預前ROM 比較(°,)Table 1 Comparison of ROM between normal control group and model group after removal of fixed device and before experimental intervention
注:正常對照組一只大鼠依從性較差,數據淘汰:經2~3 次麻醉藥追加達不到麻醉效果,導致達不到實驗要求,因此淘汰。Note.Compliance of a rat in the normal control group was poor,and the data were eliminated: the anesthesia effect could not be achieved after 2~3 times of anesthesia addition,which led to the failure to meet the requirements of the experiment,so it was eliminated.
2.3 干預前、干預42 d 后各組大鼠ROM 比較
干預42 d 后RE 組與SR 組比較,t=-2.307,P<0.05,與MC 組比較,t=2.788,P<0.05;MC 組與SR組比較,t=-5.817,P<0.05,與SC 組比較,t=-3.222,P<0.05,差異均具有統計學意義;RE 組與SC 組比較,差異無統計學意義(P>0.05)。與干預前相比(見表2),干預42 d 后SC 組、RE 組、SR組ROM 均較干預前顯著提高,差異具有統計學意義(如圖3)。
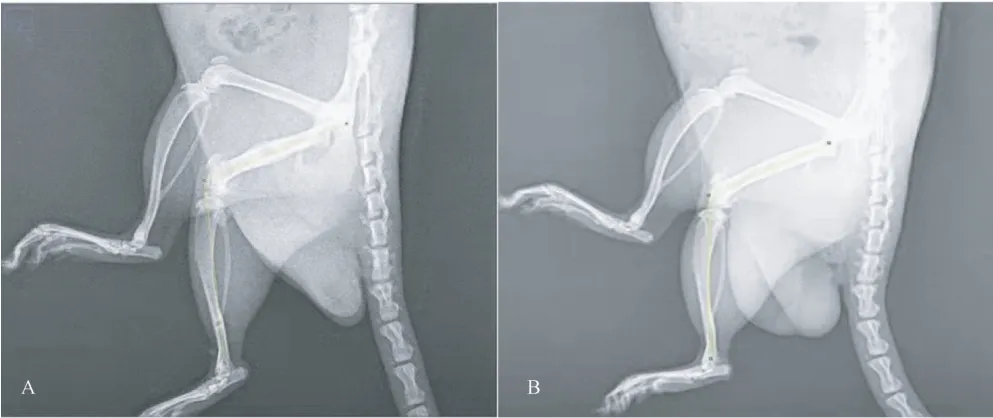
圖3 取出固定裝置后、干預42 d 后大鼠X 線拍攝Figure 3 After removing the fixation device and 42 days after intervention,the rats were photographed by X-ray
表2 各組大鼠在干預前、干預42d 后R OM 比較(°,)Table2 ROM com parison of ratsinea chgroup be fore and 42 days after intervention

表2 各組大鼠在干預前、干預42d 后R OM 比較(°,)Table2 ROM com parison of ratsinea chgroup be fore and 42 days after intervention
注:NC 組一只大鼠依從性較差,數據淘汰 ;NC 組、MC 組、RE 組各一只大鼠麻醉死亡。Note.Compliance of one rat in NC group was poor and the data were eliminated.One rat in NC group,MC group and RE group died of anesthesia.
2.4 各組大鼠IL-6、IL-17 水平
通過兩兩組間比較發現(如圖4),MC 組IL-6(1.184±0.056)pg/mL、IL-17(0.703±0.019)pg/mL含量均較NC 組顯著升高(P<0.01);RE 組IL-6(0.952±0.010)pg/mL、IL-17(0.642±0.009)pg/mL含量,SC 組IL-6(0.952±0.012)pg/mL、IL-17(0.625±0.005)pg/mL 含量,SR 組IL-6(0.905±0.005)pg/mL、IL-17(0.610±0.002)pg/mL 含量均較MC 組明顯降低,組間差異均具有統計學意義(P<0.01);SR組IL-6 及IL-17 含量均數顯著低于SC 組、RE 組,組間差異均具有統計學意義(P<0.05)。
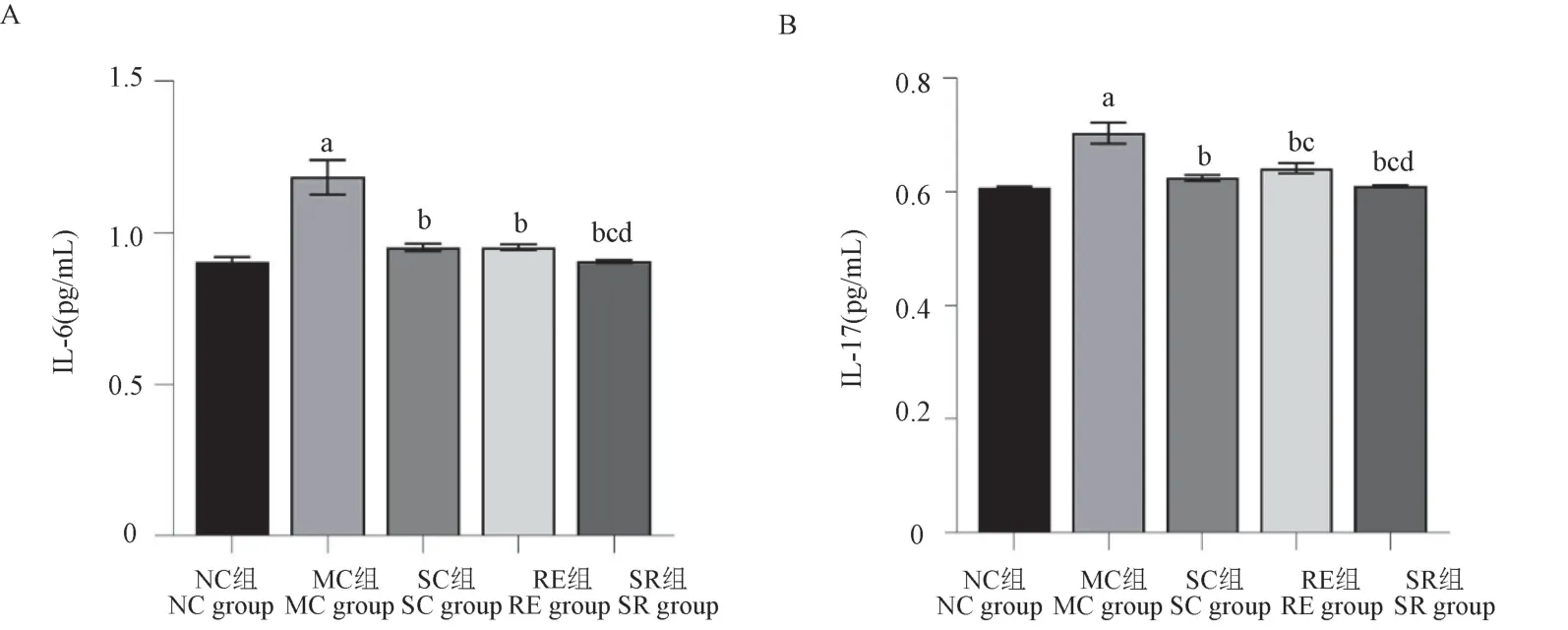
圖4 各組大鼠血清樣本IL-6 及IL-17 含量比較Figure 4 Comparison of IL-6 and IL-17 contents in serum samples of rats in each group
2.5 各組大鼠滑膜液中TGF-β1 的含量
通過兩兩組間比較發現(如圖5),MC 組TGFβ1 含量(0.255±0.004)ng/mL,較NC 組(0.236±0.001)ng/mL 顯著升高,差異具有統計學意義(P<0.01);SC 組(0.248±0.003)ng/mL、RE 組(0.250±0.002)ng/mL 及SR 組(0.242±0.005)ng/mL TGFβ1 含量均較模型對照組顯著降低,組間差異均具有統計學意義(P<0.01);SR 組TGF-β1 含量均數顯著低于SC 組、RE 組,組間差異均具有統計學意義(P<0.05)。
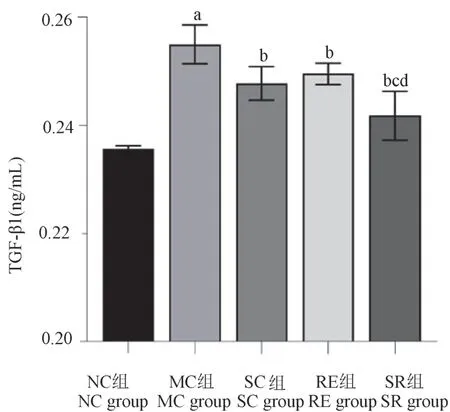
圖5 各組大鼠滑膜液TGF-β1 含量比較Figure 5 Comparison of TGF-β1 content in synovial fluid of rats in each group
3 討論
隨著人類社會的不斷發展,交通事故頻繁發生、戶外運動持續增多、生活方式改變使慢性病的患病率逐年升高,骨關節疾病發生率也呈逐年上升趨勢,尤其是關節攣縮患者大幅增加。關節固定是臨床上引起關節攣縮最常見的原因[17]。當骨折、關節脫位、韌帶損傷發生后,常采用關節固定[17]。然而,不正確的固定或過長的固定時間使關節缺乏活動,引起組織的退變或萎縮性改變,如關節周圍軟組織纖維化[18],導致關節攣縮[19]、關節活動受限等,其極大降低患者生活質量,給患者重回社會帶來嚴峻挑戰。目前臨床上治療關節纖維化的方法很多,但其治療效果均不理想,手術治療獲益與風險并存,藥物治療的病理機制尚需進一步深入研究[13]。自各國相繼發現新型冠狀病毒肺炎(coronavirus disease 2019,COVID-19)以來,慢性非傳染性疾病患者的用藥、診療及康復需求得不到滿足[20]。在這種形勢下,無需設備及專業人員便可執行的康復方案的獨特優勢尤為凸顯。近年來,中藥療法的使用越來越廣泛,中藥外敷以省時省力、貼敷方便、副作用小、可與其他康復方案聯合應用的獨特優勢備受青睞[21-22]。因此本研究采用課題組成熟的關節攣縮動物模型,將大鼠制動3 周后拆除外固定,通過中藥松弛膏聯合跑臺運動康復的干預方法,探究其對關節攣縮大鼠關節纖維化的影響。
本研究在模型制備成功后、干預前測量大鼠膝關節ROM,結果顯示,與NC 組相比,模型組大鼠關節活動度顯著減小,進一步說明關節固定是關節攣縮發生的首要原因。干預42 d 后,測量大鼠膝關節ROM,結果顯示,SC 組、RE 組、SR 組 ROM 均較模型對照組顯著提高,提示適宜的運動有利于關節功能的恢復,維持正常的關節活動,對改善關節功能減退、關節畸形具有重要意義。中藥松弛膏中主要成分秋水仙堿可抑制炎性因子釋放,阻斷中性粒細胞釋放至關節腔內,消除關節腫脹[23-24]、沒藥與乳香具有消腫生肌、活血止痛的功效[25-27]、亞麻籽中富含的omega-3 可減輕炎癥、激活肌纖維細胞加速肌肉再生[28],對改善大鼠ROM 起到一定療效。本研究結果顯示,中藥松弛膏聯合跑臺運動康復干預組ROM 顯著高于單純跑臺運動康復干預組與中藥松弛膏干預組,提示中藥松弛膏與運動療法具有協同作用,可進一步改善關節攣縮關節纖維化大鼠的ROM。
關節攣縮和纖維化是復雜的病理生理過程,與多種細胞因子驅動的炎癥反應有關,研究發現[29-30],IL-6、IL-17 在各種疾病和組織中顯示出纖維化活性。IL-6 由巨噬細胞及T 細胞產生,可促進中性粒細胞聚集于炎性反應部位,釋放蛋白酶及氧自由基[31],介導免疫病理損傷參與纖維化發展,反應纖維化程度[32]。IL-17 主要作用于間充質來源的細胞[33],分泌各種前炎性細胞因子及抗菌肽,誘導內質網應激,促進上皮細胞損傷,引起纖維化。TGF-β1 是纖維化的主要參與物,其由巨噬細胞、內皮細胞產生,通過自分泌、旁分泌調控細胞生長,是最主要的致纖維化因子之一[34]。在早期階段,組織通過大量釋放TGF-β1[35],與多種細胞相互作用[36],形成復雜的纖維化網絡。在本研究中,MC 組TGF-β1 含量較正常對照組顯著升高,表明在關節纖維化的形成中,TGF-β1 發揮著重要作用。在復雜的纖維化網絡中,TGF-β1 通路被廣泛認為可誘導組織的纖維化[37]。
本研究中,模型制備當日大鼠關節囊滑膜HE染色顯示,纖維組織排列紊亂,滑膜內壁可見增厚萎縮等改變,大量炎性細胞浸潤,提示模型制備成功。干預42 d 后模型對照組炎癥因子水平顯著高于其余四組,提示單核吞噬細胞、中性粒細胞聚集,引起并加重炎癥與纖維化活性。運動療法是防治關節纖維化的有效手段,研究表明,作為重要的有氧運動方式之一,跑臺運動對炎癥因子水平、制動引起的關節攣縮關節纖維化有明顯的改善作用[38-40],故本研究采用跑臺訓練,結果顯示RE 組IL-6、IL-17 以及TGF-β1 含量較MC 組顯著降低,運動療法可顯著改善炎癥反應及纖維化。在中藥松弛膏干預時采用按摩手法,促進關節周圍組織血液流通,松解組織粘連,放松肌肉[41],有利于藥物吸收,充分發揮藥物成分抗炎消腫,活血止痛的效用。在干預42 d 后,SR 組的炎癥因子含量、TGF-β1 含量顯著低于MC 組、SC 組及RE 組,提示中藥松弛膏聯合運動療法能通過抑制炎癥因子分泌,降低大鼠關節纖維化水平。
本研究為中醫藥聯合運動的干預方案對關節攣縮關節纖維化的防治提供新思路,后續研究中,TGF-β/Smad 信號傳導調控中藥松弛膏聯合跑臺運動康復的干預方案對關節攣縮大鼠的關節纖維化的機制值得進一步研究。綜上所述,中藥松弛膏聯合跑臺運動康復的干預方案可通過改善關節活動度,減輕炎癥因子釋放,減少TGF-β1 的分泌來改善關節攣縮大鼠的關節纖維化。因此,通過中藥松弛膏聯合跑臺運動康復干預對關節攣縮大鼠關節纖維化中IL-6、IL-17 和 TGF-β1 表達的影響研究,正確認識該疾病的康復模式,制定合理的康復方案,并采取有針對性的干預措施,對于提高這類患者生活質量及生存率至關重要。

