右美托咪定對人乳腺癌SKBR-3細胞株MAPK/JNK/Bcl-2信號通路及癌細胞轉移、侵襲的影響
顧健坤 馬偉斌 姚明 周超瑞 陳國慧
乳腺癌的不良預后主要歸因于乳腺癌細胞的高度復發與轉移,進行相關的機制研究對提高乳腺癌患者的生存率至關重要[1-2]。凋亡是程序性的細胞死亡,誘導凋亡已被評估為處置癌細胞最有前途的方法。Bcl-2家族成員主要位于線粒體膜上,并與線粒體膜電位損失和細胞色素c釋放密切相關。促細胞分裂劑活化蛋白激酶(MAPK)的活化參與細胞凋亡[3],主要通過ERK1/2(p44/p42)、c-Jun氨基末端激酶JNK(p46/p54)和p38激酶三種途徑。ERK1/2(p44/p42)主要被有絲分裂刺激激活,導致細胞生長和存活的生長因子;JNK和p38被DNA損傷,氫激活過氧化物,細胞表面受體Fas,紫外線照射,熱滲透休克,化學治療藥物誘導導致凋亡的細胞死亡[4-5]。右美托咪定是一種具有止痛、鎮靜和血液動力學作用的親脂性α2腎上腺素能激動劑,已廣泛用于減輕應激反應和全身性炎癥、抗焦慮、維持心血管系統的正常功能[6]。研究表明,嗎啡和丙泊酚等麻醉劑可能會影響惡性實體腫瘤的發生發展[7]。本研究主要探討右美托咪定對人乳腺癌SKBR-3細胞株MAPK/JNK/Bcl-2信號通路及癌細胞轉移、侵襲的影響,現報道如下。
1 材料與方法
1.1 儀 器 及 試 劑 RPMI-1640培 養 基(Gibco,Invitrogen,5412)、胎牛血清(Gibco,Invitrogen,6541)、TRIzol試劑(Gibco,Invitrogen,63654)、青霉素(碧云天生物技術有限公司,36541)、鏈霉素(碧云天生物技術有限公司,2651)、裂解緩沖液(碧云天生物技術研究所,P0013)、二甲基亞砜(碧云天生物技術有限公司,6325)、BCA蛋白質試劑盒(美國賽默飛世爾科技公司,5489)、Biotek Elx-800讀板儀(美國賽默飛世爾科技公司)、化學發光底物顯影(Thermo Fisher,美國賽默飛世爾科技公司)、3-(4,5-二甲基噻唑-2-基)2,5-二苯基四唑溴化物(MTT)試劑(Sigma Chemical Co,36541)、Giemsa溶液(sigma,62556)、SYBR Green qPCR SuperMix-UDG(sigma,3246)、SDS-PAGE膜(sigma,45874)、抗MAPK、JNK、Bcl-2(1∶1,000;Cell Signaling Technology Inc,65478、58774、24785)、辣根過氧化物酶二抗的山羊抗兔IgG(1∶1,000;Santa Cruz Biotechnology,USA,36574)、Annexin V試劑盒(美國Becton Dickinson公司,21546)、BD FACS Aria II流式細胞儀(美國Becton Dickinson公司)、計算機輔助圖像分析儀(Olympus Microimage?圖像分析,美國Windows 4.0版軟件)、PrimeScript RT試劑盒(TakaraBio,69584)、半干轉移裝置(伯樂公司Bio-Rad,中國上海)、Molecular Imager Chemidoc XRS System(伯樂公司Bio-Rad,中國上海)、iQTM Green Supermix iQ5實時檢測系統(伯樂公司Bio-Rad Laboratories,美國)、聚偏二氟乙烯膜(密理博公司Millipore,69658)。
1.2 細胞培養及分組 (1)細胞培養:人乳腺癌SKBR-3細胞株細胞獲自西安空軍軍醫大學,在帶濕度培養箱(37 ℃、5%CO2、2% O2、93%N2)和含10%胎牛血清(FBS)、1%青霉素、鏈霉素的RPMI-1640培養基中培養。(2)分組:①SKBR-3細胞組:細胞濃度為5×106/mL的乳腺癌SKBR-3細胞液在10%FBS的RPMI-1640培養基中培養;②順鉑組:乳腺癌SKBR-3細胞培養方法同前,在培養基中加入順鉑100.0 μg/mL[8];③右美托咪定低、高劑量組:乳腺癌SKBR-3細胞培養方法同前,分別加入右美托咪定100.0 μg/mL、200.0 μg/mL[9]。以上各組每孔設6個平行樣,培養72 h。
1.3 細胞增殖及克隆形成數目測定 (1)細胞活力測定:使用MTT測定法,將細胞接種在96孔聚苯乙烯培養板中,于37 ℃、5%(v/v)的CO2中溫育24 h,然后從每個孔中除去100 μL培養基,并將100 μL不同濃度的ISO加入細胞中并溫育24 h、48 h。再將溶解于磷酸鹽緩沖鹽水中的100 μL 0.5%(w/v)MTT加入每個孔中,并孵育4 h,之后向每個孔中加入100 μLDMSO。使用Biotek Elx-800酶標儀(中國Bio-Rad實驗室有限公司)測量490 nm處的吸光度。細胞存活率=(實驗組OD-空白組OD)/(實驗組OD-SKBR-3細胞組OD)。(2)克隆形成數目測定:各組乳腺癌SKBR-3細胞培養結束后,將細胞接種在6孔板中,50/孔,37 ℃下孵育14天,PBS洗滌3次,Giemsa溶液染色細胞,從7個隨機視野計算克隆形成數目。
1.4 細胞侵襲轉移水平測定 傷口愈合測試細胞侵襲,將乳腺癌SKBR-3細胞分別接種在多孔板上,并在含有10%FBS的RPMI-1640培養基中培養,直至達到匯合為止,然后使用移液器吸頭(100 μL)閉合傷口。在測試開始時和細胞遷移2 h、4 h、6 h后捕獲圖像,比較圖像以量化細胞的遷移速率。
1.5 細胞凋亡水平測定 采用Annexin V-FITC和碘化丙啶(PI)雙重染色。所有乳腺癌SKBR-3細胞使用Annexin V試劑盒進行染色,1 h內使用流式細胞儀分析細胞。早期凋亡細胞具有暴露的磷脂酰絲氨酸,但完整的細胞膜與膜聯蛋白V-FITC結合,但排除了PI;凋亡晚期的細胞均用膜聯蛋白V-FITC和PI標記,而壞死細胞僅用PI標記。
1.6 細胞MAPK、JNK、Bcl-2基因水平測定 使用TRIzol試劑從培養的細胞中分離出總RNA 0.5 μg。使用PrimeScript RT試劑盒,用1μg總RNA合成第一鏈cDNA。應用SYBR Green qPCR SuperMix-UDG試劑在實時定量PCR使用iQTM Green Supermix iQ5實時檢測系統進行PCR。應用比較循環閾值(Ct)方法通過計算2-ΔΔCt來量化基因表達水平。引物由上海生工科技合成,序列如下:MAPK,正向:5′-CGTGAGTGCCGCCCCCGTGA-3′,反向:5′-GTGTGACCCTGCTGTGCGTGACT-3′;JNK,正向:5′-TGTGACTGTGTCGGCAGCCCGTGACG-3′,反向:5′-CGTACTGCACGAATTCGTACTG-3′;Bcl-2,正向:5′-CCGTACTGACGTCGGCACCGTGAACTG-3′,反向:5′-GTGTGACGGCGAAGTGAC-3′。
1.7 細胞MAPK、JNK、Bcl-2蛋白水平測定 將細胞用PBS(pH 7.4)洗滌2次,并在含有1%PMSF和20 mM NaF的裂解緩沖液中在冰上裂解10 min,然后將其轉移至微量離心管中,將樣品在4 ℃下以15,000 g離心10 min,之后將上清液轉移至新試管中,使用BCA蛋白質試劑盒測定總蛋白濃度。將從細胞制備的勻漿用SDS樣品緩沖液處理,并立即在95 ℃下加熱10 min。蛋白質通過SDS-PAGE膜分離后,使用半干轉移裝置電轉移至聚偏二氟乙烯膜上,在TBST(20 mM Tris,166 mM NaCl和0.05%Tween 20,pH 7.5)中的5%脫脂奶粉中封閉2 h,然后將膜在臺式濃縮器中于室溫下以70 r/min洗滌15 min,該程序重復3遍后,將一抗以建議稀釋度在TBST緩沖液中于4 ℃過夜添加,之后在TBST中洗滌3次,再加入二抗并在25 ℃下孵育2 h。印跡再經TBST洗滌3次,用化學發光底物顯影,并使用Molecular Imager Chemidoc XRS System曝光。
1.8 統計學方法 采用SPSS19.0統計軟件。計量資料以(±s)表示,多組比較采用單方差分析,兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 各組乳腺癌SKBR-3細胞的OD值、存活率比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組的OD值、存活率均降低(P<0.05);與順鉑組比較,右美托咪定低/高劑量組的OD值、存活率升高(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組的OD值、存活率降低(P<0.05)。見表1和圖1。
表1 各組乳腺癌SKBR-3細胞的OD值、存活率比較[n=6,(±s)]

表1 各組乳腺癌SKBR-3細胞的OD值、存活率比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 OD值 存活率(%)SKBR-3細胞組 0μg /mL 0.87±0.08 90.32±2.63順鉑組 100.0μg /mL 0.32±0.07a 35.63±3.41a右美托咪定低劑量組 100.0μg /mL 0.65±0.05ab 74.63±3.54ab右美托咪定高劑量組 200.0μg /mL 0.52±0.08abc 56.63±4.23abc
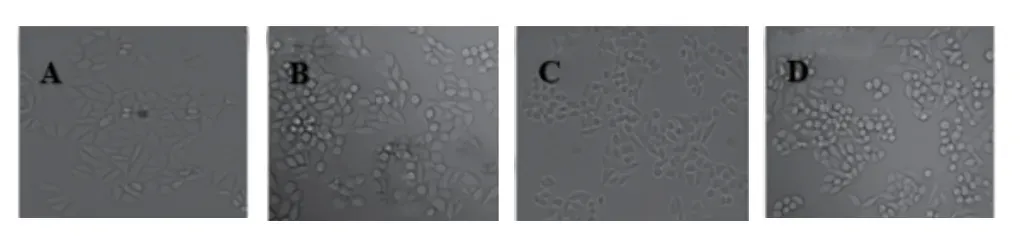
圖1 各組乳腺癌SKBR-3細胞增殖水平比較(倒置顯微鏡×400)
2.2 各組乳腺癌SKBR-3細胞的克隆形成數目比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組的克隆形成數目降低(P<0.05);與順鉑組比較,右美托咪定低/高劑量組的克隆形成數目升高(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組的克隆形成數目降低(P<0.05)。見表2和圖2。
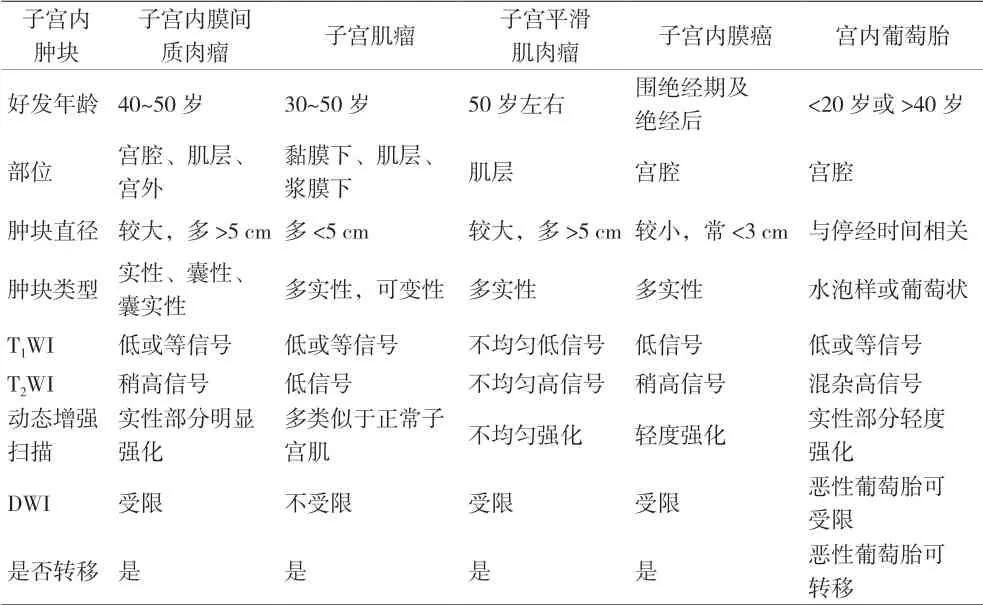
表2 子宮內實性腫塊MRI表現
表2 各組乳腺癌SKBR-3細胞的克隆形成數目比較[n=6,(±s)]
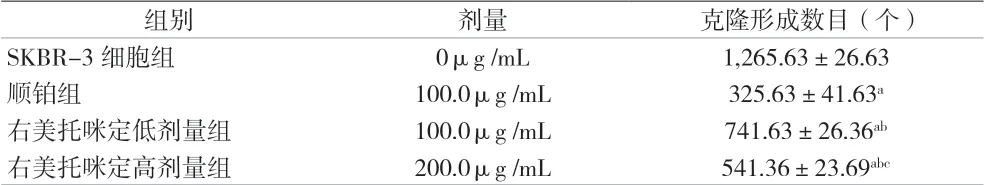
表2 各組乳腺癌SKBR-3細胞的克隆形成數目比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 克隆形成數目(個)SKBR-3細胞組 0μg /mL 1,265.63±26.63順鉑組 100.0μg /mL 325.63±41.63a右美托咪定低劑量組 100.0μg /mL 741.63±26.36ab右美托咪定高劑量組 200.0μg /mL 541.36±23.69abc

圖2 各組乳腺癌SKBR-3細胞的克隆形成數目比較(Giemsa溶液染色×400)
2.3 各組乳腺癌SKBR-3細胞的侵襲遷移能力比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組侵襲距離降低(P<0.05);與順鉑組比較,右美托咪定低/高劑量組侵襲距離升高(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組侵襲距離降低(P<0.05)。見表3和圖3。
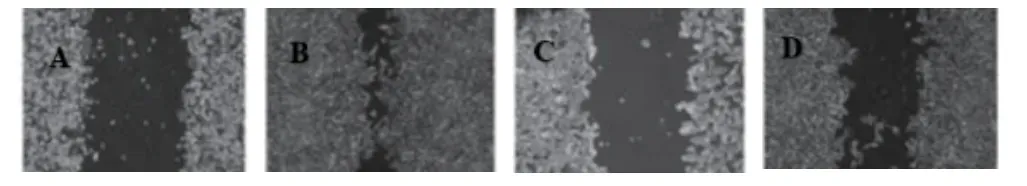
圖3 各組乳腺癌SKBR-3細胞的穿膜數目比較(0.1%結晶紫染色×100)
表3 各組乳腺癌SKBR-3細胞侵襲遷移能力的比較[n=6,(±s)]

表3 各組乳腺癌SKBR-3細胞侵襲遷移能力的比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 侵襲距離(um)SKBR-3細胞組 0μg /mL 396.63±33.84順鉑組 100.0μg /mL 90.19±26.48a右美托咪定低劑量組 100.0μg /mL 159.48±54.96ab右美托咪定高劑量組 200.0μg /mL 123.48±18.87abc
2.4 各組乳腺癌SKBR-3細胞凋亡率比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組的凋亡率升高(P<0.05);與順鉑組比較,右美托咪定低/高劑量組的凋亡率降低(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組的凋亡率升高(P<0.05)。見表4和圖4。
表4 各組乳腺癌SKBR-3細胞凋亡率比較[n=6,(±s)]
表4 各組乳腺癌SKBR-3細胞凋亡率比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 凋亡率(%)SKBR-3細胞組 0μg /mL 5.18±0.14順鉑組 100.0μg /mL 36.40±2.27a右美托咪定低劑量組 100.0μg /mL 19.00±2.24ab右美托咪定高劑量組 200.0μg /mL 46.50±2.14abc

圖4 各組乳腺癌SKBR-3細胞凋亡率比較
2.5 各組乳腺癌SKBR-3細胞MAPK、JNK、Bcl-2 mRNA的表達水平比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組的MAPK、JNK、Bcl-2 mRNA表達水平降低(P<0.05);與順鉑組比較,右美托咪定低/高劑量組的MAPK、JNK、Bcl-2 mRNA表達水平升高(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組的MAPK、JNK、Bcl-2 mRNA表達水平降低(P<0.05)。見表5。
表5 各組乳腺癌SKBR-3細胞的MAPK、JNK、Bcl-2 mRNA表達水平比較[n=6,(±s)]

表5 各組乳腺癌SKBR-3細胞的MAPK、JNK、Bcl-2 mRNA表達水平比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 MAPK JNK Bcl-2 SKBR-3細胞組 0μg /mL 5.78±0.18 5.36±0.29 6.21±0.20順鉑組 100.0μg /mL 1.45±0.21a 1.68±0.23a 2.12±0.23a右美托咪定低劑量組 100.0μg /mL 4.56±0.24ab 4.01±0.16ab 4.21±0.19ab右美托咪定高劑量組 200.0μg /mL 3.02±0.26abc 3.14±0.19abc 3.10±0.16abc
2.6 各組乳腺癌SKBR-3細胞MAPK、JNK、Bcl-2蛋白表達水平比較 與SKBR-3細胞組比較,順鉑組、右美托咪定低/高劑量組的MAPK、JNK、Bcl-2蛋白表達水平降低(P<0.05);與順鉑組比較,右美托咪定低/高劑量組的MAPK、JNK、Bcl-2蛋白表達水平升高(P<0.05);與右美托咪定低劑量組比較,右美托咪定高劑量組的MAPK、JNK、Bcl-2 蛋白表達水平降低(P<0.05)。見表6和圖5。
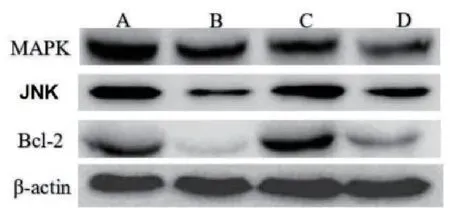
圖5 各組乳腺癌SKBR-3細胞MAPK、JNK蛋白表達水平的比較(電泳圖)
表6 各組乳腺癌SKBR-3細胞MAPK、JNK、Bcl-2蛋白表達水平比較[n=6,(±s)]

表6 各組乳腺癌SKBR-3細胞MAPK、JNK、Bcl-2蛋白表達水平比較[n=6,(±s)]
注:與SKBR-3細胞組比較,aP<0.05;與順鉑組比較,bP<0.05;與右美托咪定低劑量組比較,cP<0.05
組別 劑量 MAPK JNK Bcl-2 SKBR-3細胞組 0μg /mL 6.47±0.19 6.43±0.24 6.24±0.23順鉑組 100.0μg /mL 1.19±0.16a 2.50±0.26a 1.96±0.32a右美托咪定低劑量組 100.0μg /mL 3.48±0.19ab 5.12±0.26ab 5.14±0.23ab右美托咪定高劑量組 200.0μg /mL 1.99±0.19abc 3.15±0.45abc 2.54±0.24abc
3 討論
乳腺癌是最常見的侵襲性腫瘤之一,是全世界女性癌癥死亡的主要原因,每年有近23萬例新病例和4萬例乳腺癌死亡。 乳腺癌的早期檢測、診斷方面雖取得了進步,但外科手術以及放化療之后的復發率呈上升趨勢。因此,尋求乳腺癌新的治療藥物具有重要意義。
嗎啡、戊巴比妥、曲馬多、舒芬太尼和右旋等麻醉劑常被用于癌癥患者的手術中。研究表明,嗎啡皮下注射對于終末呼吸困難的患者非常有效;右美托咪定是一種α2腎上腺素受體激動劑,可用于減輕重癥監護病房患者的全身炎癥和劇烈疼痛,改善機械通氣圍手術期患者的呼吸功能[10];右美托咪定還具有輻射防護作用,可改善腦腫瘤的放射治療效果,可通過促進肺細胞增殖對肺泡上皮細胞的細胞凋亡起保護作用,此外右美托咪定還能抑制小鼠乳腺腫瘤細胞的侵襲性增殖[11-12]。本研究結果顯示,與SKBR-3細胞組比較,右美托咪定低/高劑量組的OD值、存活率、單克隆形成水平、侵襲距離降低,而凋亡水平升高,說明右美托咪定能夠明顯抑制SKBR-3細胞株增殖、轉移、侵襲,促進其凋亡,右美托咪定的抗癌活性歸因于細胞黏附、增殖、存活、侵襲和細胞外基質降解有關的信號通路的抑制[13]。與其他癌細胞不同,乳腺癌細胞SKBR-3不會通過間充質或類動蛋白運動的活躍機制侵入,而是通過形成腫瘤栓子侵入,在3-D培養中形成球體,球體中的SKBR-3細胞保留了E-鈣黏著蛋白的細胞-細胞黏附力。研究表明,右美托咪定可明顯抑制癌細胞E-鈣黏著蛋白表達水平。
與SKBR-3細胞組比較,本研究順鉑組、右美托咪定低/高劑量組的MAPK、JNK、Bcl-2 mRNA和蛋白表達水平降低;與順鉑組比較,右美托咪定低/高劑量組的MAPK、JNK、Bcl-2 mRNA和蛋白表達水平升高;與右美托咪定低劑量組比較,右美托咪定高劑量組的MAPK、JNK、 Bcl-2 mRNA和蛋白表達水平降低;說明右美托咪定能夠明顯抑制SKBR-3細胞MAPK、JNK、Bcl-2 mRNA和蛋白表達水平。MAPK涉及細胞生長、分化和凋亡等多種生理過程,絲氨酸/蘇氨酸激酶家族響應于不同的細胞外刺激介導細胞內信號轉導。MAPK是癌細胞生存信號轉導所必需,MAPK的抑制在角鯊烯、紫杉醇、索拉非尼、洛伐他汀、和紫杉醇等各種抗癌刺激中被證實,抑制MAPK信號可以增強順鉑誘導人類肝癌細胞凋亡的能力[14-15]。線粒體介導的凋亡途徑是固有的凋亡途徑,通過細胞色素C的釋放和隨后caspase-3的裂解,最終導致細胞凋亡。Bcl-2家族成員是線粒體釋放細胞色素c的抑制調節劑,可以通過改變其構象在線粒體外膜上形成線粒體通透性過渡孔(mPTP),使細胞色素C從線粒體釋放至細胞質[16]。細胞試驗表明,丁酸可通過抑制人結腸癌RKO細胞中的JNK激酶途徑誘導細胞凋亡,JNK抑制Bcl-2的表達可促進凋亡細胞中細胞色素c的釋放和caspase-3的活化。主要歸因于JNK通過Bcl-2的磷酸化來解離Bcl-2/Bax復合物,最終促進活性Bax從胞質向線粒體區室的轉運并誘導凋亡[17-18]。
綜上所述,右美托咪定能明顯抑制SKBR-3乳腺癌細胞增殖、轉移、侵襲,促進其凋亡,與劑量呈正性相關,作用機制與明顯抑制SKBR-3細胞MAPK、JNK、Bcl-2 mRNA和蛋白的表達進而抑制MAPK/JNK/Bcl-2信號通路的激活有關。

