優化的免疫親和柱凈化-高效液相色譜法檢測 食品中的玉米赤霉烯酮
胡 云,王 帥,鄒勇平,周元元,盧 偉,劉衍彤
(揚州市食品藥品檢驗檢測中心,江蘇揚州 225000)
玉米赤霉烯酮是鐮刀屬真菌污染玉米、小麥等谷物后產生的具有雌激素效應的真菌毒素,我國對食品中玉米赤霉烯酮的限量要求有著嚴格的規定[1-3]。目前,常用的食品中玉米赤霉烯酮檢測方法較多[4],與液相色譜-質譜法相比,液相色譜法的操作更為簡便,且設備價格適中,與熒光分光光度法相比,液相色譜法可實現大批量樣品的連續檢測,檢測效率更高,是檢驗檢測機構用于毒素檢測的首選方法。免疫親和層析是毒素分析中最常用的凈化方法之一,通過將抗體包埋在凝膠中制備的免疫親和柱具有易于制備和儲存、無需激活等優點[5]。已有研究表明[6],上樣、淋洗和洗脫條件都會影響免疫親和柱的柱回收率,雖然國家標準規定了免疫親和柱的通用凈化方法[4],但在具體應用中,為了實現痕量真菌毒素的準確檢測,對商品化的免疫親和柱的使用仍有進一步優化的必要。本文對玉米粉、玉米油、醋和黃酒中的玉米赤霉烯酮的提取和凈化方法進行優化,通過色譜柱分離以及熒光檢測器檢測,建立了一種靈敏、準確的食品中玉米赤霉烯酮的檢測方法。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
玉米粉、玉米油、醋和黃酒均購于超市;玉米赤霉烯酮免疫親和柱,3 mL/支,江蘇省蘇微微生物研究有限公司;934-AH 玻璃纖維濾紙,英國Whatman 公司。
1.1.2 試劑
甲醇、乙腈,色譜純,默克;氯化鈉、磷酸氫二鈉、磷酸二氫鉀、氯化鉀,分析純,國藥;吐溫-20,化學純,國藥;超純水,由Milli-Q 超純水機制備;玉米赤霉烯酮標準物質溶液(50.8 mg·L-1);溶劑(乙腈),色譜級,安譜。
1.2 儀器與設備
1260 高效液相色譜儀(配置FLD 檢測器),美國Agilent 公司;Milli-Q 超純水儀,美國Millipore公司;S210-K 酸度計,美國METTLER TOLEDO公司;XSR204 電子分析天平,美國METTLER TOLEDO 公司;AH40 全自動均質器,睿科集團股份公司;Fotector Plus 高通量全自動固相萃取儀,睿科集團股份公司;Auto EVA 80 全自動平行濃縮儀,睿科集團股份公司。
1.3 實驗方法
1.3.1 前處理方法
(1)提取。①玉米粉。稱取玉米粉48 g 于均質瓶中,參照《食品安全國家標準 食品中玉米赤霉烯酮的測定》(GB 5009.209—2016)的方法[4],加入4 g氯化鈉和100 mL 提取液(乙腈∶水=60 ∶40),于18 000 r·min-1高速均質200 s,立刻轉移至離心管中,于6 000 r·min-1離心10 min,準確移取10.0 mL 上清液加入50.0 mL 水稀釋并混勻,經玻纖濾紙過濾后備用。②玉米油。按照玉米粉的提取方法提取玉米油。③醋。稱取醋40 g,滴加50%(v/v)氫氧化鈉溶液調節pH 值至7.4,參照《食品安全國家標準 食品中玉米赤霉烯酮的測定》(GB 5009.209—2016)的方法[4],乙腈定容至100.0 mL,全部轉移至均質瓶中,于 18 000 r·min-1高速均質200 s,立刻用玻纖濾紙過濾,準確移取10.0 mL 濾液,加入50.0 mL 水稀釋并混勻,經玻纖濾紙過濾后備用。④黃酒。黃酒無需調節酸度,其余提取步驟與醋相同。
(2)凈化。取10.0 mL 備用的濾液,以2 秒/滴的速度通過已放置至室溫的玉米赤霉烯酮免疫親和柱,先用10 mL 0.1%吐溫20-PBS 淋洗,再用 10 mL 水淋洗,淋洗速度1 秒/滴,直至淋洗液全部通過免疫親和柱,吹干柱體至無殘留淋洗液,將1.5 mL 甲醇以0.5 mL·min-1的流速分3 次低速洗脫,收集全部洗脫液。
(3)濃縮。將洗脫液于45 ℃、0.5 L·min-1氮氣吹至近干,流動相定容至1.0 mL,濾膜過濾后上機分析。
1.3.2 液相色譜條件
色譜柱:Eclipse Plus C18(150 mm×4.6 mm,3.5 μm),美國Agilent 公司;流動相:乙腈∶水∶甲醇=46 ∶46 ∶8;流速:1.0 mL·min-1,柱溫:35 ℃,進樣量:100 μL;激發波長:274 nm,發射波長:440 nm。
1.3.3 標準溶液配制
分別移取2 μL、10 μL、20 μL、40 μL 和100 μL玉米赤霉烯酮標準物質溶液于10 mL 容量瓶中,流動相定容至刻度,配制得10.16 ng·mL-1、50.80 ng·mL-1、101.60 ng·mL-1、203.20 ng·mL-1和508.00 ng·mL-1的玉米赤霉烯酮標準溶液。
2 結果與分析
2.1 前處理條件的優化
2.1.1 優化提取方法
真菌毒素的免疫親和柱為單克隆抗體結合的凝膠顆粒,已有研究表明,玉米赤霉烯酮和抗體之間的相互作用受有機溶劑影響[6],將玉米赤霉烯酮溶于水、PBS、10%的乙腈水溶液后過柱,回收率大于95%,但是,將玉米赤霉烯酮溶于20%的乙腈水溶液后過柱,回收率則降低為86%,因此,玉米赤霉烯酮過柱時,溶液中乙腈的比例不宜高于10%。按照《食品安全國家標準 食品中玉米赤霉烯酮的測定》(GB 5009.209—2016)的提取方法[4],樣品經提取、稀釋、過濾,濾液中乙腈的比例為12%~18%,影響玉米赤霉烯酮免疫親和柱的回收率。因此,實驗調整了提取方法,優化的提取方法為調整提取液中乙腈的濃度,由90%降至60%;此外,在稀釋步驟中,將1 ∶4 的稀釋比調整為1 ∶5 的稀釋比,同時為了不影響檢測方法的靈敏度,適當增加樣品的稱樣量。經過優化,樣品中玉米赤霉烯酮的最低回收率從75.6%提升至81.3%。
2.1.2 優化免疫親和柱的凈化條件
洗脫步驟影響免疫親和柱的柱回收率,為了使玉米赤霉烯酮盡可能多地被洗脫,采用了低流速分次洗脫的方法。用2.0 mL甲醇洗脫柱載量為1 117.6 ng的玉米赤霉烯酮,分4 次,每次以0.5 mL·min-1的低速向免疫親和柱中注入0.5 mL 甲醇,等待10 s,注入和等待期間不使甲醇流出,然后,以0.5 mL·min-1的流速慢洗脫,待此部分甲醇全部流出后,進行下一次洗脫,直至2.0 mL 甲醇洗脫液全部流出。此方法的玉米赤霉烯酮洗脫情況見圖1。由圖1 可知,第1 次、第2 次和第3 次的甲醇洗脫液中玉米赤霉烯酮的量分別為217 ng、595 ng 和276 ng,第4 次的甲醇洗脫液中沒有檢測到玉米赤霉烯酮,說明1.5 mL甲醇分3 次低速洗脫,可以使玉米赤霉烯酮全部洗脫。3 次洗脫液的玉米赤霉烯酮的總量為1 088 ng,柱回收率達到97.4%,可見,采用1.5 mL 甲醇以 0.5 mL·min-1的低流速分3 次洗脫的方法,能使玉米赤霉烯酮的免疫親和凈化達到較為理想的柱回收效果。
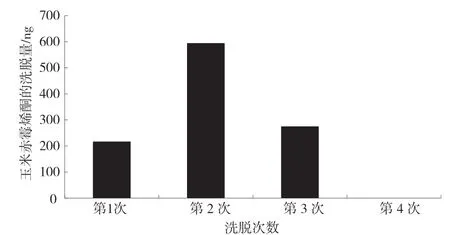
圖1 甲醇低流速分次洗脫時玉米赤霉烯酮的分布情況
將4.1 ng、10.2 ng、50.8 ng、101.6 ng、203.2 ng、304.8 ng、406.4 ng、508.0 ng、609.6 ng、711.2 ng、812.8 ng、914.4 ng、1 016.0 ng、1 219.2 ng、1 422.4 ng、1 524.0 ng、1 625.6 ng、1 727.2 ng、1 828.8 ng 和 2 032.0 ng 的玉米赤霉烯酮分別注入免疫親和柱,在優化的免疫親和柱凈化條件下,考察柱回收率,結果見圖2。當玉米赤霉烯酮的載柱量在4.1 ~1 828.8 ng 時,柱回收率在80.9%~101.5%,玉米赤霉烯酮免疫親和柱的柱效較高,當玉米赤霉烯酮的載柱量在2032.0 ng 時,柱回收率在69.8%,柱效開始降低,由此可見對于玉米赤霉烯酮含量較高的樣品,要獲得較為精準的檢測結果,應將濾液進一步稀釋后,再由免疫親和柱凈化。
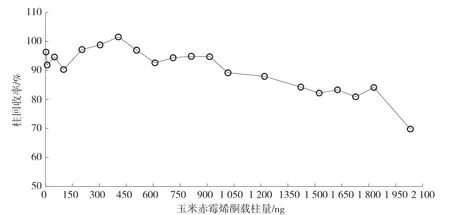
圖2 玉米赤霉烯酮免疫親和柱柱效(4.1 ~2 032.0 ng)
2.2 方法的線性范圍與檢出限、定量限
玉米赤霉烯酮在10.16 ~508.00 ng·mL-1時,校正曲線y=0.047 93x+0.013 76,相關系數為0.999 96。分別以優化后的前處理方法處理玉米粉、玉米油、醋和黃酒,其中,玉米粉和玉米油中玉米赤霉烯酮的檢出限為0.42 μg·kg-1,定量限為1.4 μg·kg-1,醋和黃酒中玉米赤霉烯酮的檢出限為0.35 μg·kg-1,定量限為 1.2 μg·kg-1,低于國家標準中5 ~50 μg·kg-1的檢出限,17 ~165 μg·kg-1的定量限,說明優化后的檢測方法具有較高的檢測靈敏度。
2.3 方法的加標回收率與精密度
依據《食品安全國家標準 食品中玉米赤霉烯酮的測定》(GB 5009.209—2016)中規定的定量限[4]和《食品安全國家標準 食品中真菌毒素限量》(GB 2761—2017)中規定的最高殘留限量[3],選擇定量限點、標準曲線中合適點和接近最高殘留限量的點(標準沒有規定的則選擇標準曲線中濃度較高的點)進行3 水平的加標回收試驗,每個水平重復6 次,計算平均加標回收率和實驗室內變異系數,結果見表1[7]。
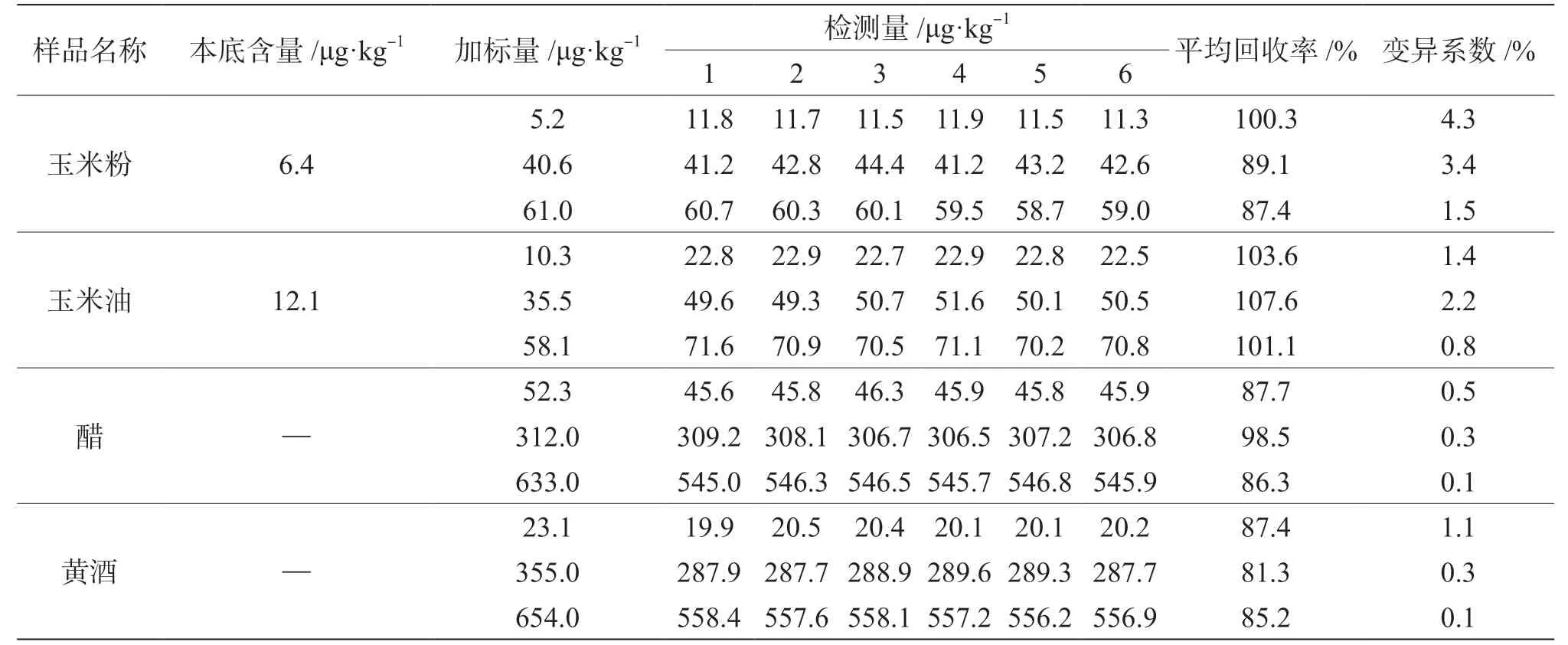
表1 樣品中玉米赤霉烯酮的加標回收率及實驗室內變異系數
4 種食品中玉米赤霉烯酮的平均加標回收率在81.3%~107.6%,實驗室內變異系數在0.1%~4.3%,符合國家標準規定的檢驗方法確認的技術要求[7]。4 種食品中,黃酒中玉米赤霉烯酮3 水平加標回收率較其他3 種食品低,可能是因為黃酒中含有一定量的醇類有機物,在一定程度上影響了免疫親和柱的柱效。在市場中隨機購買的玉米油和玉米粉中均檢出了玉米赤霉烯酮,但是,國家標準僅規定了玉米粉等谷物及其制品中玉米赤霉烯酮的限量要求,對玉米油沒有作出規定,今后有必要對市場中玉米油的玉米赤霉烯酮含量進行風險監測,并進行分析評估。
2.4 方法的準確度
對玉米油質控樣品中玉米赤霉烯酮的含量進行檢測,結果為105.8 μg·kg-1,該質控樣品中玉米赤霉烯酮的特性值為108.6 μg·kg-1,特性值區間為89.8 ~127.4 μg·kg-1,說明優化的檢測方法準確度高,適用于食品中玉米赤霉烯酮的檢測。
3 結論
實驗優化了食品中玉米赤霉烯酮的提取條件和免疫親和柱的凈化方法,柱回收率較優化前有了提高,方法靈敏度高,檢出限和定量限均低于國家標準方法,定量結果準確。實驗使用了均質器、固相萃取儀和平行濃縮儀,在實現大批量檢測的同時,獲得了優于人工操作的、穩定的平行檢測結果。綜上,本方法適用于食品中玉米赤霉烯酮含量的檢測。自然界中的玉米赤霉烯酮普遍存在,除了污染谷物、飼料、食用和藥用草藥外[6,8-9],存在于霉菌產毒菌絲的菌絲體和孢子中的玉米赤霉烯酮還會污染農業生產環境中的空氣[10],進而對動物和工人健康造成潛在危害。玉米赤霉烯酮在動物體內產生的代謝產物α-玉米赤霉烯醇和β-玉米赤霉烯醇具有與玉米赤霉烯酮同樣的類雌激素效應,且容易污染牛奶和奶制品[11]。因此,對國家標準沒有作限量要求的食品以及環境進行玉米赤霉烯酮及其代謝產物的風險監測和安全性評估是今后需要努力的方向。

