米曲霉發酵廚余垃圾制備富酶產物的研究
賈 璇,郭 萌,冶榮霞,李 輝,李雪琪,劉曉佩,李鳴曉,戴 昕
1. 北京工商大學,中國輕工業清潔生產和資源綜合利用重點實驗室,北京 100048
2. 北京工商大學,國家環境保護食品鏈污染防治重點實驗室,北京 100048
3. 中國環境科學研究院,環境基準與風險評估國家重點實驗室,北京 100012
4. 南京萬德斯環保科技股份有限公司,江蘇 南京 211100
廚余垃圾是指居民日常生活和學校、公司等單位供餐,以及餐飲服務等活動中產生的有機垃圾,在生活垃圾中占比為49.4%~64.5%. 廚余垃圾具有高油脂、高含水率、高有機質和高鹽分“四高”屬性,并且含有多種微量元素,易腐敗和滋生細菌. 隨著我國垃圾分類政策的實施,廚余垃圾產量劇增,據報道,2020年我國廚余垃圾產量已達到1.2×10t. 廚余垃圾的高值化利用迫在眉睫,其中生物處理因其條件溫和、產物可控,成為國內外研究熱點. Dienye等利用水果廢棄果皮和黑曲霉的遺傳特性菌株白化金藻()生產檸檬酸,發現白化金藻適合培養黑曲霉,具有較大的檸檬酸生產潛力,并可減少農業環境污染. Jurado等研究認為,接種菌劑可以強化在處理過程中整個微生物系統的生長及活性. Kwan等研究表明,真菌水解發酵干酪乳桿菌是將餐廚垃圾轉化為乳酸的有效途徑.
在廚余垃圾生物處理過程中,菌株的選取至關重要. 米曲霉分泌的豐富酶系能有效降解淀粉及蛋白質原料,為其他微生物的生長代謝奠定基礎. 目前,米曲霉已應用于食品加工領域,但在有機廢棄物資源化領域的研究剛剛起步. Mamo等發現,利用米曲霉產凝乳蛋白酶可提高丹伯干酪的生產率. Miyazawa等證明,半乳糖氨基半乳聚糖和α-1,3-葡聚糖都有助于米曲霉菌絲在液體培養中的聚集. 汪剛慧將米曲霉接種到餐廚垃圾中生產水解酶,利用生物酶強化污泥厭氧消化. Pleissner等在泡盛曲霉和米曲霉的深層發酵中,獲得了富含葡萄糖、磷酸鹽的水解產物. Pengthamkeerati等以木薯、甘蔗渣和污泥為培養基,接種米曲霉TISTR 3 605進行固態發酵產生α-淀粉酶. Balakrishnan等用食用油餅固態發酵優化了酸堿度、培養時間和溫度的條件,從而提高了米曲霉生產α-淀粉酶的速率.
目前,對米曲霉的研究僅局限于食品加工、生長特性、污泥的厭氧消化和富含營養物質的水解產物等方向,對于不同米曲霉的生長特性和產酶規律尚有待研究. 因此,該研究以廚余垃圾為底物,通過對比兩株米曲霉的生長特性及其好氧發酵過程中的產酶規律,旨在為廚余垃圾高值化利用提供理論依據和技術支撐.
1 材料與方法
1.1 試驗材料
廚余垃圾
廚余垃圾取自北京某大學食堂,將廚余垃圾中的骨頭、果核等大塊雜質分揀出后,用粉碎機勻漿,過20目(0.85 mm)篩后置于4 ℃冰箱保存備用. 廚余垃圾基本理化指標如表1所示.

表 1 廚余垃圾基本理化指標Table 1 Basic physical and chemical indexes of kitchen waste
米曲霉
所用米曲霉CGMCC3.4427 (簡稱“米曲霉C”)購于中國微生物菌種保藏管理委員會普通微生物中心,米曲霉BNCC142787 (簡稱“米曲霉B”)購于北納創聯生物技術研究院.
1.2 試驗設計
米曲霉孢子液制備
將平板培養的米曲霉收集至無菌瓶中,用無菌水稀釋100倍后置于4 ℃冰箱保存備用,利用稀釋平板計數法測得米曲霉B、米曲霉C的孢子懸浮液的濃度分別為90、85個/mL.
生長條件優化
分別取米曲霉B和米曲霉C的孢子懸浮液5 mL接種到100 mL液體培養基(葡萄糖2%、蛋白胨1%、KHPO0.1%、MgSO0.05%、NaCl 0.05%)中,于38 ℃、120 r/min下培養,每隔24 h取出2 mL液體培養基,用濾紙過濾后將真菌菌絲體烘干后稱量,以菌絲體干質量為縱坐標、培養時間為橫坐標,繪制米曲霉的生長曲線.
采用察氏固體培養基培養72 h后進行形態觀察,探究米曲霉B和米曲霉C在不同溫度(20、30、40、50 ℃)和pH(5、6、7)條件下的生長特性.
米曲霉酶源制備
接種米曲霉孢子懸浮液,研究不同培養方式(靜置、振蕩)和培養溫度(30、35、40 ℃)對兩株米曲霉固態發酵產酶活性的影響. 為保證試驗的準確性且獲得更好的富酶產物,通過滅菌方式開展研究,避免土著生物的干擾.
設計10組試驗,每組設3個平行. 每個錐形瓶內稱取50 g破碎后的廚余垃圾,初始pH調至6,高溫滅菌并冷卻至室溫后,各接種1 mL米曲霉B、米曲霉C的孢子懸浮液,加入1 mL無菌水混合培養,每隔24 h取樣測定指標. 試驗設計如表2所示.
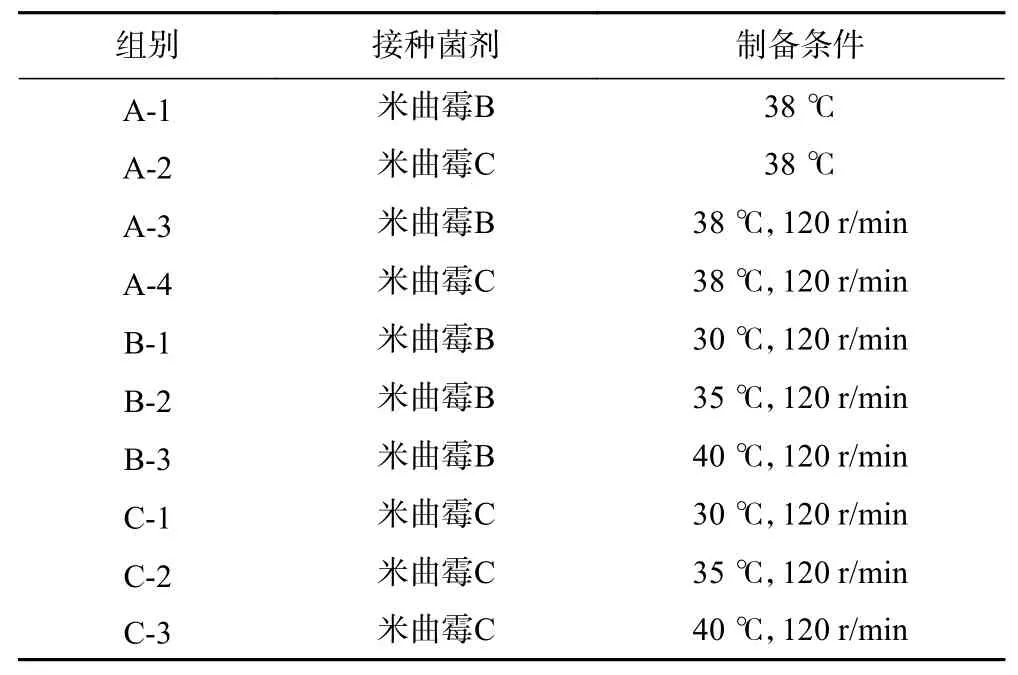
表 2 廚余垃圾酶源制備試驗設計Table 2 Experimental design of preparation of enzyme source from kitchen waste
1.3 分析方法
總固體(TS)含量和揮發性固體(VS)含量采用恒重法測定;蛋白質含量采用凱氏定氮法測定;淀粉含量、溶解性碳水化合物含量分別采用酸水解法和蒽酮法進行測定;pH使用pH計測量;蛋白酶、淀粉酶活性分別采用微生物蛋白水解酶、淀粉水解酶ELISA試劑盒測定.
2 結果與分析
2.1 米曲霉的生長特性分析
米曲霉生長曲線
絲狀真菌類的微生物與細菌類的微生物不同,其菌體的生長主要由菌絲體的延伸完成. 米曲霉B和米曲霉C在察氏培養基中的生長曲線如圖1所示,結果表明,兩株米曲霉的生長曲線均分為對數期(0~48 h)、穩定期(48~96 h)和衰亡期(96~120 h). 在培養初期,米曲霉逐漸適應環境開始生長,培養液中出現肉眼可見的菌絲,隨后菌絲體生長速率加快,進入對數生長期,菌絲開始不斷地增長和增厚,菌液中開始出現黏液狀菌絲,72 h后米曲霉進入生長衰亡期,由于菌絲體自溶,菌絲體干質量開始減少. 張曉琦發現,在pH為5、溫度為35 ℃、轉速為140 r/min、56 h條件下米曲霉生長曲線也呈現先升后降的趨勢. 試驗結果顯示,米曲霉B和米曲霉C的干質量分別在72和48 h達到最大值,分別為0.120和0.111 g.
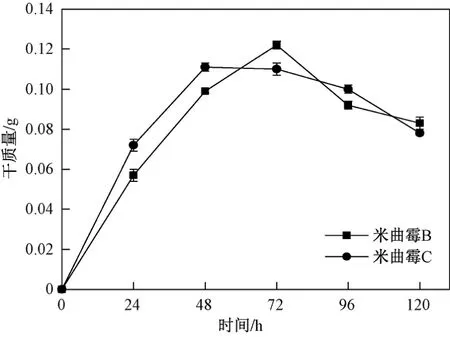
圖 1 兩種米曲霉的生長曲線Fig.1 Growth curve of two Aspergillus oryzae
米曲霉形態特征
每種真菌都有最適合其生長的溫度,且pH直接影響細胞外酶的活性和微生物的代謝. 米曲霉B和米曲霉C在不同溫度(20、30、40、50 ℃)和pH(5、6、7)條件下培養72 h后的形態特征分別如圖2、3所示. 米曲霉在察氏固體培養基上形成菌落較快,培養初期生出孢子,初為嫩黃色,繼而轉到黃綠色,米曲霉的生長可分為3個階段:孢子發芽期、菌絲生長期、產孢子期.
由圖2、3可見,在20 ℃下,米曲霉B和米曲霉C生長緩慢;在30和40 ℃、培養72 h下,米曲霉B、米曲霉C的生長速率在pH為6時生長最佳,其中40 ℃下的生長速率快于30 ℃;在50 ℃、培養72 h下,米曲霉B和米曲霉C分別在pH為5、6的條件下有菌絲體產生,其余pH下米曲霉不生長. 米曲霉B和米曲霉C菌株在培養后期呈黃綠色,其中米曲霉B顏色偏綠,菌絲較長,容易結塊,孢子多;米曲霉C顏色偏黃,菌絲較短,結塊較少,孢子較多.
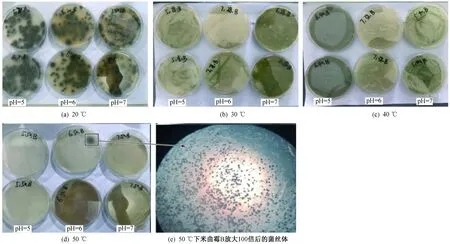
圖 2 米曲霉B在不同溫度和pH下的生長情況Fig.2 Growth of Aspergillus oryzae B under different temperatures and pH conditions
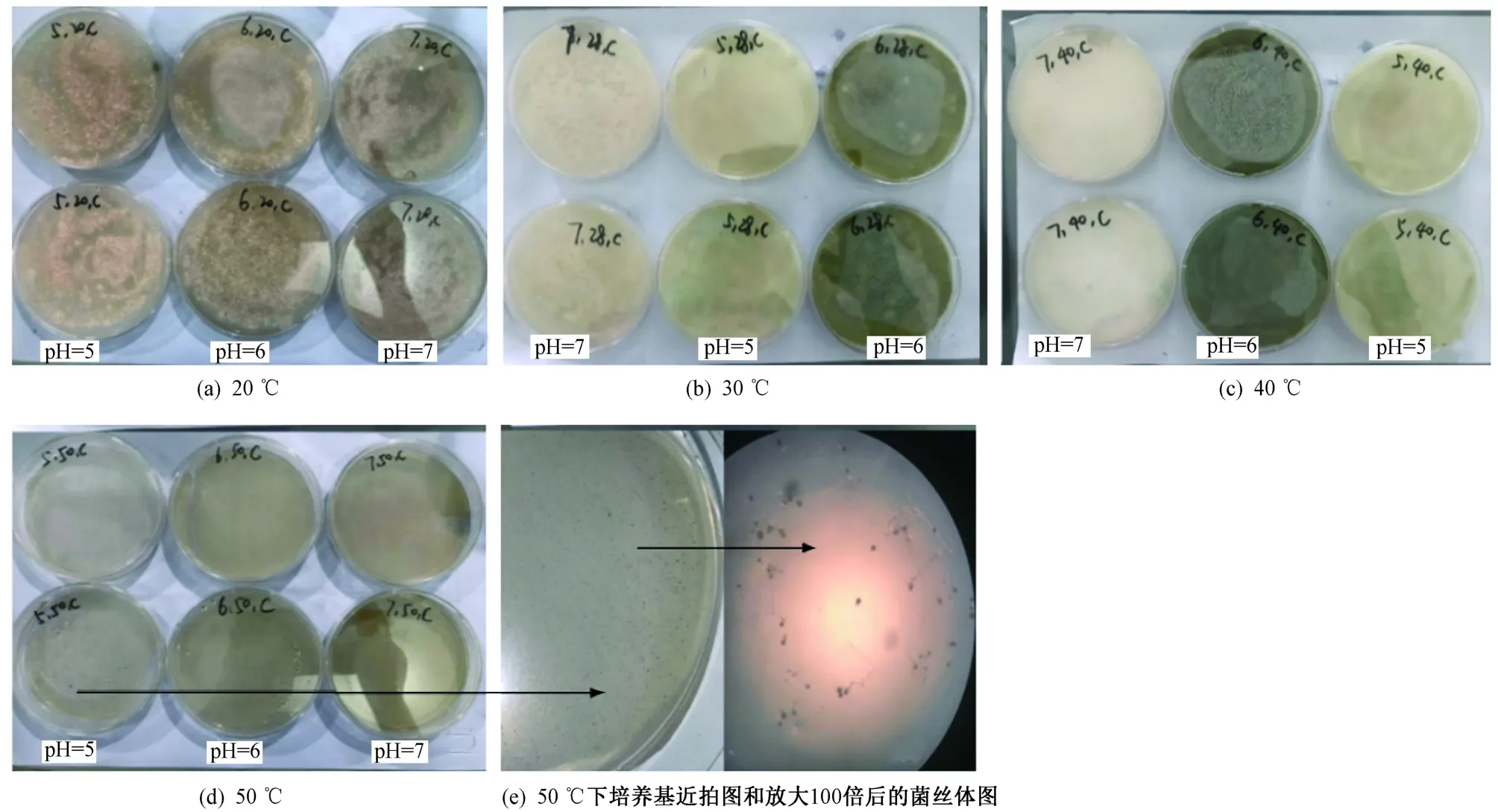
圖 3 米曲霉C在不同溫度和pH下的生長情況Fig.3 Growth of Aspergillus oryzae C under different temperatures and pH conditions
由米曲霉的形態分析可知,米曲霉的菌絲體由分割的分枝菌絲所構成,從菌絲體中生出分生孢子,孢子均呈圓形. 相對于其他情況,兩株米曲霉分別在30 ℃和40 ℃、pH為6時生長最好,米曲霉B生長速率較快,產孢子較早.
2.2 不同培養方式對米曲霉產酶的影響
在米曲霉培養過程中,不同培養方式對米曲霉菌絲體的形成、形態和發酵產酶都有一定影響. 因此,探究在靜置培養與振蕩培養下米曲霉的產酶效果,選取A-1、A-2、A-3、A-4處理組進行分析.
培養方式對蛋白酶活性的影響
蛋白酶活性是表征廚余垃圾固態發酵酶源制備過程中酶活變化的重要參數,蛋白酶是催化其他蛋白質中肽鍵水解的一大類酶,可高效快速水解廚余垃圾中的蛋白質,將其轉化為游離氨基酸.
如圖4所示,在38 ℃下靜置培養的A-1組以及振蕩培養的A-3組中蛋白酶活性均呈上升-下降-
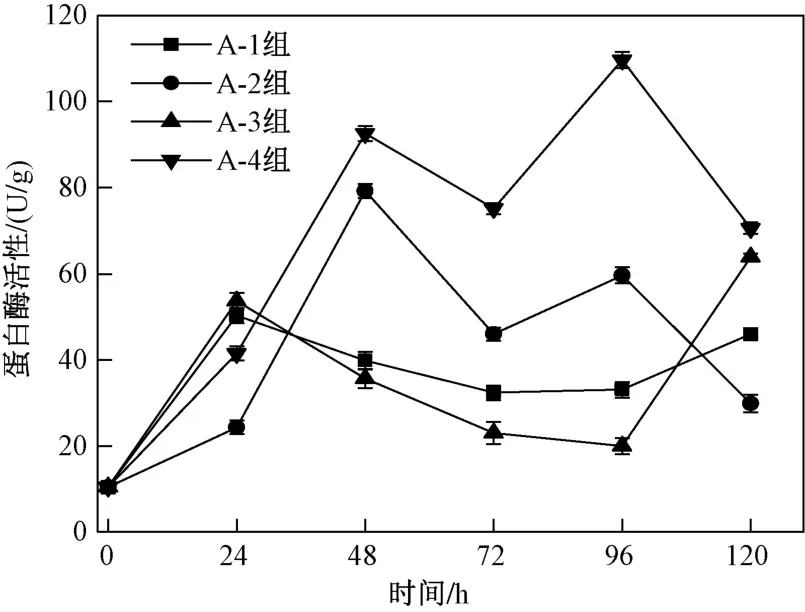
圖 4 不同培養方式下米曲霉產蛋白酶活性隨時間的變化情況Fig.4 Changes of protease activity of Aspergillus oryzae in different culture methods with tim
上升的趨勢. 米曲霉菌絲適應新環境時吸收充足營養,新陳代謝加快,分泌大量酶. 在24 h時,A-1、A-3組的蛋白酶活性分別為50.30、53.65 U/g,可以得出,轉速影響霉菌菌絲體的形成及形態,振蕩(120 r/min)培養下米曲霉B的蛋白酶活性高于靜置培養;在24~96 h內,隨著發酵的進行,A-1、A-3組的蛋白酶活性達到一定值后呈下降趨勢,96 h時分別降至33.05、19.99 U/g,可能是因為營養物的耗盡和大量代謝廢物的產生,形成了大量的休眠孢子,最終降低了酶的活性;96~120 h內蛋白酶活性升高,120 h時分別升至45.99、63.85 U/g.
在38 ℃下靜置培養的A-2組以及振蕩培養的A-4組的蛋白酶活性在0~48 h內呈上升趨勢,48 h時分別升至79.19、92.57 U/g,A-4組的蛋白酶活性高于A-2組,48 h時達到第1個峰值,原因可能是振蕩培養的方式能夠更好地使廚余垃圾與米曲霉充分接觸,混合均勻,故能更好地促進米曲霉的菌體生長,進而促進其孢子增殖,可以推斷,振蕩培養可以提高米曲霉的產酶速率;在48~72 h內,A-2、A-4組的蛋白酶活性呈下降趨勢,由于蛋白酶的不斷溶出,環境內酶量達到環境容納量(值)使其競爭加強,酶活性下降. 在72~96 h內,A-2、A-4組中蛋白酶活性升高,在96 h時達到第2個峰值(109.65 U/g),可能是因為,米曲霉穩定生長且廚余垃圾中的營養物質還未消耗盡,隨著時間的延長,米曲霉繼續吸收環境內的營養物質,促進蛋白酶溶出. 由此可見,振蕩培養可加強米曲霉菌絲體的形成和生長速率,加快其繁殖,促進酶分泌,使米曲霉B和米曲霉C的蛋白酶活性分別提高26.94%、38.46%,明顯優于靜置培養.
培養方式對淀粉酶活性的影響
淀粉酶活性是表征廚余垃圾酶源制備過程酶活變化的主要參數,淀粉酶可將淀粉和糖原轉化為單糖或低聚糖等可發酵性糖,為米曲霉及其他微生物提供碳素營養,淀粉酶活性的增加可以使發酵過程中微生物獲得更多的碳源,促進碳代謝.
由圖5可見,在0~24 h內,A-1、A-2、A-3、A-4組的淀粉酶活性均上升,其中A-2組數值最大,為84.07 U/g;在24~48 h內,A-1、A-3組的淀粉酶活性繼續上升,A-2、A-4組的淀粉酶活性呈下降趨勢,在48 h時,A-1、A-3組的淀粉酶活性分別為64.98、52.64 U/g,由于米曲霉C生長較快,產生孢子較早,產酶快,分解速率快,這兩組的淀粉酶活性低于A-2、A-4組,可見,無論是振蕩培養還是靜置培養,米曲霉B的淀粉酶活性均低于米曲霉C;在48~72 h內,4個處理組的淀粉酶活性均呈下降趨勢,表明隨著發酵時間的延長,菌絲體不斷地斷裂與溶解,新陳代謝速率減慢,使淀粉酶活性降低;在72~120 h內,A-1、A-3、A-4組的淀粉酶活性呈上升趨勢,至120 h時,A-3組的淀粉酶活性達到最高值,為137.92 U/g. 綜上,在振蕩條件下,兩株米曲霉在廚余垃圾中產淀粉酶能力更強,淀粉酶活性分別提高54.65%、43.76%,反應底物中有大量可利用的溶解性有機物質,伴隨著微生物迅速繁殖充分吸收營養物質進而大量分泌淀粉酶,促使反應體系中淀粉酶含量增加.
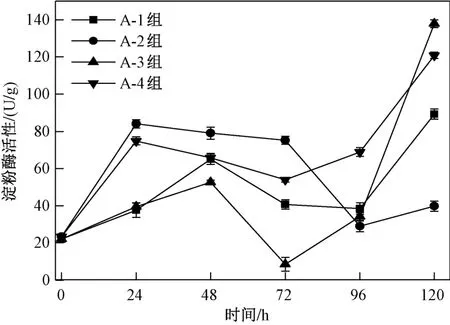
圖 5 不同培養方式下米曲霉產淀粉酶活性隨時間的變化情況Fig.5 Changes of amylase activity of Aspergillus oryzae in different culture methods with tim
2.3 不同培養溫度對米曲霉產酶的影響
溫度是影響酶的重要因素之一. 較高的溫度會對微生物的代謝活動產生一些不利影響,還會抑制真菌生長. 由節得出,在振蕩培養下兩株米曲霉的產酶活性優于靜置培養,基于此,探究不同溫度(30、35、40 ℃)對米曲霉B和米曲霉C產酶的影響.
培養溫度對蛋白酶活性的影響
由圖6可見,在0~120 h內,B-1、B-3、C-1、C-2、C-3組中的蛋白酶活性均呈上升-下降-上升-下降的趨勢. 在0~24 h內,兩種米曲霉進入新環境發生應激反應,使蛋白酶活性均呈上升趨勢,且米曲霉B的蛋白酶活性在30 ℃時升至64.23 U/g;在24~48 h內,隨溫度的升高,B-2、B-3、C-3組蛋白酶的催化速率增加,活性較高,且48 h時B-3組的蛋白酶活性(66.64 U/g)最佳;在48~72 h內,B-1、C-1、C-2組蛋白酶繼續溶出,蛋白酶活性上升,B-2、B-3、C-3組蛋白酶活性下降,在72 h時C-2組蛋白酶活性升至63.55 U/g. 在72~120 h內,B-2、C-3組蛋白酶活性呈先升后降的趨勢,且96 h時C-3組蛋白酶活性達到峰值(64.02 U/g),米曲霉C蛋白酶活性在96 h時達到了穩定期峰值. 隨著發酵時間的延長,營養物逐漸耗盡,菌體自溶,菌體不再產生孢子,蛋白酶活性下降. B-1、B-3、C-2組蛋白酶活性呈下降趨勢,C-1組則呈先降后升的趨勢.
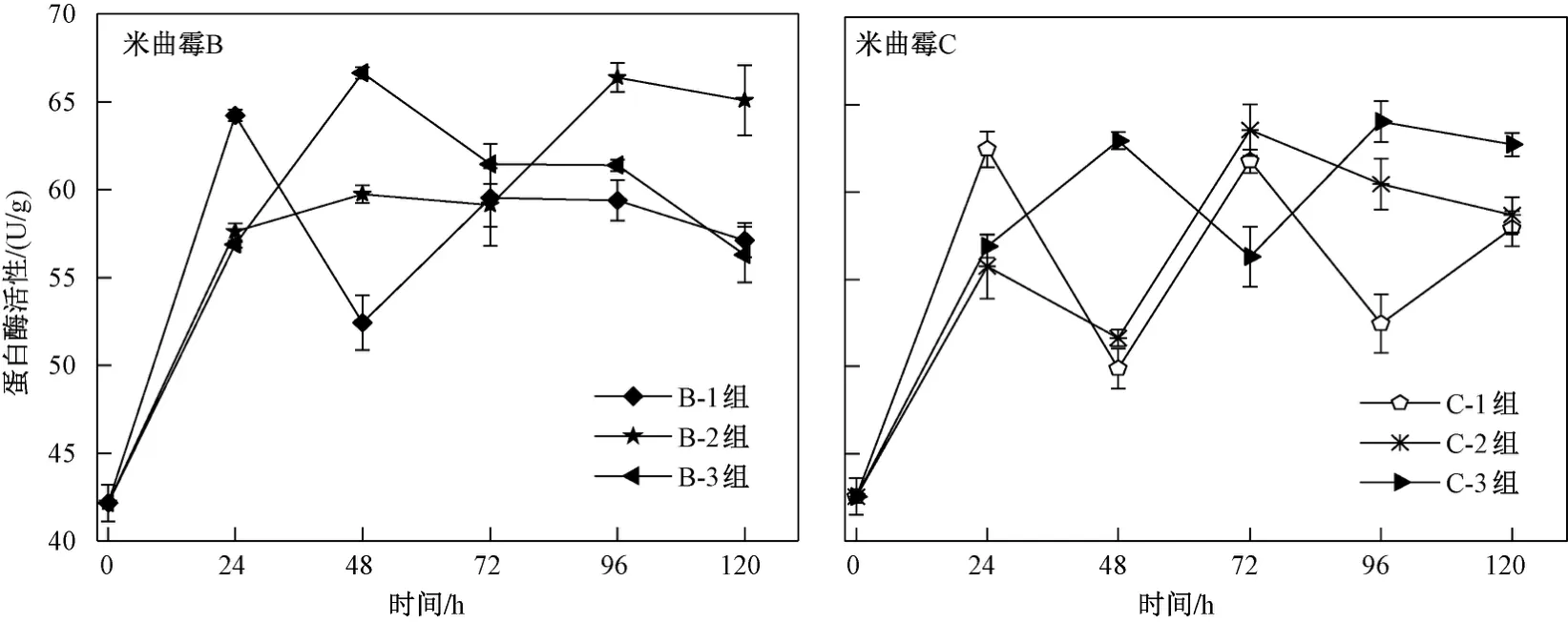
圖 6 不同培養溫度下米曲霉B和米曲霉C產蛋白酶活性隨時間的變化情況Fig.6 Changes of protease activity of Aspergillus oryzae B and Aspergillus oryzae C with time at different culture temperatures
綜上,米曲霉B在40 ℃下培養48 h時蛋白酶活性(66.64 U/g)最高,米曲霉C在40 ℃下培養96 h時的蛋白酶活性(64.02 U/g)最高.
培養溫度對淀粉酶活性的影響
由圖7可見,隨著培養時間的延長,B、C兩組淀粉酶活性均呈上升-下降-上升-下降的趨勢,分別降至99.10 U/g(B-1組)、99.41 U/g(B-2組)、101.68 U/g(B-3組)、106.33 U/g(C-1組)、105.43 U/g(C-2組)、96.57 U/g(C-3組). 0~120 h內,B-1組在30 ℃下培養48 h時淀粉酶活性(129.44 U/g)達到最高;C-3組在40 ℃下培養96 h時淀粉酶活性(131.11 U/g)達到最高.
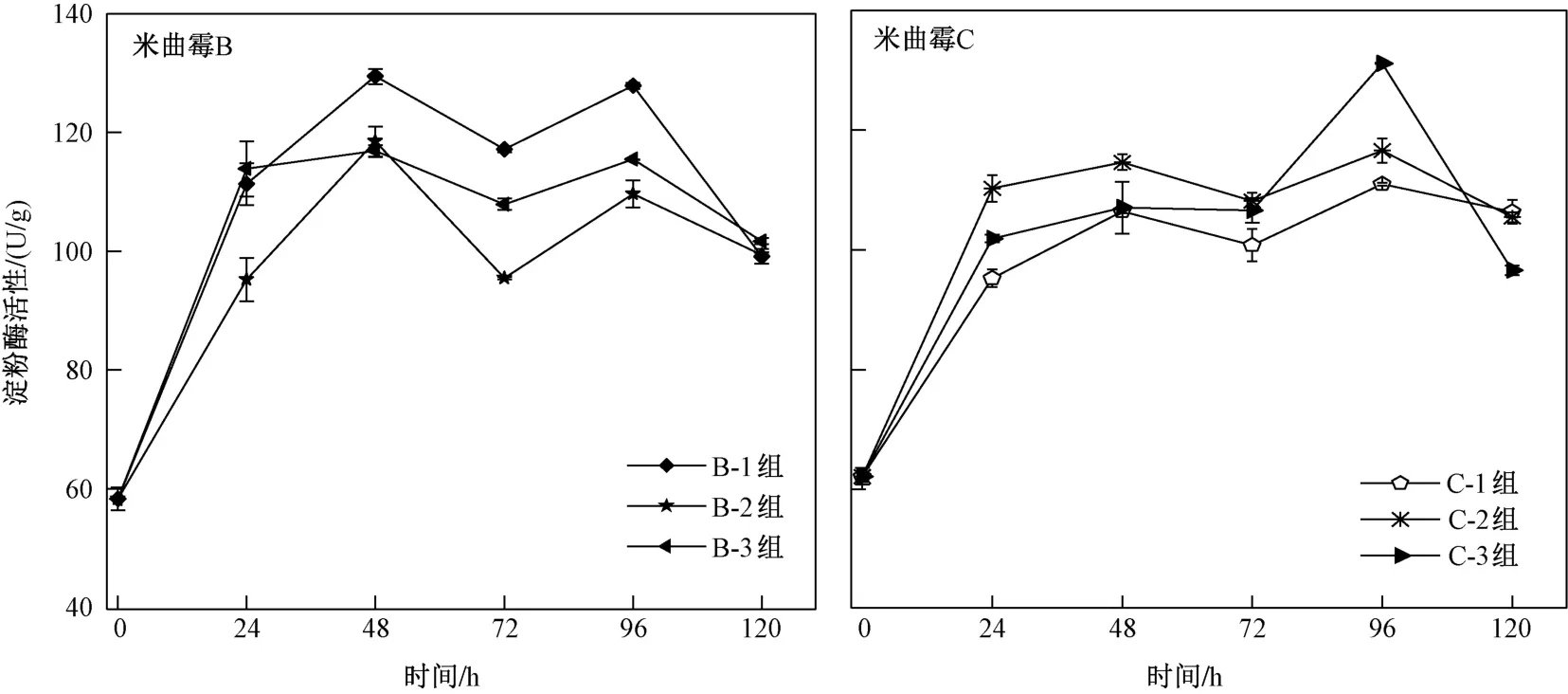
圖 7 不同培養溫度下米曲霉B和米曲霉C產淀粉酶活性隨時間的變化情況Fig.7 Changes of amylase activity of Aspergillus oryzae B and Aspergillus oryzae C with time at different culture temperatures
在0~48 h內,由于米曲霉的快速生長和生長代謝活動,淀粉酶活性迅猛增長. 48~72 h內淀粉酶活性降低的原因可能是,隨著生長時間的延長,菌絲不斷溶解和斷裂. 72~96 h內淀粉酶活性升高的原因可能是,雖然處于穩定期,但也有部分米曲霉菌絲體產生,96~120 h,由于米曲霉進入衰敗期,培養基中營養物質的耗盡導致淀粉酶活性降低.
綜上,米曲霉B在30 ℃下培養48 h時淀粉酶活性達到最高,米曲霉C在40 ℃下培養96 h時淀粉酶活性達到最高. 但從整個淀粉酶活性周期綜合來看,米曲霉B的淀粉酶活性高于其他各組,故米曲霉B的淀粉酶活性優于米曲霉C.
3 結論
a) 米曲霉B和米曲霉C分別在30 ℃和40 ℃、pH為6時生長速率最佳;與靜置培養相比,振蕩培養可使米曲霉B和米曲霉C的蛋白酶活性分別提高26.94%、38.46%;淀粉酶活性分別提高54.65%、43.76%. 可見,振蕩培養顯著加強米曲霉菌絲體的形成和生長速率,加快其繁殖,促進淀粉酶和蛋白酶分泌,明顯優于靜置培養.
b) 廚余垃圾好氧發酵過程中,米曲霉B和米曲霉C產生蛋白酶與淀粉酶的潛在能力相當. 在120 r/min、40 ℃條件下,米曲霉B、米曲霉C的蛋白酶活性分別在48 h、96 h時達到最大,分別為66.64、64.02 U/g. 隨溫度的升高,蛋白酶催化的速率加快,活性升高,當溫度過高時,酶活性受到抑制,同時隨著時間的延長,菌體不再產生孢子,導致活性下降;在120 r/min下,30 ℃培養48 h、40 ℃培養96 h時,米曲霉B、米曲霉C產淀粉酶活性分別達到最高,為129.44、
131.11 U/g.
c) 米曲霉B可在更溫和的條件下實現產酶,采用其好氧發酵廚余垃圾制備的富酶產物可以為目前廚余垃圾處理提供一種經濟、可行、處理能效高的生物酶制劑,為廚余垃圾全量高值化利用提供技術支撐.

