妊娠期高血壓患者子代胎盤組織中長非編碼RNA表達差異分析
高永寧,劉珍珍,李玉明,胡金朋
妊娠期高血壓是妊娠婦女妊娠20周后新出現的血壓異常升高[收縮壓和(或)舒張壓≥140/90 mmHg],血壓在分娩后可恢復正常[1]。妊娠期高血壓發病率為2%~8%,可造成胎兒窘迫、早產、胎兒發育遲緩、胎盤早剝、新生兒死亡等不良妊娠結局。臨床主要采取對癥治療,如擴容、降壓、解痙等,而終止妊娠或分娩是唯一的根治方法。目前關于妊娠期高血壓具體的發病機制或分子途徑仍不十分清楚,但研究顯示,妊娠期高血壓患者胎盤常伴有動脈硬化和梗死,而這與滋養層細胞浸潤及螺旋動脈的生理性改變具有相關性,最終導致胎盤缺血,因此認為滋養層細胞侵襲功能障礙可誘發妊娠期高血壓[2]。長非編碼RNA(lncRNA)作為一種調控因子,在分子水平參與了核質運輸、表觀遺傳調控、轉錄調控、染色體劑量補償及mRNA剪接、翻譯等[3];而在細胞水平,lncRNA則參與細胞周期、細胞分化、細胞自噬、細胞凋亡、細胞增殖等的調節,因此lncRNA與機體發育過程和多種疾病有關,但具體作用機制還不十分清楚[4-5]。近年來,lncRNA在妊娠期高血壓中的表達情況及可能發病機制已成為研究熱點,研究顯示,妊娠期高血壓患者胎盤內lncRNA的差異表達與胎盤滋養層細胞功能相關[6]。因此,本研究擬通過采用高通量測序手段分析妊娠期高血壓患者和健康孕婦分娩后的胎盤組織,探討妊娠期高血壓患者lncRNA表達情況及相關靶基因富集通路,有望為尋找妊娠期高血壓患者早期生物學標志物及其可能發病機制提供參考。
1 材料與方法
1.1組織樣本收集 選取在武警特色醫學中心婦產科于2018年1—6月收治的健康產婦及妊娠期高血壓產婦各15例分別作為健康對照組(C組)及妊娠期高血壓組(M組)。從每組15例產婦中各選取9例產婦胎盤組織用于高通量測序檢測,余6例產婦胎盤組織用于后期高通量測序檢測lncRNA差異表達的臨床驗證。
1.2納入及排除標準
1.2.1妊娠期高血壓組:納入標準:①30~35歲且為單胎妊娠的孕產婦;②隨機尿蛋白+以上或24 h尿蛋白>0.3 g;③妊娠20周后新診斷的高血壓,即舒張壓≥90 mmHg和(或)收縮壓≥140 mmHg;④無尿蛋白情況下,新發的高血壓伴血小板減少癥、腎功能不全、肝功能損害、肺水腫、神經系統異常或視覺異常任一情況。
1.2.2對照組:納入標準:①30~35歲且為單胎妊娠的孕產婦;②孕期血壓正常。排除標準:①非自然受孕;②多胎妊娠或者胎兒發育畸形;③胎盤位置或形態異常;④羊水過多或胎膜早破;⑤產后3個月內血壓仍未恢復正常;⑥合并其他疾病。
1.3樣本處理及RNA提取 胎兒娩出5 min內,在臍帶附著點母體面同一部位取胎盤組織,去除血管及蛻膜胎膜,用無菌磷酸鹽緩沖液沖洗新鮮標本后,保存在液氮中備用。從每個胎盤組織中取0.2 cm3大小組織,加入Trizon 5 ml后加入氯仿0.3 ml,組織破碎儀(2000 r/min)破碎組織,冰盒上放置5 min。12 000 r/min離心15 min(4 ℃),把水相層移至新的RNase-Free離心管中,加入等體積70%乙醇,混勻;加入吸附柱RM中,12 000 r/min離心30 s(4 ℃),棄流出液;加入RW1洗滌沉淀,12 000 r/min離心30 s(4 ℃),棄流出液,共3次;把吸附柱裝入新離心管中,加入無RNase水(35 μl),溶解RNA,12 000 r/min離心1 min(4 ℃);流出液加入吸附柱內,12 000 r/min離心1 min(4 ℃),最終得到RNA保存于-80 ℃冰箱內。
1.4高通量測序檢測lncRNA表達水平 測序前先將每組9例樣本再次隨機分為3組,每組3例,將各組內的3個樣本等量混合后加入至離心管內,構成新的樣本M1、M2、M3與C1、C2、C3。先通過軟件進行數據評估與質控,再通過轉錄組測序對樣本mRNA的表達水平進行測定,并對lncRNA表達進行Pearson相關分析,將相關性絕對值>0.95的mRNA作為lncRNA預測靶基因;對比分析lncRNA antisense表達水平。利用RNAplex軟件通過2個長鏈RNA間相互作用來預測mRNA與反義lncRNA間的結合互補,通過所有基因(轉錄本)的小提琴圖及表達量分布圖比較各組表達水平,最后取平均值。而對于無生物學重復的樣本,先將read count數據通過TMM進行標準化處理,然后通過DEGseq進行差異分析;而對于有生物學重復的樣本,通過DESeq2分析。為了得到差異顯著的基因,將篩選條件設為:差異倍數|Fold Change|>2且Q值<0.05。篩選有差異的lncRNA后,研究其靶基因對應基因在注釋功能中的分布情況,以闡明樣本差異在基因功能上的體現。使用String在線數據庫(http://stringdb.org/)導入篩選的差異基因,得到其所編碼的蛋白質間相互作用,之后行聚類分析,找出網絡核心關鍵蛋白,分析差異lncRNA對應靶基因的相互作用。
1.5進一步驗證2組子代胎盤中lncRNA差異表達 根據Gen Bank數據庫獲得基因序列并合成引物。測定2組剩余6例子代胎盤高通量測序檢測結果顯示lncRNA差異表達最顯著的RNA純度、濃度,取1.5 μl RNA原液測定在280、260 nm處的光密度值。RNA純度=吸光度260/吸光度280,RNA濃度=吸光度260×4(ng/μl)。最后,RNA逆轉錄后行熒光定量PCR。
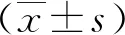
2 結果
2.1樣本測序原始序列數據統計 C1~3組分別讀取53325958、58331146、52276474條序列,M1~3組共讀取50851088、49712562、59418802條序列,其中堿基質量>20的數目比例均>98.40%,堿基質量>30的數目比例均>94.50%。見表1。

表1 樣本測序原始序列數據統計
2.2數據結果比對 各個樣本所測得序列可定位到基因組上的均有97%以上,可比對到外顯子上的整段測序序列有78%以上。見表2及表3。

表2 健康產婦測序數據結果

表3 妊娠期高血壓產婦測序數據結果
2.3lncRNA篩選 分別將測序所得lncRNA序列導入4種編碼潛能分析軟件(PLEK、Pfam、CPC2、CNCI)進行功能篩選(表4),最終均出現在上述4種軟件中具有編碼潛能的lncRNA共有884個(圖1),將其作為lncRNA數據集,主要包括131個lncRNA、257個sense_intronic lncRNA、73個antisense lncRNA、423個sense_overlapping lncRNA,見圖2。lncRNA在染色體上的分布:以1~4、6號染色體為主,性染色體中以X染色體為主。見圖3。lncRNA特征結果分析顯示:lncRNA序列中外顯子數目少于mRNA,而內含子數量則與mRNA相似,而開放閱讀框長度則更短。見圖4。

表4 長非編碼RNA篩選統計結果

圖1 長非編碼RNA編碼潛能分析預測維恩圖

圖2 長非編碼RNA分類

圖3 長非編碼RNA在染色體上的分布

圖4 長非編碼RNA特征比較
2.4lncRNA差異表達結果 2組樣本內差異表達lncRNA共有32個(19個下調、13個上調),其中6個lncRNA(ENST00000492363、ENST00000555581、ENST00000494550、ENST00000531484、ENST00000485594、ENST00000489582)差異倍數>15。見表5。差異表達lncRNA聚類分析見圖5。

圖5 差異表達長非編碼RNA聚類分析

表5 長非編碼RNA表達統計結果
2.5差異表達lncRNA對應靶基因的GO富集分析 GO富集分析顯示,主要富集的生物學過程為多細胞生物過程、細胞成分組織或生物發生、生物過程的負調節、生物調節、發展過程、代謝過程。主要富集的細胞組分為膜腔、細胞器部分、胞外區、單元格部分、胞外區部分、細胞器、細胞外基質;主要富集的分子功能為轉錄因子活性、結合、催化活性,信號傳感器活動、蛋白質結合、形態發生活性、轉運活性、結構分子活性、電子轉移活性。見圖6。

圖6 差異表達長非編碼RNA對應靶基因GO富集分析
2.6差異表達lncRNA對應靶基因的KEGG通路富集分析 富集基因數>40個的通路共有41條,包括12條代謝相關通路、10條有機體系統相關通路、8條人類疾病相關通路、4條細胞過程相關通路、4條遺傳信息通路、3條環境信息相關通路。見圖7。

圖7 差異表達長非編碼RNA對應靶基因KEGG通路富集分析
2.7差異表達lncRNA對應靶基因的相互作用分析 處于網絡中核心位置的差異表達lncRNA對應靶基因主要包括 PSMB10、RELA、CASP10、RPS27A、EIF4G1、GNB2L1、PSMF1、DDX6等基因。見圖8。

圖8 差異表達長非編碼RNA對應靶基因編碼蛋白相互作用網絡圖
2.82組子代胎盤組織ENST00000492363表達水平 根據數據庫Gen Bank獲得基因序列(表6)。2組子代胎盤組織ENST00000492363表達水平比較顯示,妊娠期高血壓產婦子代胎盤組織中ENST00000492363表達水平為(1.45±0.12)顯著高于正常妊娠孕婦胎盤組織的(1.04±0.09),差異有統計學意義(P<0.05)。

表6 妊娠期高血壓產婦和正常妊娠產婦基因序列
3 討論
妊娠期高血壓可長期影響后代及母親的健康。妊娠期高血壓的主要特點是滋養層細胞侵及子宮,引發胎盤灌注不足,但其有效治療靶點目前仍不清楚。近年來基因組測序技術快速發展,研究顯示人類基因組內僅有1%~2%的基因可翻譯為蛋白質,但大量其他不能翻譯為蛋白質的基因在不同的生物學過程中也發揮著重要作用,如lncRNA[7]。
lncRNA作用機制非常復雜,雖然其在眾多疾病生物學過程中發揮重要作用,但是至今仍有諸多問題尚未闡明[8]。研究顯示,lncRNA主要通過以下途徑發揮作用:①作為小分子RNA的前體,修飾成小分子RNA(如miRNA、piRNA)而發揮作用;②在編碼基因上游的啟動子區轉錄,從而干擾基因的表達;③與編碼基因轉錄本形成互補的雙鏈,以干擾mRNA剪切;④結合特定的蛋白質,從而調節其靶蛋白的活性,或改變蛋白質的定位;⑤抑制組蛋白修飾、RNA聚合酶Ⅱ或介導染色質重構,影響下游基因的轉錄、表達;⑥組成核酸蛋白質復合體,從而參與生物學過程[9]。
本研究結果顯示,M組胎盤組織中共有32種lncRNA與C組存在差異表達,表明妊娠期高血壓的發生、發展與lncRNA具有相關性。有研究顯示,與正常孕婦胎盤組織相比,子癇前期孕婦胎盤組織中LncRNA-HEIPP、lncRNA-TCL6的表達均顯著升高,而lncRNA-HEIPP下調促進了滋養層細胞的侵襲,其中低水平lncRNA-TCL6表達的子癇前期孕婦收縮壓和舒張壓、尿蛋白水平均明顯低于高lncRNA-TCL6表達的孕婦,且TCL6下調可促進滋養層細胞增殖,表明lncRNA-TCL6過表達可通過抑制滋養層細胞增殖,促進高血壓的發生[10]。
本研究GO富集分析及KEGG通路富集分析結果表明,妊娠期高血壓的發生與胎盤的代謝改變具有相關性。有研究也表明,能量供應不足可引起淺螺旋動脈重構及著床異常,從而會引起胎盤及胎兒代謝組學的變化,因此代謝異常可能是妊娠期高血壓的發病因素之一。妊娠過程中,葡萄糖是一種能量底物,也可調節胚胎著床及胎盤發育[11]。此外,游離脂肪酸代謝也為胎盤及胎兒發育提供了能量[12]。
蛋白相互作用網絡分析結果顯示,基因CASP10、DDX6、PSMB10、EIF4G1、PSMF1、RELA、RPS27A、GNB2L1等處于網絡核心位置,表明在妊娠期高血壓發生發展過程中上述基因發揮著重要作用。RPS27A位于細胞質中,屬于核糖體蛋白S27AE家族成員,含C4型鋅指結構域[13]。RELA則屬于NF-κB亞基,而NF-κB由RELA、NFKB1、NFKB2、NFKB1、Rel組成,NF-κB內的RELA-REL、RELA-NFKB1可作為轉錄激活因子而發揮作用,如參與DNA結合、調節基因表達[14];而NF-κB中RELA-RELA復合物則可通過侵襲素介導而參與IL-8表達活化[15]。PSMF1在調控蛋白酶體功能中具有重要作用,可抑制20S蛋白酶體水解肽底物及蛋白質,也可抑制調節蛋白PA28、PA700激活蛋白酶體[16]。PSMF1通過11S和19S調節器抑制蛋白酶體的激活,也可通過與免疫蛋白酶體中的催化亞基2競爭發揮作用[17]。GNB2L1參與多種信號分子的調節[18],可參與組成40S核糖體亞單位,當核糖體在翻譯中停滯后,可通過活化穩定蛋白激酶C,促進PKC磷酸化,從而延長G0/G1期,最終抑制細胞生長[19]。CASP10為半胱氨酸天冬氨酸蛋白酶家族成員[20],可參與細胞壞死、凋亡及炎癥信號的傳導[21]。EIF4G1基因編碼蛋白組成蛋白復合體EIF4F,可促進mRNA向核糖體的募集。DDX6屬于DEAD盒蛋白家族成員,具有mRNA降解及翻譯抑制功能,還可通過抑制ATG基因表達,從而阻斷自噬[22-23]。
總之,與健康產婦胎盤組織比較,妊娠期高血壓產婦胎盤組織中有ENST00000492363、ENST00000494550、ENST00000555581、ENST00000531484、ENST00000489582和ENST00000485594等32種lncRNA表達存在差異,其中ENST00000492363表達上調且差異倍數最大,臨床樣本定量分析也進一步證實ENST00000492363表達存在差異性。另外,lncRNA靶基因富集于與物質代謝具有相關性的通路,且PSMF1、DDX6、RPS27A、PSMB10、CASP10、GNB2L1、RELA、EIF4G1等基因處于網絡調控中心,表明物質代謝及上述基因可能與妊娠期高血壓發生發展具有相關性,為妊娠期高血壓的發病機制研究提供了新的方向。

