某院598例藥品不良反應報告統計分析
江瑩 陳璋璋 許青 呂遷洲 李曉宇
摘 要 目的:分析某三級甲等醫院上報的藥品不良反應(adverse drug reactions, ADR)的發生特點,以提高臨床安全用藥水平。方法:收集該院2021年上報至國家藥品不良反應監測中心的ADR報告,對患者性別、年齡、原患疾病、懷疑藥品、給藥時間、給藥頻次等相關因素進行回顧性分析。結果:該院2021年上報的ADR總例數為598例,其中25.42%的ADR報告與抗腫瘤藥物有關,其次為抗感染藥物(24.25%);≥65歲年齡段患者的ADR報告率最高(45.32%)。ADR報告中以消化系統損害最為多見(30.11%);給藥途徑中以經靜脈用藥的ADR報告率最高(48.16%)。結論:在日常ADR監測中,應重點監測使用抗腫瘤藥物、年齡≥65歲、經靜脈給藥和聯用多種藥物的患者。消化系統、皮膚及皮膚附件損害是常見的ADR信號。臨床醫生應不斷提高安全用藥的意識和認識,從而使患者獲得更好的健康效益。
關鍵詞 藥品不良反應 合理用藥 監測
中圖分類號:R969.3 文獻標志碼:C 文章編號:1006-1533(2022)05-0024-04
引用本文 江瑩, 陳璋璋, 許青, 等. 某院598例藥品不良反應報告統計分析[J]. 上海醫藥, 2022, 43(5): 24-27; 57.
基金項目:國家自然科學基金青年基金項目(82003995)
Retrospective analysis of 598 cases of adverse drug reactions in a hospital
JIANG Ying, CHEN Zhangzhang, XU Qing, LYU Qianzhou, LI Xiaoyu
(Department of Pharamcy, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: The characteristics of adverse drug reactions (ADR) were determined, to provide information for rational use of drugs in clinic. Methods: ADR reports from the National Center For ADR during 2021 were retrospectively analyzed in terms of gender, age, disease, suspicious drugs, delivery time, delivery frequency. Results: A total of 598 ADR cases were reported, in which 25.42% were related to anti-tumor drugs, followed by anti-infective drugs (24.25%). The incidence of ADR was the highest in the age group ≥65 years old (45.32%), the system/organs injury mainly occurred in the digestive system(30.11%) and the incidence of ADR caused by intravenous infusion in the drug delivery route accounted for 48.16%. Conclusion: In daily monitoring of ADR, patients who are using anti-tumor drug, older than 65 years old, adopting intravenous infusion route and administrating multiple drugs should be monitored. Digestive system injury and skin and accessory injury are common ADR signals, and great attention should be paid to safe use of drugs so as to achieve better health benefit for patients.
KEy WORDS adverse drug reactions; rational drug use; monitoring
醫院所見藥品不良反應(adverse drug reactions, ADR)多發生在病情發展或聯用多種藥物的患者中,上報至國家藥品不良反應監測中心的ADR大部分發生于住院患者。為了解ADR的發生規律和特點,本研究回顧性分析某三級甲等醫院2021年上報至國家藥品不良反應監測中心的598例ADR報告的情況,以期提高臨床醫生安全用藥的意識和認知。
1.1 資料來源
收集某三級甲等醫院2021年上報至國家藥品不良反應監測中心的598例ADR報告,提取相關信息,進行回顧性分析。
1.2 統計方法
按照《藥品不良反應報告和監測管理辦法》(衛生部令第81號)[1]所定標準對ADR進行其與藥品的關聯性評價和嚴重程度評估 ,同時參照《WHO藥品不良反應術語集》[2]對ADR累及器官/系統情況及其主要臨床表現進行統計。采用Excel 2013軟件對患者年齡、性別、懷疑藥品、合并用藥、給藥途徑、用藥起止時間、ADR過程描述、轉歸等信息進行描述性統計,計數資料以構成比表示。
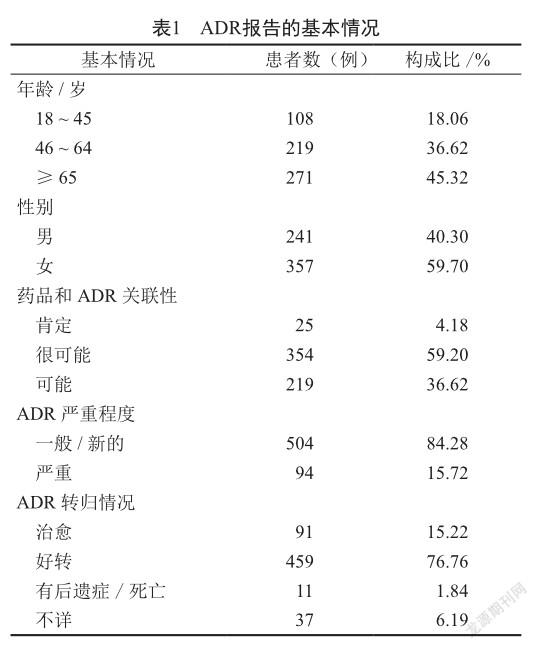
2.1 ADR報告的基本情況
在598例ADR報告中,女性患者為357例(59.70%),男性患者為241例(40.30%),女性患者占比高于男性患者。從患者年齡段看,≥65歲的最多(271例),其次為46 ~ 64歲患者(219例)。ADR嚴重程度,嚴重的為94例(15.72%),一般或新的為504例(84.28%)。藥品和ADR關聯性評價,肯定的為25例,很可能的為354例。598例ADR患者中,550例經停用藥物等對癥處理后治愈或好轉,11例經治療后有后遺癥或死亡,37例轉歸情況不詳(表1)。
2.2 ADR報告涉及的藥品種類分布情況
598例ADR報告涉及的藥品種類包括抗腫瘤藥物、抗感染藥物、免疫調節劑、解熱鎮痛藥物、抗病毒藥物、腸外/腸內營養制劑、專科藥物等,其中排名前三的藥品種類依次為抗腫瘤藥物(152例,25.42%)、抗感染藥物(145例,24.25%)和心血管系統藥物(64例,10.70%。表2)。此外,375例(62.71%)ADR患者在聯用≥3種藥品。

2.3 ADR報告涉及的給藥途徑
598例ADR報告共涉及6種給藥途徑,其中經靜脈用藥的ADR報告數最高(288例,48.16%),以下依次為口服用藥(276例,46.15%)、皮下注射(24例,4.01%)、肌內注射(5例,0.84%)、吸入用藥(3例,0.50%)和局部用藥(2例,0.33%)。
2.4 ADR累及器官/系統及其主要臨床表現
參照《WHO藥品不良反應術語集》對ADR累及系統/器官進行統計,發現598例ADR共累及11類器官/系統,其中以消化系統損害最為多見(199例次,30.11%),臨床上主要表現為惡心/嘔吐、消化道出血、肝功能損害等,其次為皮膚及皮膚附件損害(156例次,23.60%。表3)。

2.5 抗腫瘤藥物嚴重ADR涉及的藥品種類和主要臨床表現
在94例嚴重ADR報告中,涉及抗腫瘤藥物的報告數最多(47例),其中聯合用藥的39例,單獨用藥的8例,共涉及抗腫瘤藥物品種15個,其中口服劑型3個(表4)。在47例抗腫瘤藥物嚴重ADR報告中,涉及程序性細胞死亡受體-1(programmed cell death receptor-1, PD-1)/程序性細胞死亡受體配體-1(programmed cell death receptor ligand-1, PD-L1)抑制劑的報告數為29例,其中包括3級腸炎5例、3級心肌炎7例、3級肝炎4例、4級肝炎1例。這29例患者經糖皮質激素沖擊治療和對癥治療后有15例患者的ADR情況緩解,1例患者因肝衰竭導致全身多器官功能衰竭而死亡。此外,涉及絡鉑類藥物的嚴重ADR報告數為10例,涉及酪氨酸激酶抑制劑的嚴重ADR報告數為4例。

3.1 患者年齡、性別對ADR發生率的影響
本研究發現,女性患者的ADR發生率高于男性患者(分別為59.70%和40.30%),這可能與男、女性解剖和生理上的差異有關,如體質量、身體組成、胃腸道動力、肝和腎功能都會影響藥物的代謝。與男性相比,女性體質量低、器官小、體脂多,體液總量、胃腸道動力和腎小球濾過率也都較低,這些差異對藥物的吸收、分布、代謝和消除都有一定的影響。患者年齡對ADR的發生也有顯著影響,尤其是兒童和老年患者,這些患者在藥物臨床試驗中通常未被廣泛納入研究。本研究發現,≥65歲年齡段患者的ADR發生率最高,其次是46 ~ 64歲年齡段患者,這與相關研究結果一致[3]。老年患者易發生ADR的主要原因包括:一方面,他們的器官代償能力和生理功能都已有所減退,藥物代謝和排泄速率減緩,使得藥物易在體內蓄積;另一方面,他們合并的基礎疾病較多,通常多藥聯用,藥物相互作用風險較高。因此,在臨床實踐中,除須綜合評估患者的病情外,還需考慮到患者的年齡、合并疾病、聯用的藥物等因素,為其制定個體化的治療方案。
3.2 藥品給藥途徑對ADR發生率的影響
ADR最易發生于經靜脈給藥的患者中。經靜脈給藥起效快、劑量可控,是臨床上常用的給藥途徑,但因藥物避開了肝臟首過效應而直接進入血液系統,對機體的刺激也隨之增強,容易發生ADR。所以,臨床用藥應遵循“能口服的不采用肌內注射,能肌內注射的不采用經靜脈給藥”的原則,合理選擇給藥途徑。
3.3 藥品種類對ADR發生率的影響
多藥聯用在臨床上非常普遍,是導致ADR高發的重要原因之一。研究表明,使用1種或2種藥物的ADR發生率很低,而隨著使用的藥物品種數增加,ADR發生率也隨之增加。在本研究中,375例ADR患者(62.71%)使用了≥3種藥品,說明多藥聯用確會增加ADR的發生率。此外,可能與醫院患者的構成有關,在本研究中,抗腫瘤藥物的ADR報告率最高,涉及到的抗腫瘤藥物包括微管蛋白活性抑制藥、絡鉑類藥物、單克隆抗體和靶向抗腫瘤藥物等,ADR表現以血液系統、消化系統損害為主,與抗腫瘤藥物無法精準識別腫瘤細胞,常會不同程度地損傷正常組織/器官有關。抗腫瘤藥物常多藥聯用,這也增加了ADR的發生率。
抗菌藥物的ADR報告率位列第二,其中排名前三的抗菌藥物分別為左氧氟沙星注射液、頭孢吡肟注射液和利奈唑胺注射液。左氧氟沙星為第三代喹諾酮類抗菌藥物,其抗菌譜廣、半衰期長、價格低廉,臨床應用廣泛,常見ADR有神經毒性和肌骨骼損傷等。本研究發現,左氧氟沙星注射液的主要ADR為消化系統和神經系統損害,提示應加強抗菌藥物的合理用藥意識,嚴格按照藥品說明書上的適應證和用法用量規范用藥,同時密切關注藥品輸注過程中患者的臨床表現,對ADR做到早發現、早預防。頭孢菌素類抗生素具有抗菌譜廣、適應人群廣的特點,是目前臨床抗感染治療的首選藥物,但其過敏反應發生率較高,臨床使用時應嚴格遵循有關診療規范。本研究還發現,利奈唑胺所致ADR累及血液系統的比例最高,患者臨床表現有血小板減少、白細胞減少等,且主要發生于用藥后的14 d內,提示在利奈唑胺用藥初期應監測相關指標。
3.4 ADR累及的系統/器官及主要臨床表現
本研究中,ADR累及的系統/器官以消化系統和皮膚及皮膚附件損害為主,主要臨床表現為惡心/嘔吐、腹痛、腹脹、紅腫、皮疹、瘙癢等。由于這些癥狀容易捕捉,臨床上較易作出判斷,故上報率較高。對于無癥狀或需通過實驗室檢查發現的ADR,建議加強用藥過程中的藥學監護,做到早發現、早處理。
3.5 抗腫瘤藥物嚴重ADR累及的系統/器官及應對策略
在本研究中,抗腫瘤藥物的ADR報告率最高,嚴重ADR例數也最多,涉及到的抗腫瘤藥物主要是靶向抗腫瘤藥物PD-1/PD-L1抑制劑,其次為絡鉑類藥物。有研究顯示,PD-1/PD-L1抑制劑單藥治療的肝臟ADR發生率約為5%,嚴重心肌炎發生率約為0.09%,3 ~ 4級肝損傷發生率約為1% ~ 2%,ADR發生時間多為首次用藥后的8 ~ 12周內[4]。根據美國腫瘤免疫治療學會發布的免疫檢查點抑制劑相關不良事件管理指南[5],對于大部分1 ~ 2級ADR,先暫停用藥物治療,待實驗室檢查指標好轉后再恢復用藥;對于≥3級ADR,酌情永久停用該藥物治療。
絡鉑類藥物的嚴重ADR主要表現為消化系統、血液系統和神經系統損害。有研究顯示,第一代絡鉑類藥物順鉑的胃腸道和腎毒性明顯,第二代絡鉑類藥物卡鉑的骨髓抑制毒性較強,而第三代絡鉑類藥物奧沙利鉑治療的神經系統毒性發生率較高[6]。因此,在使用絡鉑類藥物治療時,應采取相應的ADR防治措施,如對于重度惡心/嘔吐等消化系統毒性,常聯合使用5-羥色胺受體拮抗劑和地塞米松進行防治;對于腎毒性,一般通過增加水分攝入或輸液量,促進藥物排泄來予以控制;對于血液毒性,可選用粒細胞集落刺激因子或粒細胞巨噬細胞集落刺激因子來糾正白細胞和血小板計數;對于神經系統毒性,可給予維生素B1和維生素C等,以改善中毒癥狀。
在臨床實踐中,收集、上報、分析和評價ADR信息不但能夠幫助醫護人員盡早發現藥物警戒信號,而且也是保障用藥安全的重要措施。特別是對于聯合化療、經靜脈途徑給藥和≥65歲的患者,用藥過程中更須密切監測相應的實驗室檢查指標,觀察是否出現了可疑的ADR信號,并制定ADR應急處理規程;對于可能造成嚴重損害的ADR,應建立有效的預警機制,最大程度地提高藥品使用的安全性。
參考文獻
[1] 中華人民共和國衛生部. 《藥品不良反應報告和監測管理辦法》(衛生部令第81號)[EB/OL]. (2011-05-04) [2022-01-13]. https://www.nmpa.gov.cn/xxgk/fgwj/ bmgzh/20110504162501325.html.
[2] WHO藥品不良反應術語集[J]. 中國藥物警戒, 2007, 4(4): 250-256.
[3] Machado-Alba JE, Londo?o-Builes MJ, Echeverri-Cata?o LF, et al. Adverse drug reactions in Colombian patients, 2007-2013: analysis of population databases [J]. Biomedica, 2016, 36(1): 59-66.
[4] Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies [J]. Ann Oncol, 2015, 26(12): 2375-2391.
[5] Brahmer JR, Abu-Sbeih H, Ascierto PA, et al. Society for Immunotherapy of Cancer (SITC) clinical practice guideline on immune checkpoint inhibitor-related adverse events [J]. J Immunother Cancer, 2021, 9(6): e002435.
[6] 金星, 吳文清, 伍延婷. 127例鉑類抗癌藥物不良反應報告回顧性分析[J]. 安徽醫藥, 2017, 21(5): 957-959.

