妊娠中晚期孕婦血清Gremlin1水平變化及其對(duì)妊娠期糖尿病的影響
齊 琪,江黎晨,孫 蓉,胡紅琳,章 秋
(安徽醫(yī)科大學(xué)第一附屬醫(yī)院 內(nèi)分泌代謝病科,安徽 合肥 230022)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期首次發(fā)生或發(fā)現(xiàn)的糖代謝異常,患病率在全球范圍內(nèi)呈上升趨勢(shì),中國作為世界上人口最大、發(fā)展最快的國家,隨著人民生活水平和醫(yī)療水平的提高,近年來GDM的患病率急劇上升。一項(xiàng)于2010-2012年在天津市開展的針對(duì)18 589例婦女的流行病學(xué)調(diào)查發(fā)現(xiàn),GDM的患病率為9.3%[1]。孕婦糖代謝紊亂對(duì)母嬰健康均產(chǎn)生嚴(yán)重危害,然而GDM的發(fā)病機(jī)制至今尚不明確。有研究認(rèn)為,GDM的發(fā)病機(jī)制類似于2型糖尿病,即多種原因?qū)е侣砸葝u素抵抗背景下的β細(xì)胞功能障礙[2]。Gremlin1是骨形態(tài)形成蛋白(bone morphogenetic protein, BMP)拮抗劑家族的新成員, 直接中和BMP配體和抑制BMP信號(hào),在脊椎動(dòng)物肢體的胚胎發(fā)育和腎臟、肺的形態(tài)形成過程中起重要的作用[3]。既往研究多關(guān)注Gremlin1在腎、肺、肝和骨關(guān)節(jié)等疾病中的作用,而近期關(guān)于2型糖尿病、多囊卵巢綜合征等疾病的研究表明,Gremlin1與胰島素抵抗相關(guān),可能通過降低胰島素的敏感性參與糖代謝[4-5]。本研究旨在了解GDM患者血清Gremlin1水平變化,探究Gremlin1對(duì)GDM的影響。
1 資料與方法
1.1病例選擇 選取2020年9-11月就診于安徽醫(yī)科大學(xué)第一附屬醫(yī)院行孕期體檢的妊娠24~28周并完善口服葡萄糖耐量試驗(yàn)(oral glucose tolerance test, OGTT)的妊娠期女性175例, 根據(jù)OGTT結(jié)果分為GDM組(n=87)和糖代謝正常(NGT)組(n=88)。GDM依據(jù)國際糖尿病和妊娠小組2010年診斷標(biāo)準(zhǔn)[6]:空腹血糖(fasting blood glouse,F(xiàn)BG)≥5.1 mmol/L和(或)1 h血糖(1 h blood glouse,1 hBG)≥10.0 mmol/L和(或)2 h血糖(2 h blood glouse, 2 hBG)≥8.5 mmol/L。納入標(biāo)準(zhǔn):①妊娠24~28周,無不良孕史;②單胎、自然受孕;③無糖尿病病史及糖尿病家族史。排除標(biāo)準(zhǔn):①輔助生殖受孕;②不良孕史;③存在嚴(yán)重臟器畸形或功能異常;④長期服用藥物治療。所有研究對(duì)象均簽署知情同意書。
1.2方法
1.2.1一般資料 由同一試驗(yàn)人員收集所有研究對(duì)象的年齡、孕周、身高、妊娠前體重、妊娠后體重,計(jì)算妊娠前體質(zhì)量指數(shù)(body mass index,BMI)、妊娠后BMI、妊娠期增加體重。
1.2.2生化指標(biāo) 所有研究對(duì)象均于OGTT檢查前一晚禁食8 h以上,次日清晨空腹時(shí)抽取前臂靜脈血3 ml,采血后5 min內(nèi)口服50%葡萄糖溶液150 ml,以口服第一口葡萄糖溶液開始計(jì)時(shí),在口服葡萄糖溶液后第1、2 h再次分別抽取前臂靜脈血3 ml;靜脈血標(biāo)本采集后以3 200 r/min、離心半徑18 cm離心6 min后分離血清。另取1 ml空腹血清保存于-80 ℃冰箱,待后期檢測(cè)Gremlin1水平。采用德國EKF葡萄糖/乳酸分析儀氧化電極法測(cè)定空腹血糖(fasting blood glouse,F(xiàn)BG),1 h血糖(1 h blood glouse,1 hBG),2 h血糖(2 h blood glouse, 2 hBG),采用西門子centaur xp化學(xué)發(fā)光儀化學(xué)發(fā)光法測(cè)定空腹胰島素(fasting insulin,F(xiàn)INS),1 h胰島素(1 h insulin, 1 hINS),2 h胰島素(2 h insulin, 2 hINS),空腹C肽(fasting C protein,F(xiàn)CP),1 h C肽(1 h C protein,1 hCP), 2 hC肽(2 h C protein, 2 hCP)。根據(jù)以上檢測(cè)數(shù)據(jù)計(jì)算胰島素抵抗指數(shù) (homeostatic model assessment insulin resistance, HOMA-IR),HOMA-IR=(FBG×FINS)/22.5;胰島β細(xì)胞功能指數(shù)(homeostatic model assessment βcell insulin secretion index, HOMA-β),HOMA-β=20×FINS/(FPG-3.5),胰島素敏感指數(shù)(insulin sensitivity index,ISI)=1/(FBG×FINS);血糖曲線下面積(AUC-G)=(FBG/2+1 hBG+2 hBG/2);胰島素曲線下面積(AUC-I)=(FINS/2+1 hINS+2 hINS/2)。采用酶聯(lián)免疫吸附法測(cè)定空腹血清Gremlin1水平。
2 結(jié) 果
2.1一般資料比較 GDM組妊娠前體重、妊娠后體重、孕前BMI、孕后BMI高于NGT組,差異有統(tǒng)計(jì)學(xué)意義(均P<0.05),GDM組與NGT組年齡、孕周、身高、妊娠期增加體重比較,差異無統(tǒng)計(jì)學(xué)意義(均P>0.05),見表1。
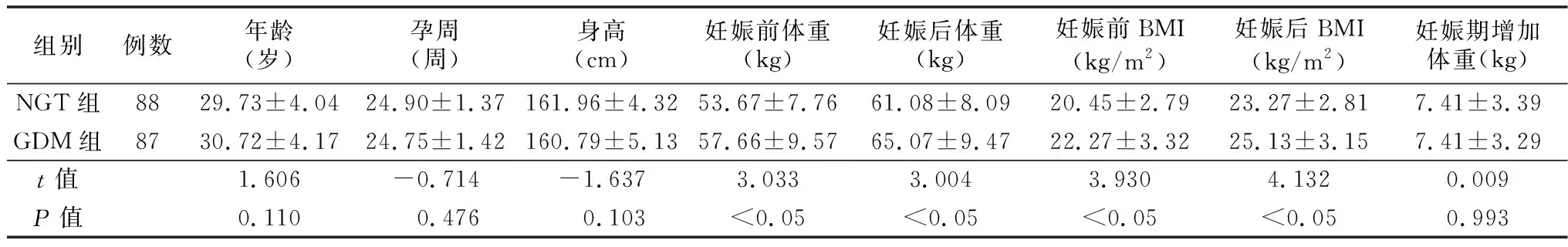
表1 兩組一般資料比較
2.2生化指標(biāo)比較 GDM組FBG、FINS、FCP、1 hBG、1 hINS、1 hCP、2 hBG、2 hINS、2 hCP、HOMA-IR、AUC-G、AUC-I高于NGT組,差異有統(tǒng)計(jì)學(xué)意義(均P<0.05)。GDM組血清Gremlin1水平高于NGT組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05),HOMA-β、ISI低于NGT組,差異有統(tǒng)計(jì)學(xué)意義(均P<0.05),見表2。
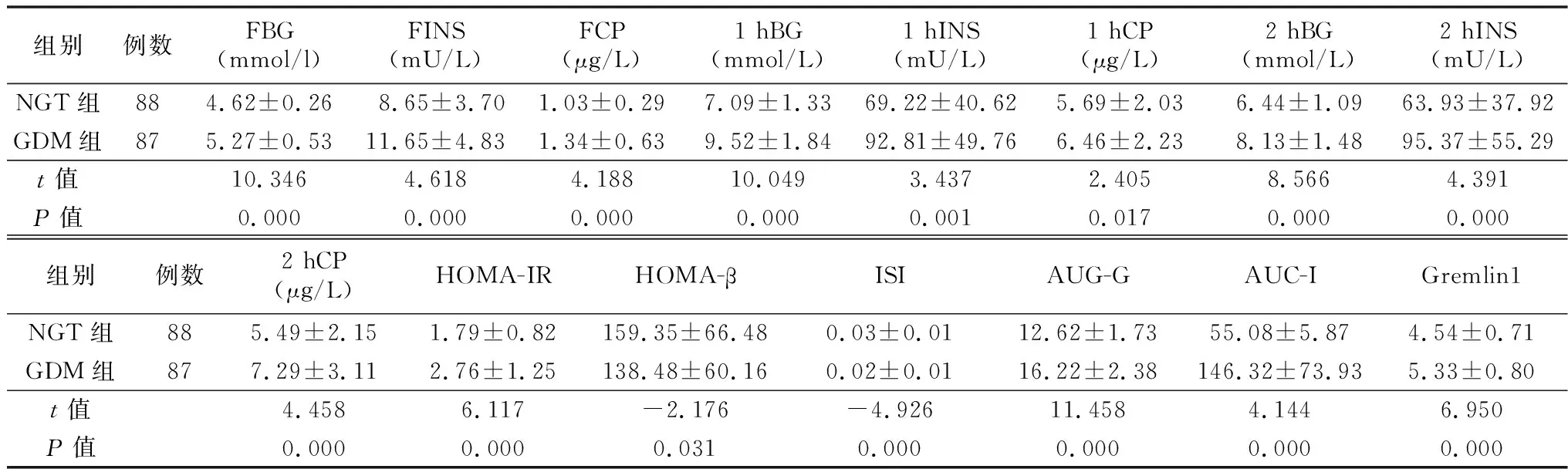
表2 兩組生化指標(biāo)比較
2.3Gremlin1與各指標(biāo)相關(guān)性 血清Gremlin1與妊娠后BMI、FBG、1 hBG、1 hINS、2 hBG、2 hINS、2 hCP、HOMA-IR、AUG-G、AUC-I呈正相關(guān)(均P<0.05),與ISI、HOMA-β呈負(fù)相關(guān)(均P<0.05),見表3。
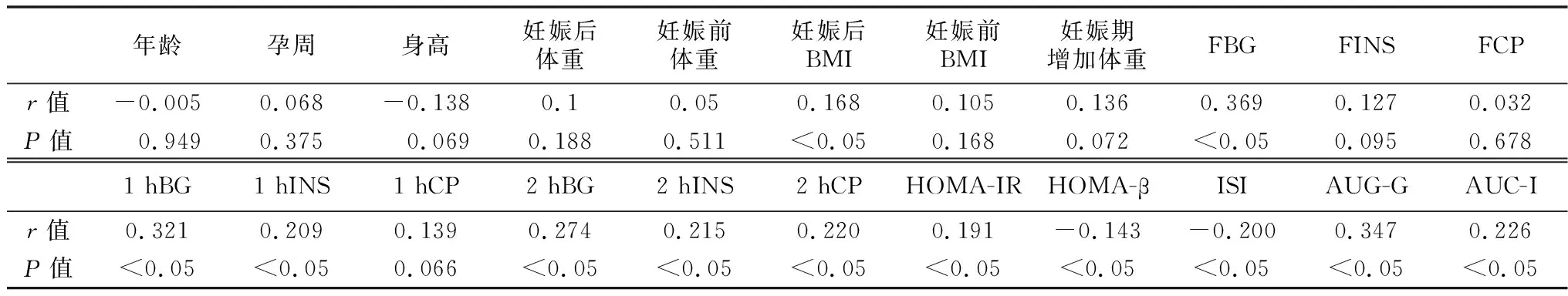
表3 Gremlin1與各指標(biāo)相關(guān)性
2.4Logistic回歸分析 將血清Gremlin1水平設(shè)為自變量,GDM設(shè)為因變量,進(jìn)行單因素Logistic回歸分析,結(jié)果發(fā)現(xiàn),血清Gremlin1是GDM的危險(xiǎn)因素,見表4。將Gremlin1及兩組其他差異有統(tǒng)計(jì)學(xué)意義的因素納入多因素Logistic回歸分析,結(jié)果發(fā)現(xiàn),血清Gremlin1為GDM的獨(dú)立危險(xiǎn)因素,見表5。
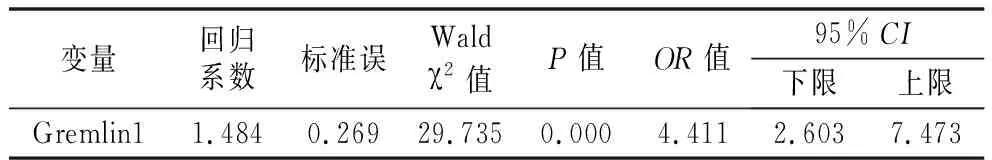
表4 單因素Logistic回歸分析

表5 多因素Logistic回歸分析
3 討 論
隨著我國生育政策及人群生活方式的改變,GDM的患病率逐年上升,近期的一項(xiàng)薈萃分析顯示,中國大陸GDM的患病率為14.8%(95%CI12.8~16.7%)[7]。一項(xiàng)多中心跨國研究表明,GDM是先兆子癇、早產(chǎn)、剖腹產(chǎn)、小于胎齡兒、肩部難產(chǎn)、新生兒低血鈣、高膽紅素血癥和進(jìn)入新生兒特別護(hù)理病房等不良事件的獨(dú)立危險(xiǎn)因素[8]。并且,GDM患者的后代在出生后患有肥胖癥、糖尿病等疾病的風(fēng)險(xiǎn)顯著增加[9]。多代間的惡性循環(huán),增加了糖尿病等慢性疾病的患病率,為全世界帶來巨大的醫(yī)療負(fù)擔(dān)。因此,GDM的早期發(fā)現(xiàn)及治療十分重要。
在妊娠期間,脂肪組織不僅作為儲(chǔ)存能量的器官,同時(shí)也作為一種內(nèi)分泌器官參與胰島素抵抗甚至GDM的發(fā)病。白色脂肪組織根據(jù)能量的供應(yīng)和需求情況儲(chǔ)存和釋放脂質(zhì)及脂肪酸。白色脂肪細(xì)胞儲(chǔ)存能量的過程受到嚴(yán)密的調(diào)控,其中BMP所誘導(dǎo)的信號(hào)通路起到重要作用,當(dāng)BMP4與受體的結(jié)合受到其拮抗劑的抑制時(shí),脂肪細(xì)胞會(huì)以不合理的體積增大為代償來儲(chǔ)存能量,當(dāng)脂肪細(xì)胞的肥大不能滿足儲(chǔ)存能量的需求時(shí),脂質(zhì)就會(huì)儲(chǔ)存在肝臟和內(nèi)臟脂肪組織中[10]。肥大的脂肪細(xì)胞分泌的脂肪因子出現(xiàn)紊亂,進(jìn)而導(dǎo)致胰島素抵抗。同樣,當(dāng)出現(xiàn)胰島素抵抗時(shí),胰島素對(duì)脂肪組織分解的抑制作用減弱,導(dǎo)致血液循環(huán)內(nèi)脂肪酸和甘油含量升高,抑制骨骼肌細(xì)胞對(duì)葡萄糖的攝取。由于解剖關(guān)系,內(nèi)臟脂肪分解產(chǎn)生的脂肪酸及甘油由門靜脈輸送至肝臟,導(dǎo)致肝臟糖異生增加,也加重了肝臟的胰島素抵抗[11]。因此,妊娠前超重或肥胖是GDM的危險(xiǎn)因素,可增加GDM的發(fā)病率[12],妊娠前BMI常用于GDM的危險(xiǎn)因素篩查,本研究中GDM組妊娠前BMI高于NGT 組也證實(shí)了以上結(jié)論。妊娠期是脂肪組織增加的高峰期,有研究表示,妊娠期體重過度增加同樣是GDM的危險(xiǎn)因素[13]。本研究中,GDM組妊娠前及妊娠后BMI均高于NGT組,提示GDM與體重增加及肥胖相關(guān),與上述研究結(jié)果基本一致。
1998年,Hsu等[3]研究發(fā)現(xiàn),Gremlin1是BMP的受體拮抗劑。Gremlin1除了在細(xì)胞外發(fā)揮抑制作用,還可以與細(xì)胞內(nèi)的BMP4前體蛋白特異性結(jié)合,從而阻止成熟BMP4蛋白的產(chǎn)生和分泌[14]。Gremlin1除通過以上途徑來阻斷BMP分泌和增加細(xì)胞外BMP內(nèi)吞作用外,還參與多種生理、病理過程。有研究發(fā)現(xiàn),Gremlin1直接參與胰島素抵抗,在體外實(shí)驗(yàn)中Gremlin1可以抑制骨骼肌細(xì)胞、脂肪細(xì)胞和肝臟細(xì)胞由胰島素所誘導(dǎo)的葡萄糖攝取,相反的是,在細(xì)胞培養(yǎng)基中加入抗Gremlin1抗體則會(huì)增強(qiáng)由胰島素介導(dǎo)的葡萄糖攝取[4]。本研究發(fā)現(xiàn)Gremlin1水平與HOMA-IR呈正相關(guān),支持Gremlin1導(dǎo)致胰島素抵抗的結(jié)論,但是其具體機(jī)制尚不明確。
Gremlin1作為BMP拮抗劑在胰島素抵抗中起重要作用,BMP4及其抑制劑調(diào)控間充質(zhì)干細(xì)胞成為定向的前脂肪細(xì)胞,再分化成為功能成熟的脂肪細(xì)胞。而這種控制是通過BMP4與其受體結(jié)合,激活細(xì)胞內(nèi)的Smad1/5/8,使胞漿內(nèi)的WISP2/ZNF423復(fù)合物解離,ZNF423進(jìn)入細(xì)胞核中,使PPARγ的轉(zhuǎn)錄上調(diào),促使間充質(zhì)干細(xì)胞轉(zhuǎn)化為定向的前脂肪細(xì)胞,也使得前脂肪細(xì)胞向棕色脂肪細(xì)胞分化[15]。白色脂肪細(xì)胞主要儲(chǔ)存脂質(zhì),并分泌多種脂肪因子來調(diào)節(jié)胰島素敏感性;而棕色脂肪細(xì)胞則是通過豐富的線粒體及解偶聯(lián)蛋白1來分解脂質(zhì)產(chǎn)生熱量,并且分泌脂肪因子來增加胰島素敏感性。由前脂肪細(xì)胞分化而來的白色脂肪細(xì)胞中ZNF423通過與早期的細(xì)胞因子Ebf2結(jié)合形成復(fù)合體,抑制白色脂肪細(xì)胞向米色/棕色表型的轉(zhuǎn)化來保持白色脂肪細(xì)胞的表型。然而Ebf2/ZNF423復(fù)合體可以被BMP4及BMP7解離,使已分化的白色脂肪細(xì)胞呈現(xiàn)米色/棕色表型,從而增加胰島素敏感性[16]。此外,BMP4在成熟脂肪細(xì)胞中高表達(dá),并由成熟脂肪細(xì)胞分泌,可能通過正反饋?zhàn)饔脕碚心夹碌那绑w細(xì)胞進(jìn)入成脂細(xì)胞譜系,以防止脂肪細(xì)胞通過肥大來儲(chǔ)存脂質(zhì)[17]。肥厚性肥胖患者的皮下脂肪細(xì)胞中BMP4的mRNA、蛋白分泌增加,表明前體細(xì)胞對(duì)BMP4具有抵抗力,也就是處于BMP4抵抗?fàn)顟B(tài),這種狀態(tài)與BMP4抑制劑相關(guān)[17]。Gremlin1通過與BMP4二聚體結(jié)合抑制以上信號(hào)通路,使脂肪細(xì)胞增殖減少并產(chǎn)生肥大、白色脂肪細(xì)胞的數(shù)量增加,從而導(dǎo)致胰島素抵抗。本研究發(fā)現(xiàn),與NGT組比較,GDM組胰島素抵抗明顯,Gremlin1水平顯著升高,對(duì)所有入組患者進(jìn)行相關(guān)性分析發(fā)現(xiàn)Gremlin1水平與HOMA-IR呈正相關(guān),與ISI呈負(fù)相關(guān)。Gremlin1為GDM的獨(dú)立危險(xiǎn)因素,提示Gremlin1可能通過胰島素抵抗參與調(diào)節(jié)GDM的糖代謝過程。同時(shí),糖脂代謝為慢性代謝性疾病,為明確Gremlin1在GDM中的作用機(jī)制,需更多大樣本量、長周期、多中心臨床研究加以證實(shí)。
綜上,GDM患者血清Gremlin1升高,并與胰島素抵抗呈正相關(guān),參與GDM的糖代謝。

