草海桐銅鋅超氧化物歧化酶基因的克隆及序列分析
張靜文,張力文,嚴云香,常 義,陳 艷,李欣勇
(1.海南師范大學生命科學學院/熱帶島嶼生態學教育部重點實驗室,海口 571158;2. 中國熱帶農業科學院熱帶作物品種資源研究所,海南 儋州 571737)
【研究意義】植物受到逆境脅迫,如干旱、高鹽、低溫等,會誘導活性氧(ROS)的大量累積,ROS可導致生物分子損傷、凋亡或壞死、影響植物的生長發育[1]。超氧化物歧化酶(Super oxide dismutase,SOD)是一種重要的抗氧化酶,在清除自由基、維持活性氧代謝平衡、保護膜結構的功能及延遲衰老、保護組織和細胞免受氧化損傷方面起著重要作用。草海桐 (ScaevolasericeaL.) 作為一種鹽生植物,因其抗逆性強而廣泛分布于沿海沙灘、石礫地。研究表明伴隨著鹽濃度的升高,草海桐可通過增加抗氧化酶活性清除活性氧,降低鹽脅迫對植物的傷害[2-3]。因此,本研究運用生物技術方法從草海桐中克隆銅鋅超氧化物歧化酶基因,可為草海桐耐鹽脅迫相關分子機制及超氧化物歧化酶的深入研究提供理論依據。【前人研究進展】SOD是一類金屬酶,根據酶的輔因子的不同可分為4類:銅鋅超氧化物歧化酶(Cu/Zn-SOD)、錳超氧化物歧化酶(Mn-SOD)、鐵超氧化物歧化酶(Fe-SOD)和鎳超氧化物歧化酶(Ni-SOD)[4]。該家族可催化超氧化物陰離子歧化為過氧化氫,進一步被過氧化氫酶和過氧化物酶消除,轉化為無毒害作用的水和氧分子。Mn-SOD和Fe-SOD存在于線粒體、過氧化物酶體和葉綠體中。其中,Cu/Zn-SOD主要存在于葉綠體、細胞質和過氧化物酶體中,是活性氧清除酶系統中含量最豐富、最重要的酶,具有降低膜脂過氧化的作用[5]。前人研究表明,增強植物體內抗氧化酶活性有助于提高植物的抗逆性[6]。目前,研究人員已從秋茄[7]、水稻[8]、馬鈴薯[9]等植物中克隆得到Cu/Zn-SOD,經過逆境脅迫,發現均可誘導該基因的表達,提高植物的抗逆性。草海桐主要分布在我國華南沿海沙灘、石礫地,尤其是在我國的西沙群島分布有大量的草海桐林。西沙群島由于形成較晚,地貌主要是由珊瑚石灰巖和沙壤土組成,由此說明草海桐具有較強的抗逆性[10]。進一步研究表明,低鹽下可促進草海桐生長;伴隨著鹽濃度的升高,草海桐可通過增加抗氧化酶活性和可溶性蛋白、可溶性糖、脯氨酸等滲透調節物質清除活性氧,降低鹽脅迫對植物的傷害[2-3]。此外,草海桐還可響應干旱脅迫,通過對草海桐的形態解剖學特征發現:葉片及上表皮厚、氣孔密度小、導管直徑大,有利于適應干旱環境[11]。【本研究切入點】目前,對草海桐主要進行了在原生境下的抗逆生物學特性研究,尚未有關于抗逆功能基因的克隆與分析。【擬解決的關鍵問題】本研究以鹽脅迫草海桐葉片為材料,運用RACE技術克隆獲得草海桐Cu/Zn-SOD全長序列,并借助生物信息學技術對獲得的Cu/Zn-SOD進行序列分析,并成功構建了pBinGlyRed-SsCSD重組質粒。研究結果有助于揭示草海桐對鹽堿環境的適應機制,以期為草海桐的開發利用提供一定的理論與實踐依據。
1 材料與方法
1.1 植物材料
草海桐(ScaevolasericeaL.)種子采自三亞鐵爐港紅樹林自然保護區(18°15′N,109°42′E)。將浸種后的草海桐種子播種在沙床上,待種子萌發長出子葉后移植到裝有黃沙、泥炭土(體積比為3∶1)的育苗袋里,隨后放入人工氣候箱 (10 h光照, 14 h黑暗),每天噴灑一定量的水,培養溫度為25 ℃。待草海桐長出4~6片真葉時,用含有200 mmol/L NaCl的1/2 Hoagland 營養液處理24 h,處理結束后分別剪取草海桐的葉片和根,蒸餾水沖洗干凈,濾紙擦拭后液氮速凍保存樣品。
1.2 RNA提取及cDNA鏈的合成
稱取0.1 g草海桐的葉片,根據EASYspinplus多糖多酚復雜植物RNA快速提取試劑盒 (艾德萊生物公司, 北京)說明書進行操作。RNA溶于30 μL RNase Free Water中,瓊脂糖凝膠電泳檢測RNA質量,超微量核酸蛋白測定儀(Thermo)檢測所提總RNA的濃度,合格的樣品用于下一步分析。以草海桐總RNA為模板,按照反轉錄試劑盒 (全式金,北京)說明進行反轉錄,合成 cDNA 第一鏈。使用內參基因SsActin1進行cDNA第一鏈檢測[12]。
1.3 草海桐SsCSD基因保守片段的克隆
下載已報道的擬南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、秋茄(Kandeliacandel)、苦瓜(MomordicacharantiaL.)、向日葵(Helianthusannuus)、黃花蒿(Artemisiaannua)、萵苣(Lactucasativa)、麻風樹(Jatrophacurcas)、三裂葉薯(Ipomoeatriloba)、香瓜(Cucumismelo)等植物中的Cu/Zn-SOD氨基酸序列,運用ClustalW在線比對,根據同源序列設計簡并引物(表1)以擴增草海桐SsCSD的保守片段。以草海桐 cDNA 為模板進行PCR擴增,PCR擴增條件為:95 ℃ 3 min; 95 ℃ 15 s,55 ℃ 15 s,72 ℃ 45 s(35個循環);72 ℃ 5 min。PCR產物檢測回收后與pEASY-Blunt 載體 (全式金,北京)連接并轉入到大腸桿菌感受態細胞中,隨機挑取陽性菌落送到廣州天一輝遠基因科技有限公司測序。
1.4 草海桐SsCSD全長cDNA的克隆
對測序結果進行 Blast 在線分析,確認為CSD的同源片段后,根據獲得的中間片段序列設計 3′RACE的正向引物3′RACE OP和3′RACE IP(表1),接頭引物使用試劑盒提供的 UPM,參照 RACE試劑盒 (Takara,日本) 說明,進行草海桐SsCSD基因 3′末端的擴增。同樣的,設計5′RACE的引物5′RACE OP和5′RACE IP,接頭引物使用 UPM,進行草海桐SsCSD基因 5′末端的擴增。利用DNAMAN軟件設計含有接頭的引物進行ORF擴增。

表1 草海桐SsCSD基因克隆及表達分析的引物
1.5 草海桐SsCSD基因的生物信息學分析
利用Vector NTI軟件對測序結果進行拼接,得到全長cDNA;運用NCBI的 ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder)識別開放閱讀框并翻譯成氨基酸序列。根據尹明華等[13]的方法對草海桐的SsCSD序列進行氨基酸序列分析、理化性質分析、結構預測、亞細胞定位和功能分析等。
1.6 草海桐SsCSD植物表達載體的構建及鑒定
使用無縫克隆法構建pBinGlyRed-SsCSD載體。根據NCBI的預測的ORF序列,利用DNAMAN軟件設計含有接頭的特異性引物,上、下游分別添加EcoRⅠ和XmaⅠ內切酶位點:SsCSDORF FP和SsCSDORF RP(表1),進行ORF擴增。PCR的擴增程序:95℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s 35個循環);72 ℃ 5 min。PCR產物經1%瓊脂糖凝膠電泳進行檢測回收。同時植物表達載體pBinGlyRed經過EcoRⅠ和XmaⅠ雙酶切,將回收基因片段與線性化載體采用無縫克隆法進行連接,經熱激法轉入大腸桿菌感受態細胞。挑取單菌落進行菌落PCR驗證和測序,提取質粒并采用凍融法轉入農桿菌GV3101, 對菌液 PCR 鑒定為陽性的克隆即可用于遺傳轉化。
2 結果與分析
2.1 草海桐SsCSD全長cDNA序列的獲取
使用簡并引物CSD FP和CSD RP進行RT-PCR擴增獲得約280 bp的保守片段(圖1)。將該片段進行Blast分析,發現該序列同其他物種的銅鋅超氧化物歧化酶高度同源。根據此片段序列設計特異性引物3′RACE OP,3′RACE IP,5′RACE OP和5′RACE IP,利用RACE技術獲得了草海桐SsCSD基因的3′末端和5′末端cDNA片段,長度分別為650和700 bp。將上述3個核苷酸序列拼接后,獲得了草海桐SsCSD基因的全長cDNA序列,其長度為1148 bp,5′端和3′端分別存在 92和370 bp 的非翻譯區(圖2)。
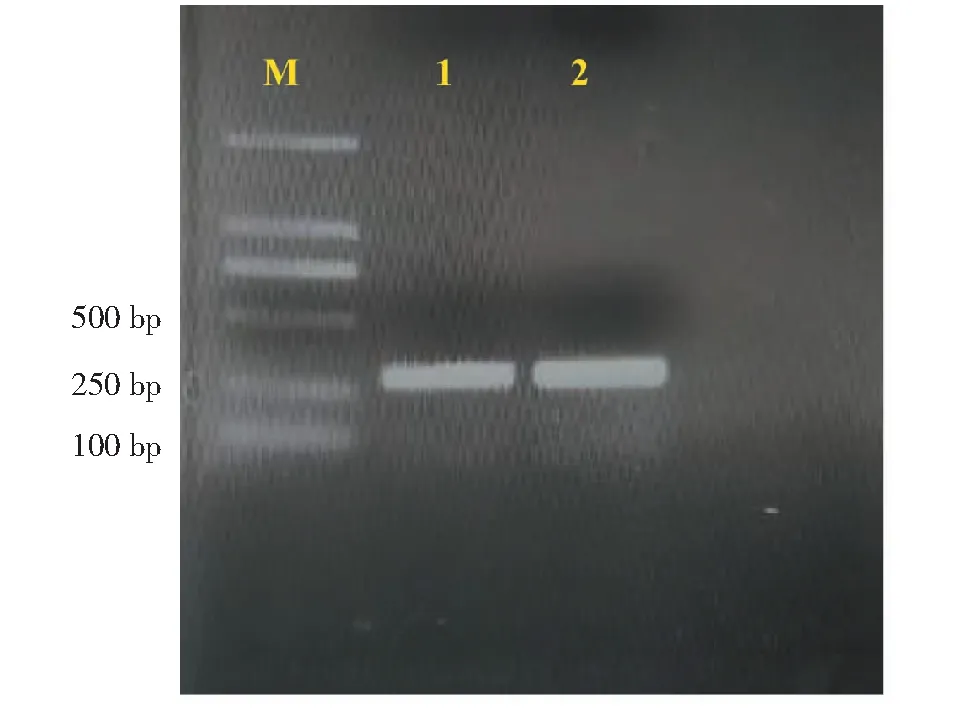
M: Trans 2K DNA marker; 1~2: CSD 保守片段M: Trans 2K DNA marker; 1-2: Conserved sequence of CSD圖1 簡并PCR凝膠電泳Fig.1 Degenerate PCR gel electrophoresis

圖2 草海桐SsCSD的ORF框及氨基酸序列Fig.2 ORF and amino acid sequence of SsCSD in S.sericea
2.2 草海桐SsCSD基因編碼蛋白的生物信息學分析
草海桐SsCSD含完整編碼區,從起始子到終止子共編碼228個氨基酸(圖2),分子量為23.260 kDa,理論等電點為5.55,脂溶指數為85.18。利用ExPASy Proteomics Server的ProtScale程序分析該蛋白的親水性和疏水性,總平均疏水性為-0.14,推測為親水性脂溶蛋白(圖3)。
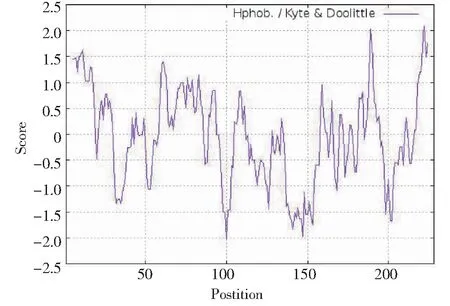
圖3 SsCSD蛋白疏水性/親水性預測和分析Fig.3 Protein hydrophobicity/hydrophilicity prediction and analysis of SsCSD
利用NCBI網站(https://www.ncbi.nlm.nih.gov/)對上述所得的蛋白序列進行保守結構域分析,由圖4可知,草海桐SsCSD屬于Cu/Zn-SOD家族。利用softberry網站對克隆得到的基因進行亞細胞定位分析,預測表明定位于葉綠體的可能性最大。采用Signal P 3.0 Server預測表明,SsCSD含有信號肽序列。TMHMM結果顯示,該蛋白無跨膜區,為非跨膜蛋白(圖5)。采用SOPMA結構預測草海桐SsCSD蛋白的二級結構顯示無規則卷曲(Random coil,47.37%)和延伸鏈(Extended strand,28.95%)占比最高,其次是α-螺旋(Alpha helix,16.67%)和β-轉角(Beta turn,7.02%)(圖6)。
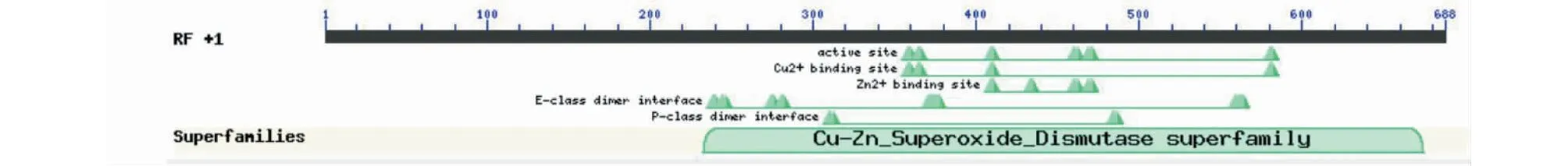
圖4 草海桐SsCSD蛋白保守結構域分析Fig.4 Conserved domain analysis of SsCSD in S. sericea
2.3 草海桐SsCSD基因編碼蛋白系統進化分析
為進一步了解SsCSD的生物學功能,采用MEGA7對草海桐和10個物種的CSD氨基酸序列進行系統進化樹分析。經過比對分析,草海桐與雙子葉植物向日葵、萵苣、黃花蒿的CSD蛋白在同一大分支下,表明草海桐的SsCSD蛋白在進化上與向日葵、萵苣、黃花蒿的親緣關系最近(圖7)。進一步聚類發現,Cu/Zn-SOD蛋白成員聚成2個大類,草海桐與擬南芥(AtCSD2)、秋茄(KcCSD)、麻風樹(JcCSD)和向日葵(HaCSD)的葉綠體型CSD蛋白同處于一個分支;水稻(OsCSD1和OsCSD2)與擬南芥(AtCSD1)的細胞質型CSD蛋白同處于另一個分支。結合之前分析的SsCSD定位于葉綠體,該進化分析系統樹表明草海桐SsCSD蛋白也聚類到葉綠體CSD蛋白,推測草海桐SsCSD蛋白定位于葉綠體。
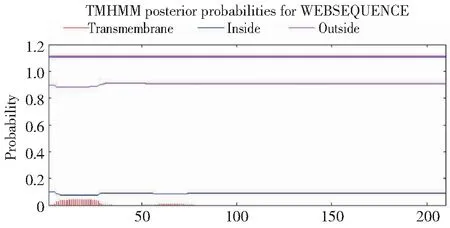
圖5 草海桐SsCSD蛋白跨膜結構分析Fig.5 Protein transmembrane structure analysis of SsCSD in S. sericea
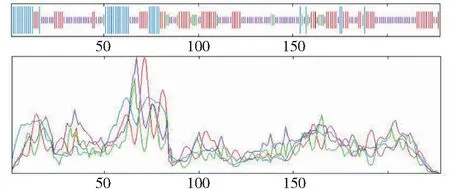
藍色:α-螺旋;紅色:延伸鏈; 紫色:無規則卷曲;綠色:β-轉角Blue represents α-helix; Red represents extended strand; Purple represents irregular curl; Green represents β-turn圖6 草海桐SsCSD蛋白二級結構預測Fig.6 Protein secondary structure prediction of SsCSD in S. sericea
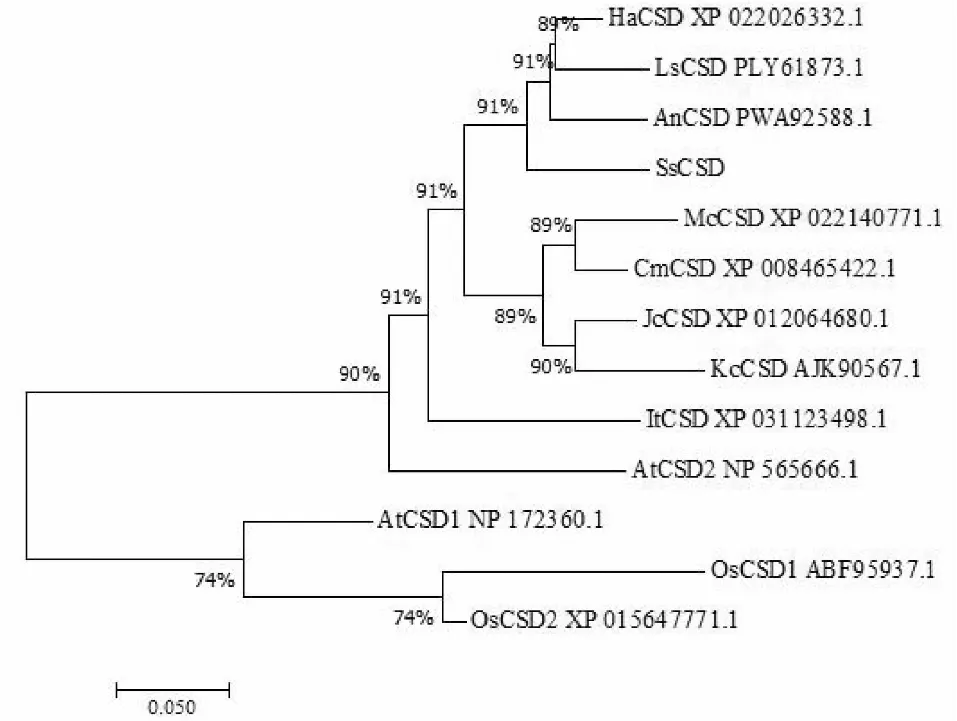
圖7 草海桐與其他植物CSD氨基酸序列的系統進化分析Fig.7 Phylogenetic analysis of CSD in S. sericea and other plants
2.4 草海桐SsCSD基因的植物表達載體構建
以草海桐的cDNA為模板,用引物對CSD ORF FP和CSD ORF RP擴增SsCSD基因的ORF序列,凝膠電泳顯示擴增得到一條約700 bp的條帶,通過無縫克隆的方法將目的基因與線性化載體進行連接,篩選并測序正確后,重新提取質粒,轉化農桿菌感受態細胞GV3101。菌落PCR鑒定顯示均在750 bp左右有目的條帶(圖8),表明重組載體pBinGlyRed-SsCSD已成功轉入農桿菌GV3101中,可用于下一步的植物遺傳轉化,以驗證基因功能。

M: Trans 2K DNA marker; 1:陰性對照;2:陽性對照;3~9:陽性菌落M: Trans 2K DNA marker; 1: Negative control;2: Positive control;3-9: Screening for positive colonies for pBinGlyRed-SsCSD圖8 草海桐SsCSD基因的表達載體陽性克隆鑒定Fig.8 The Positive clone identification for gene expression vector of SsCSD in S.sericea
3 討 論
植物不同于動物,它以一種固著的生活方式以面對各種環境脅迫,諸如高溫、低溫、干旱、水澇及高鹽等的影響。當植物面臨非生物脅迫時,表現為葉片中葉綠素的含量減少,光合速率下降;氧離子(O2-)、過氧化氫(H2O2) 和羥基(-OH)等活性氧物質(ROS)積累,ROS的積累會引起膜系統的過氧化,從而造成細胞脂膜系統的破壞,而脂膜過氧化產物會對植物細胞造成毒害[14-15]。為了減輕ROS的毒害作用,植物配有一系列酶和非酶抗氧劑分子以清除ROS,超氧化物歧化酶作為一種抗氧化酶,具有清除活性氧的功能,保護植物體免受活性氧的危害[16]。Cu/Zn-SOD是3種歧化酶中含量最豐富的一種酶,是活性氧清除酶系統中最重要的酶,參與植物的耐鹽堿、抗旱及耐高溫等逆境脅迫,且易受到多種逆境因子的誘導表達[4]。草海桐是一種濱海植物,耐鹽性強,且在一定范圍內超氧化物歧化酶活性隨著鹽濃度的增大而提高,在此基礎上,本研究通過RACE技術成功克隆了草海桐Cu/Zn-SOD。
近年來,對Cu/Zn-SOD研究較為廣泛,如在白菜[17]、茶樹[18]、絲瓜[5]、秋茄[7]中均克隆了Cu/Zn-SOD。按照其在細胞內的分布位置可分為細胞內Cu/Zn-SOD (ic Cu/Zn-SOD)和細胞外Cu/Zn-SOD(ec Cu/ZnSOD),細胞內Cu/Zn-SOD主要定位在細胞質和葉綠體中,而細胞外Cu/Zn-SOD則多見于動物細胞中[19-20]。本研究通過亞細胞定位預測SsCSD定位于葉綠體,結合系統進化分析草海桐SsCSD與其他植物葉綠體Cu/Zn-SOD聚在一個分支,推測草海桐SsCSD定位于葉綠體。研究表明,鹽堿脅迫會誘導水稻的葉綠體Cu/Zn-SOD轉錄水平提高,SOD酶活性高于對照,過表達OsCu/Zn-SOD可顯著提高水稻的耐鹽性,且轉基因株系的根長、株高和鮮重均高于對比水稻;隨著鹽脅迫加深,會加劇體內丙二醛的含量,通過生理指標檢測發現過表達植株中的MDA含量顯著低于對照株,表明過表達OsCu/Zn-SOD增強了植物清除活性氧的能力,降低了氧化脅迫傷害[8]。鹽生植物具有更強的耐鹽能力,秋茄在短期鹽脅迫下,可通過根部有效排出Na+;而在長期鹽脅迫下,可將Na+向上運輸至葉片,導致葉片中H2O2含量提高,通過提高體內KcCSD的轉錄水平緩解鹽脅迫,直接表現為葉片中的SOD活性增強[21]。研究人員克隆到了秋茄的CSD基因,分析顯示為葉綠體型Cu/Zn-SOD,在煙草中過表達KcCu/Zn-SOD,鹽脅迫情況下,轉基因煙草葉綠體中的H2O2積累遠低于野生型煙草,表明煙草葉綠體中光合電子傳遞鏈形成超氧陰離子,作為信號反饋調節抗氧化系統,激活逆境下的防御機制,減少葉綠體中活性氧的積累,緩解鹽脅迫[7]。
4 結 論
本研究以鹽脅迫草海桐為材料,運用RACE技術克隆到了草海桐Cu/Zn-SOD基因,命名為SsCSD,該基因全長共1148 bp。生物信息學分析表明SsCSD編碼蛋白含有228個氨基酸,預測分子量為23.26 kDa,等電點5.55,為親水性蛋白;其二級結構由無規則卷曲(47.37%)、延伸鏈(28.95%)、α-螺旋(16.67%)和β-轉角(7.02%)組成;氨基酸保守結構域分析表明該序列具有銅鋅超氧化物歧化酶保守結構域,屬于SOD家族。草海桐Cu/Zn-SOD在進化上與向日葵、萵苣、黃花蒿葉綠體型Cu/Zn-SOD親緣關系更近,結合生物信息學分析,推測SsCSD定位于葉綠體。在此基礎上,成功構建了SsCSD植物過表達載體,有助于基因功能分析。為此,后續研究將對SsCSD的亞細胞定位,基因與草海桐耐鹽能力的相關性進行分析,有助于揭示草海桐適應鹽生境的分子機制。

