介入聯合保守治療下肢動脈硬化閉塞癥的臨床療效及預后危險因素分析
唐文濤,劉杰,徐章倫
(湖北省天門市第一人民醫院1. 介入科,2. 腫瘤科,湖北 天門431700)
下肢動脈硬化閉塞癥是一種因動脈粥樣硬化引發血管腔狹窄或閉塞而導致下肢血液供應不足甚至潰瘍、壞死的慢性進展性疾病,其發病率逐年增加,若治療不及時,下肢會出現嚴重缺血,重度者被截肢,對患者的生存質量產生巨大影響[1]。一般治療、藥物治療、手術治療及介入治療是常用的治療方法,目前認為介入治療是一種療效顯著的方法,但也有觀點認為其容易受多方面因素影響,增加治療的不確定性[2]。因此,本研究分析介入聯合保守治療對下肢動脈硬化閉塞癥的臨床效果,分析影響該病預后的危險因素,旨在為臨床治療提供有力的參考依據。
1 資料與方法
1.1 一般資料
選取2016年7月—2018年10月湖北省天門市第一人民醫院接受治療的98 例下肢動脈硬化閉塞癥患者,根據治療方法的不同分為實驗組(50 例)和對照組(48 例)。實驗組在保守治療基礎上聯合介入治療,其中,男性35例,女性15例;年齡43~86 歲,平均(65.41±6.27)歲;病程2~8年,平均(4.38±1.42)年;病變動脈:髂動脈30 條,股腘動脈27 條,膝下動脈26 條;合并癥:高血壓32 例,心臟病14例,糖尿病9 例,腦血管病12 例,慢性腎功能不全16 例,高脂血癥25 例,低蛋白血癥30 例,貧血13 例。對照組僅采取保守治療,其中,男性32 例,女性16 例;年齡43~85 歲,平均(64.83±6.25)歲;病程2~9年,平均(4.47±1.46)年;病變動脈:髂動脈27 條,股腘動脈24 條,膝下動脈22 條;合并癥:心臟病14 例,高血壓30 例,糖尿病8 例,腦血管病11 例,慢性腎功能不全12 例,高脂血癥24 例,低蛋白血癥29 例,貧血15 例。診斷標準[3]:①患者年齡>40 歲;有吸煙史、高血壓、高脂血癥、糖尿病等高危因素;②有下肢動脈硬化閉塞癥的臨床表現;③缺血肢體遠端動脈搏動減弱或消失;④踝肱指數(ankle brachial index,ABI)≤0.9;⑤彩色多普勒超聲、 計算機斷層動脈造影(computed tomographic angiography, CTA)、核磁共振動脈造影(magnetic resonance angiography, MRA)、數字減影血管造影(digital subtraction angiography, DSA)等影像學檢查結果顯示相應動脈出現狹窄或閉塞等病變。符合上述診斷標準前4 項即可診斷為下肢動脈硬化閉塞癥。納入標準:①符合上述下肢動脈硬化閉塞癥診斷標準;②臨床資料完整。排除標準:①合并惡性腫瘤、肝腎等重要器官功能障礙者;②凝血功能障礙者;③精神分裂癥、抑郁癥等精神障礙者。本研究經醫院醫學倫理委員會審核批準,患者和家屬簽署知情同意書。
1.2 治療方法
對照組在控制血壓、血脂、血糖的同時采取抗血小板的保守治療。實驗組在保守治療基礎上聯合介入治療:患者局部麻醉后行股動脈穿刺,向血管內置入導管鞘并注入肝素,經下肢血管造影,充分了解下肢動脈狹窄及閉塞情況,并確定穿刺點,之后將導管和導絲經導管鞘置入,探查遠端至接近血管閉塞部位,采取緩慢捻轉“J”型親水導絲的方式將閉塞部位打通;或者于患者膝下動脈置入微球囊行經皮腔內血管成形術,于健側股動脈處將6 F 導管置入,5 F 造影導管經下肢動脈狹窄處穿過,置換加硬導絲,并使球囊導管跟進,擴張下肢動脈狹窄、閉塞部位。若擴張后造影顯示動脈狹窄率仍>30%,則于狹窄段放置EV3 血管內支架,若發生完全性閉塞則需先行血栓旋切術以疏通血管,再置入支架。造影檢查顯示血管管腔暢通后,經導管灌注藥物至動脈后即可結束手術。手術后對患者進行抗凝治療,改善凝血功能,避免血小板聚集導致深靜脈血栓。出院后患者需長期接受抗血小板治療,并囑咐患者增加運動量。
1.3 觀察指標
①患者的年齡、性別構成、病程、吸煙史、飲酒史,以及是否合并高血壓、心臟病、糖尿病、腦血管病、慢性腎功能不全、高脂血癥、低蛋白血癥、貧血、纖維蛋白原。②患者的白細胞、血小板及淋巴細胞計數。③患者的跛行距離、Rutherford 分級、病變動脈及ABI。踝部脛前或脛后動脈收縮壓與上臂(肱動脈)收縮壓的比值即為ABI[3]。Rutherford 分級[3]:輕度間歇性跛行為1 級;中度間歇性跛行為2 級;重度間歇性跛行為3 級;出現靜息痛為4 級;輕微組織缺損為5 級;組織潰瘍、壞疽為6 級。④患者的住院時間、臨床療效、心腦血管事件、截肢及死亡發生情況。臨床療效評定標準[4]:血管造影顯示血管狹窄<30%,癥狀消失,未合并嚴重并發癥為顯效;血管造影顯示狹窄<50%,潰瘍愈合率>50%,癥狀改善,未出現并發癥為有效;血管狹窄更嚴重,癥狀未改善甚至加重為無效;總有效率=顯效率+有效率。
1.4 隨訪及預后分組
每隔半年入院復查,一旦發現血管狹窄便及時治療,患者隨訪1年。隨訪期間再狹窄(下肢彩色超聲或CT 復查血管狹窄>50%定義為再狹窄)、截肢、死亡患者定義為預后不良組(31 例),其余患者為預后良好組(67 例)。
1.5 統計學方法
數據分析采用SPSS 17.0 統計軟件,計量資料以均數±標準差(±s)表示,比較用t檢驗;計數資料以構成比或例(%)表示,比較用χ2檢驗。影響預后的危險因素分析采用多因素Logistic 回歸分析模型;采用決策樹模型確定連續變量Logistic 分析時的分層分界點。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者的一般資料比較
兩組患者的年齡,性別構成,病程,跛行距離,ABI,Rutherford 分級,病變動脈,吸煙史、飲酒史、高血壓、心臟病、糖尿病、腦血管病、慢性腎功能不全、高脂血癥、低蛋白血癥、貧血、纖維蛋白原、白細胞計數、血小板計數及淋巴細胞計數比較,差異均無統計學意義(P>0.05)。見表1。
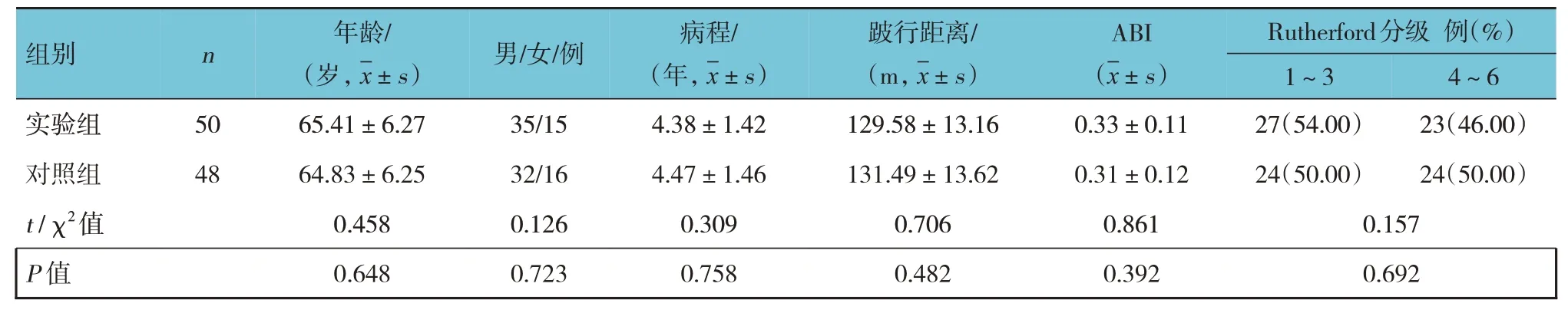
表1 兩組患者的一般資料比較
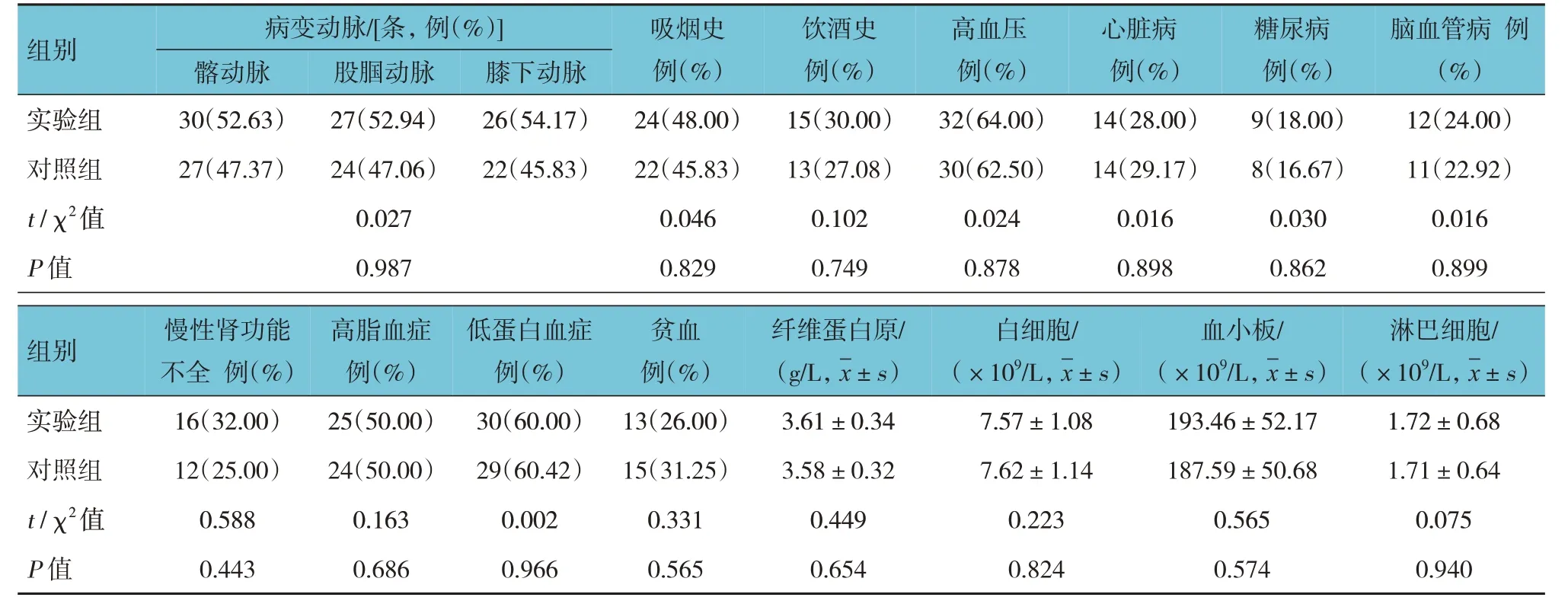
續表1
2.2 兩組患者治療情況比較
兩組患者住院時間、治療費用比較,差異有統計學意義(P<0.05),實驗組較對照組住院時間縮短,但治療費用增加。兩組患者的跛行距離、ABI 比較,差異有統計學意義(P<0.05),實驗組大于對照組。兩組患者血管暢通率、總有效率比較,差異有統計學意義(P<0.05),實驗組高于對照組。兩組患者心腦血管事件、截肢及死亡發生率比較,差異有統計學意義(P<0.05),實驗組低于與對照組。兩組患者Rutherford 分級比較,差異有統計學意義(P<0.05),實驗組較對照組明顯改善。見表2。
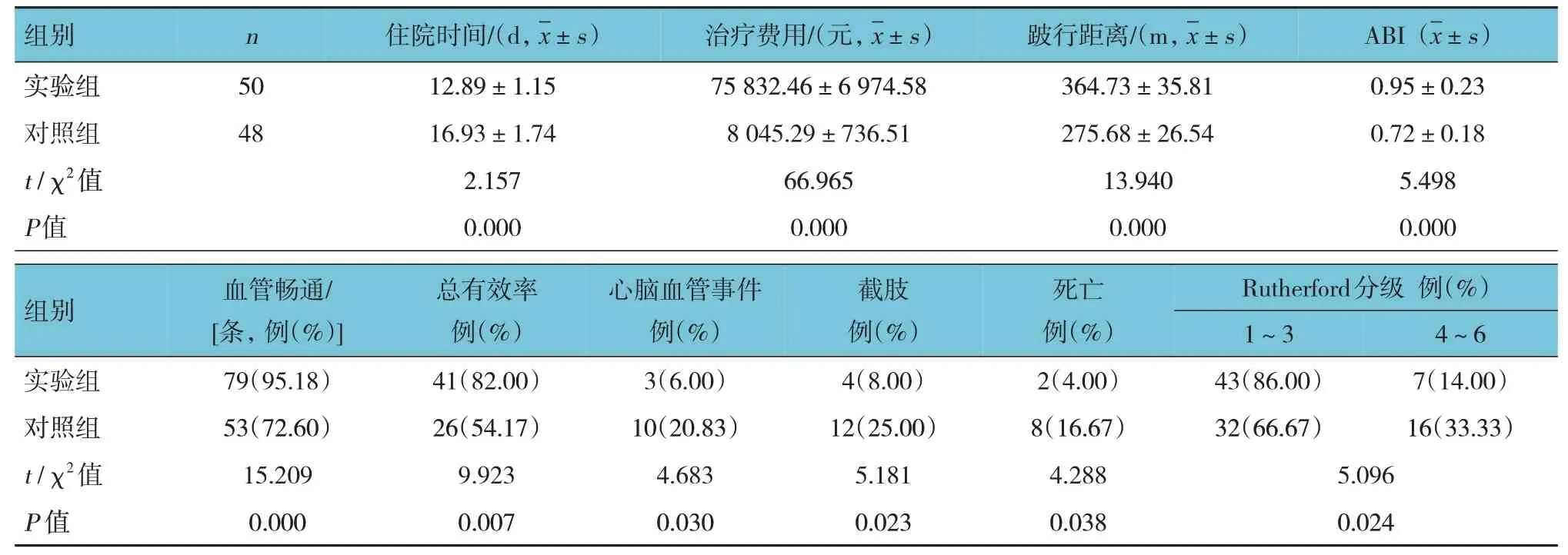
表2 兩組患者治療情況比較
2.3 影響預后的單因素分析
預后不良組和預后良好組患者在年齡、病程、住院時間、ABI、纖維蛋白原、治療方法、吸煙史、血小板升高、淋巴細胞降低、暢通與病變動脈構成、高血壓、糖尿病、高脂血癥方面比較,差異有統計學意義(P<0.05);兩組在性別構成、Rutherford 分級、飲酒史、白細胞升高、心臟病、腦血管病、慢性腎功能不全、低蛋白血癥、貧血方面比較,差異無統計學意義(P>0.05)。見表3。
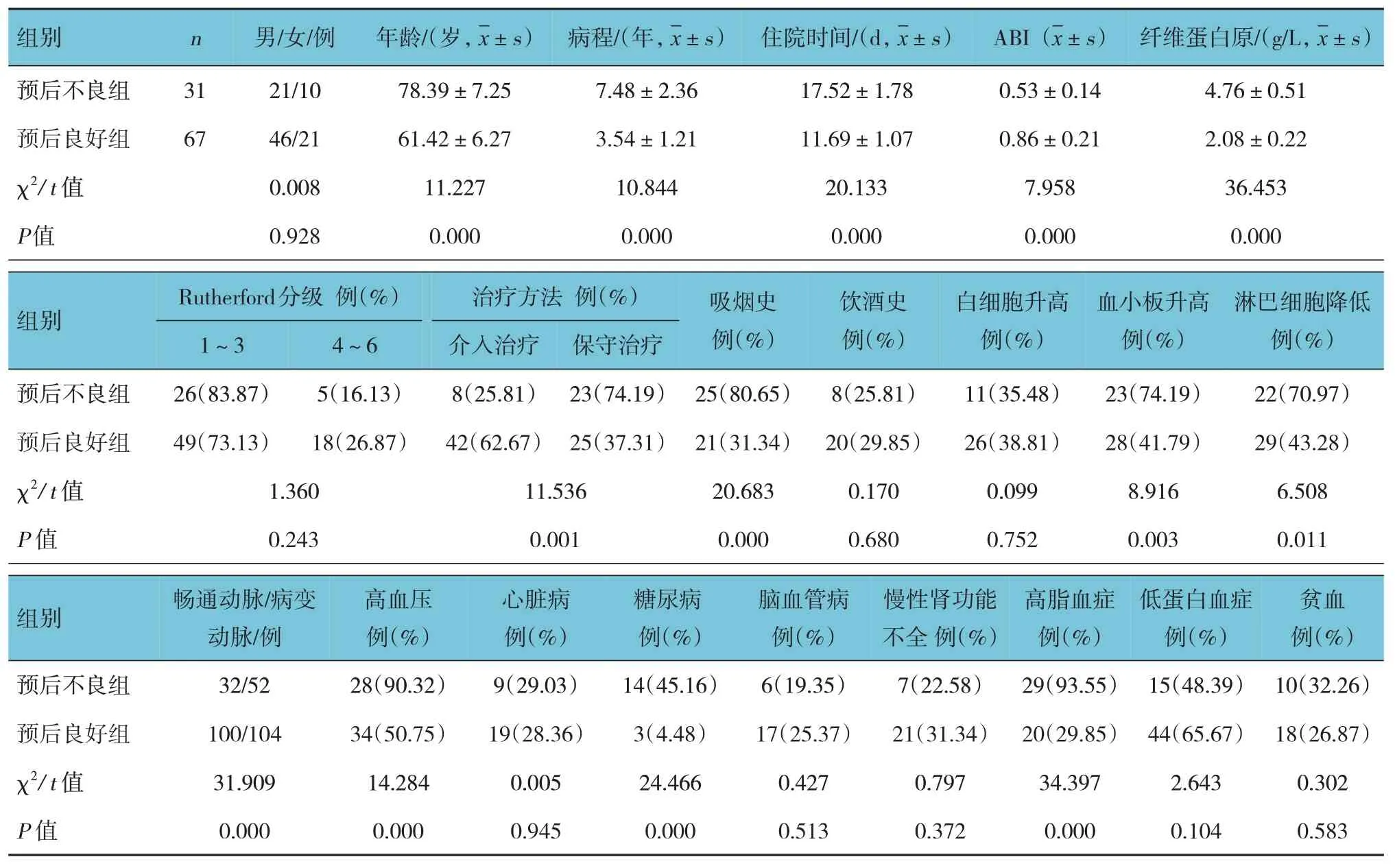
表3 預后不良組和預后良好組影響因素的比較
2.4 影響預后的多因素Logistic回歸分析
將預后不良組和預后良好組差異有統計學意義的因素作為自變量,將下肢動脈硬化閉塞癥預后作為因變量,經多因素Logistic 回歸分析結果顯示,年齡[=1.768(95% CI:1.013,2.847)]、保守治療[=4.126(95% CI:2.527,6.638)]、吸煙[=3.074(95% CI:1.409,4.753)]、高 血 壓[=2.631 (95% CI:1.625,3.986)]、糖 尿 病[=4.956(95% CI:3.226,6.817)]、高脂血癥[=2.278(95% CI:1.343,3.751)]及纖維蛋白原(=3.149(95% CI:2.182,4.691)]是影響下肢動脈硬化閉塞癥預后的獨立危險因素(P<0.05)。見表4。
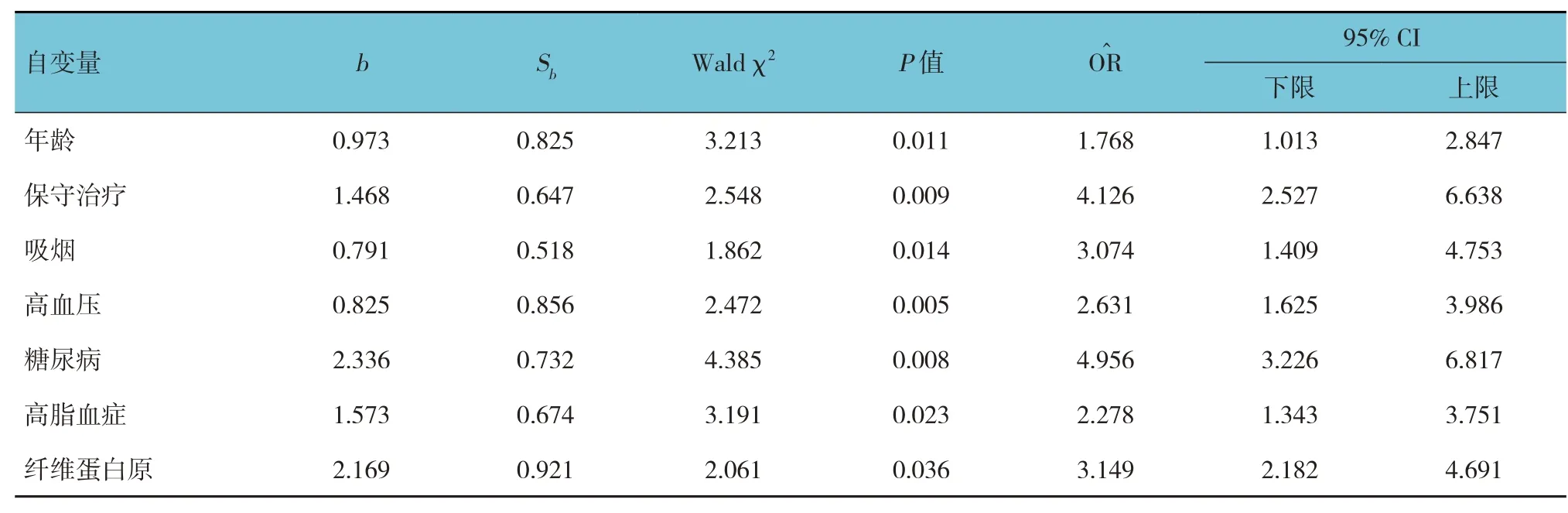
表4 影響下肢動脈硬化閉塞癥預后的多因素Logistic回歸分析參數
2.5 連續變量分層結果
決策樹模型分析結果顯示,年齡70 歲、纖維蛋白原水平4 g/L 時預測性更高,對下肢動脈硬化閉塞癥預后的影響更大(P<0.05)。進而對年齡、纖維蛋白原水平進行分層,年齡分為>70歲和≤70歲,纖維蛋白原水平分為>4 g/L 和≤4 g/L,結果顯示,年齡>70 歲、纖維蛋白原>4 g/L、采取保守治療、吸煙、合并高血壓、糖尿病、高脂血癥是下肢動脈硬化閉塞癥預后不良的高危因素。見圖1。
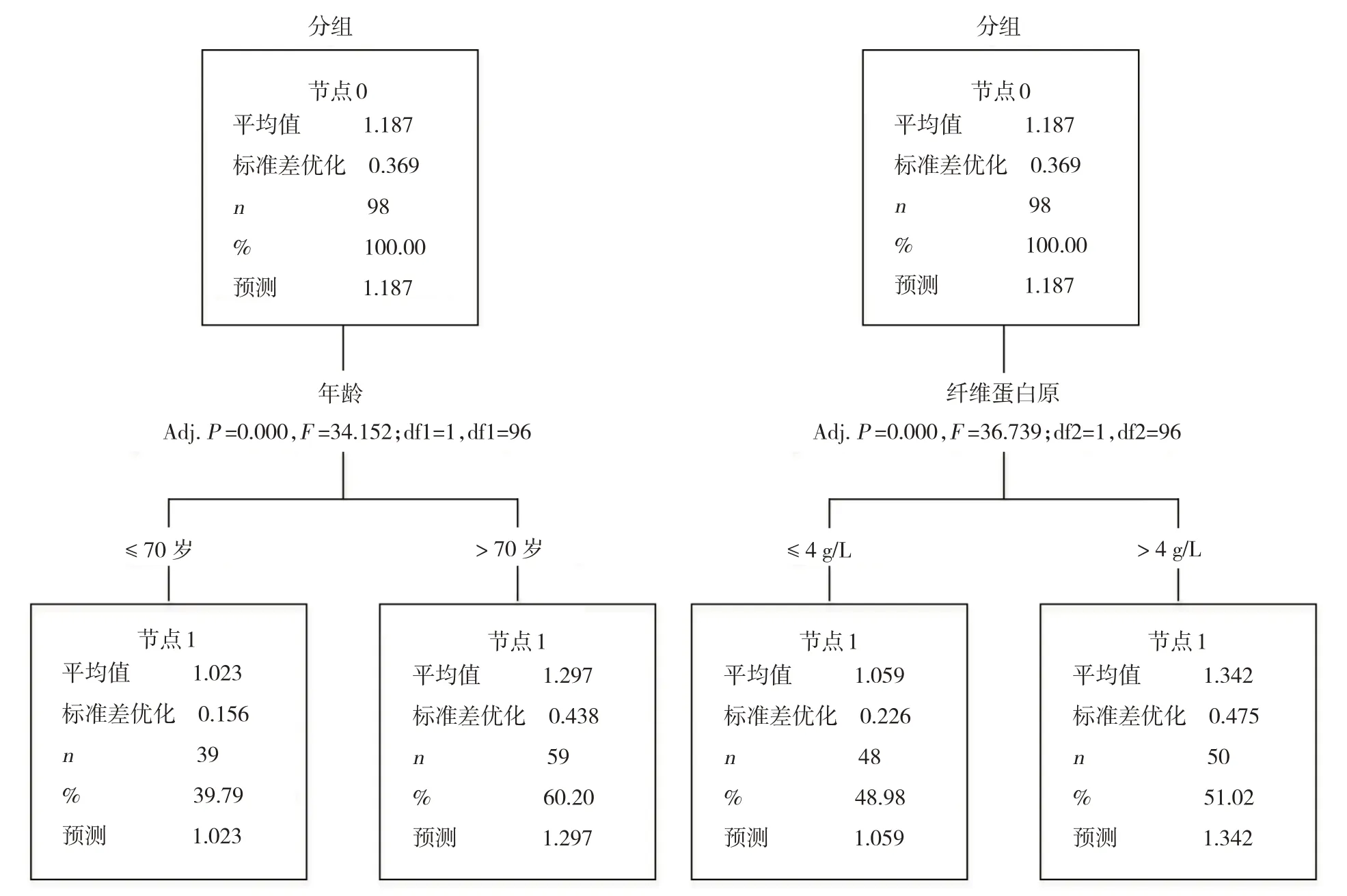
圖1 決策樹模型分析連續變量分層節點
3 討論
下肢動脈硬化閉塞癥常以患肢皮膚溫度降低、缺血性靜息痛、間歇性跛行、遠端肢體潰瘍甚至壞疽為主要臨床表現,目前認為血管內形成的血栓及斑塊使血管腔變狹窄、閉塞,導致組織出現供血不足、壞死是發病的主要原因[5]。早期文獻報道[6],下肢動脈硬化閉塞癥治療難度較大且預后差,盡管保守治療在改善患者微循環的同時還能發揮抗感染作用,但并未達到理想效果。近年來,隨著醫學水平的提高和醫療器械的改進,介入治療因具有微創、安全、療效好、易恢復的特點而被廣泛采用。溶栓、球囊擴張、腔內旋切、支架置入、擴張和重建動脈是常用的介入治療方法[7]。本研究實驗組住院時間較對照組縮短,但治療費用增加。治療后實驗組Rutherford 分級明顯改善,血管暢通率和總有效率明顯增加,該結果與張滿霞等[8]報道相符。治療后實驗組的跛行距離和ABI大于對照組,該結果與李潤生等[9]報道一致。介入治療使患者狹窄甚至閉塞的血管得到有效擴張和重建,改善血液流通情況,從而使血管暢通率顯著增加,Rutherford 分級隨之改善,跛行距離和ABI隨之增加,總有效率亦顯著提高。保守治療雖然能改善患者微循環,但起效慢,住院時間延長。介入治療由于高值耗材的使用而大大增加了治療費用。實驗組心腦血管事件、截肢及死亡發生率均低于對照組。說明下肢動脈硬化閉塞癥采用介入聯合保守治療更安全有效,可大大降低心腦血管事件、截肢及死亡發生率,本結果與鐘輝[10]報道相符。
近年來,盡管治療方法較多,醫療器械更加先進,明顯提高了下肢動脈硬化閉塞癥患者的保肢率和生存率,但有數據顯示仍有一定程度心腦血管病、截肢、死亡等不良事件的發生[11]。作為一種系統性疾病,下肢動脈硬化閉塞癥常伴發心臟病、糖尿病、腦血管病等諸多疾病,下肢缺血嚴重者發生潰瘍、壞疽進而導致截肢,合并癥的加重可能導致患者死亡[12]。因此,分析影響患者預后的危險因素,及早進行有效預防治療意義重大。本研究分析結果顯示,兩組患者的性別構成、Rutherford 分級、飲酒史、心臟病、腦血管病、慢性腎功能不全、低蛋白血癥、貧血及白細胞升高均無差異。兩組患者在年齡、病程、住院時間、ABI、纖維蛋白原、治療方法、吸煙史、血小板升高、淋巴細胞降低、暢通與病變動脈構成、高血壓、糖尿病及高脂血癥方面均有差異。將以上差異有統計學意義的因素納入多因素Logistic 回歸分析,結果顯示,年齡、保守治療、吸煙、高血壓、糖尿病、高脂血癥、纖維蛋白原是影響下肢動脈硬化閉塞癥預后的獨立危險因素。文獻報道[13],隨著年齡的增長,下肢動脈硬化閉塞癥發病率升高,且>70 歲的人群發病率顯著高于≤70 歲的人群,與本研究結果相符。諸多研究證實[14],介入治療是目前臨床上最常用的治療方法,其臨床效果及預后均顯著優于保守治療。吸煙增加了血管再狹窄的發生率,從而使嚴重下肢缺血和截肢的危險加大,且資料顯示吸煙量與疾病嚴重程度具有正相關性[15]。動脈粥樣硬化是下肢動脈硬化閉塞癥發生的主要病因,高血糖可導致機體激素分泌異常、血管內皮細胞功能紊亂及血小板功能異常,從而發生動脈粥樣硬化[16]。高血壓,尤其是收縮期血壓與下肢動脈硬化閉塞癥的相關性更高,但相對危險度比吸煙和糖尿病低[17]。高脂血癥可增加間歇性跛行發生的危險,增加患病率[18]。纖維蛋白原是血液中的重要凝血因子,其水平升高可引發動脈粥樣硬化[19]。決策樹模型是對結果變量根據自變量進行預測及分析,連續變量分層的分界點確定采用決策樹模型CHAID 方法,以α=0.05 作為決策樹模型中連續變量拆分的檢驗水準,當拆分后的變量P>0.05 后不再拆分[20]。本研究結果顯示,年齡>70 歲、纖維蛋白原>4 g/L 對下肢動脈硬化閉塞癥預后的影響更大,此外,采取保守治療、吸煙、合并高血壓、糖尿病、高脂血癥也是下肢動脈硬化閉塞癥預后不良的高危因素。
綜上所述,下肢動脈硬化閉塞癥采用介入聯合保守治療,具有安全性高、療效好、易恢復,并發癥少的優勢。年齡增加、保守治療、吸煙、高血壓、糖尿病、高脂血癥、纖維蛋白原升高可導致下肢動脈硬化閉塞癥預后不良,可叮囑患者治療后及早戒煙,采取降壓、降糖、降脂等針對性措施減少病情復發,進而取得良好預后。

