鹽酸伊立替康對一線標準方案治療失敗小細胞肺癌患者的療效分析
羅小龍,林富林,葉韻杰,嵇雪林,鄧玲枝
(聯勤保障部隊第九零三醫院1.普外科,2.消毒供應室,浙江 杭州310000)
肺癌是我國乃至全球高發、高致死性的惡性腫瘤,根據病理學分類可分為非小細胞肺癌(nonsmall cell lung cancer, NSCLC)與小細胞肺癌(small cell lung carcinoma, SCLC)。SCLC 僅占肺癌總數的15%~20%,但復發率及病死率均較高[1]。當前臨床研究多集中于NSCLC,且獲得了巨大進展,而SCLC的研究較少。SCLC 具有進展速度快、瘤體倍增時間短、分化程度低、惡性程度高及遠處轉移風險高等特點,大部分患者難以經手術切除獲得痊愈,多需接受化療[2]。SCLC 一線化療的敏感性較高,臨床推薦的SCLC 一線化療方案為依托泊苷加鉑類(依托泊苷+順鉑或依托泊苷+卡鉑)方案,一線化療緩解率可達50%~90%,但化療效果維持時間短,大部分局限期SCLC 及幾乎所有廣泛期SCLC 患者在1年內病情進展或復發,嚴重威脅患者的生存[3]。目前,臨床尚缺乏針對SCLC 的標準二線治療方案。多西他賽、紫衫醇、鹽酸拓撲替康、鹽酸伊立替康等用于二線治療SCLC 具有一定效果,但仍缺乏充分的有效性及毒性研究[4]。本研究探討鹽酸伊立替康用于二線治療SCLC 的近期療效、毒副反應、生存情況,并檢測相關血清腫瘤標志物的水平,旨在為SCLC 的二線治療提供參考。
1 資料與方法
1.1 一般資料
選取2017年2月—2019年2月在聯勤保障部隊第九零三醫院一線標準方案治療失敗接受二線治療的75 例SCLC 患者為研究對象。納入標準:①經細胞學或組織病理學檢查確診為SCLC;②接受標準一線化療,且在一線化療失敗后接受二線治療及隨訪;③至少具有1 個可測量病灶;④年齡≥30 歲,性別不限;⑤體力活動狀態(performance status, PS)評分為0~2 分;⑥預計生存期>2 個月。排除標準:①合并自身免疫性疾病或急、慢性感染;②合并嚴重心腦血管疾病、肝腎功能障礙;③合并其他惡性腫瘤;④已出現脊髓受壓、腦膜轉移或活動性腦轉移;⑤合并精神疾病、認知功能障礙及溝通交流障礙。本研究經醫院醫學倫理委員會審核批準,所有患者自愿簽署知情同意書。
1.2 治療方法
根據患者意愿進行二線治療,21 例不愿接受再次化療者,予以除專科抗腫瘤藥物外的最佳支持治療(BSC 組),包括止吐、鎮痛、營養支持及局部姑息性放療等,以減輕癥狀及改善生活質量為目的。54 例患者接受二線化療(二線化療組),其中,19 例單用鹽酸伊立替康治療(鹽酸伊立替康組),35 例鹽酸伊立替康加鉑類化療(IP 組)。具體劑量:鹽酸伊立替康(齊魯制藥有限公司,國藥準字H20068128)60~70 mg/m2靜脈滴注,d 1,d 8;若聯合鉑類,則順鉑(齊魯制藥有限公司,國藥準字H37021362)75 mg/m2,靜脈滴注,d 1;或卡鉑(齊魯制藥有限公司,國藥準字H10920027)曲線下面積(AUC)5~6 靜脈滴注,d 1。以上化療方案均21 d 為1 個周期,連續化療4~6 個周期,周期之間休息1 周。化療前常規應用止吐藥物預防嘔吐,化療期間出現Ⅳ度副反應允許減量,在下個周期標準劑量的基礎上降低25%,或將鹽酸伊立替康加鉑類方案調整為鹽酸伊立替康單藥化療。
1.3 酶聯免疫吸附試驗(ELISA)檢測血清神經元特異性烯醇化酶(NSE)、癌胚抗原(CEA)、細胞角蛋白19片段(CYFRA21-1)
治療前后,清晨取患者空腹靜脈血3.0~5.0 mL,3 000 r/min 離心10 min,離心半徑為15 cm,取上清液,置于-70℃冰箱中冷凍保存待測。采用ELISA法檢測血清NSE、CEA、CYFRA21-1 的水平,由固定檢驗人員嚴格按照試劑說明書操作。參考范圍:NSE<17.00 μg/L,CEA<5.00 μg/L,CYFRA21-1<3.20 μg/L。
1.4 療效標準
開始化療后,每8 周評估1 次腫瘤控制效果,評價標準參照實體腫瘤療效評價標準(RECIST)[5]。完全緩解(CR):靶病灶完全消失,淋巴結直徑縮小至10 mm 以下;部分緩解(PR):靶病灶三徑之和較基線值減少≥30%;疾病穩定(SD):靶病灶三徑之和較基線值減少<30%或增加<20%;疾病進展(PD):靶病灶三徑之和較基線值增加>20%,直徑增加≥5 mm 或出現至少1 個新病灶。計算客觀緩解率(ORR)=(CR+PR)/總例數×100%,疾病控制 率(DCR)=(CR+PR+SD)/總例數×100%。開始治療至PD 時間(無PD 者統計至末次隨訪時間)定義為無進展生存期(PFS);開始治療至死亡時間(存活者統計至末次隨訪時間)定義為總生存期(OS)。患者均接受門診復查、電話或微信形式隨訪直至確認疾病進展,隨訪截至2020年2月29日。
1.5 觀察化療期間副反應發生情況
根據美國國家癌癥研究所(NCI)制定的藥物毒性評價標準v4.0(CTCAE v4.0)[6]評價血液學毒性和非血液學毒性,分為0~Ⅳ5 級。
1.6 統計學方法
數據分析采用SPSS 22.0 統計學軟件。計數資料以構成比或率(%)表示,比較用χ2檢驗;計量資料以均數±標準差(±s)表示,比較用方差分析,進一步兩兩比較,采用LSD-t檢驗;生存時間比較采用Log rank χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 二線化療組與BSC組一般臨床資料比較
二線化療組和BSC 組患者的年齡比較,差異有統計學意義(P<0.05);兩組的性別、吸煙史、疾病分期、一線化療方案、一線化療后PFS、放療、確診時PS評分、復發間隔時間比較,差異無統計學意義(P>0.05)。見表1。
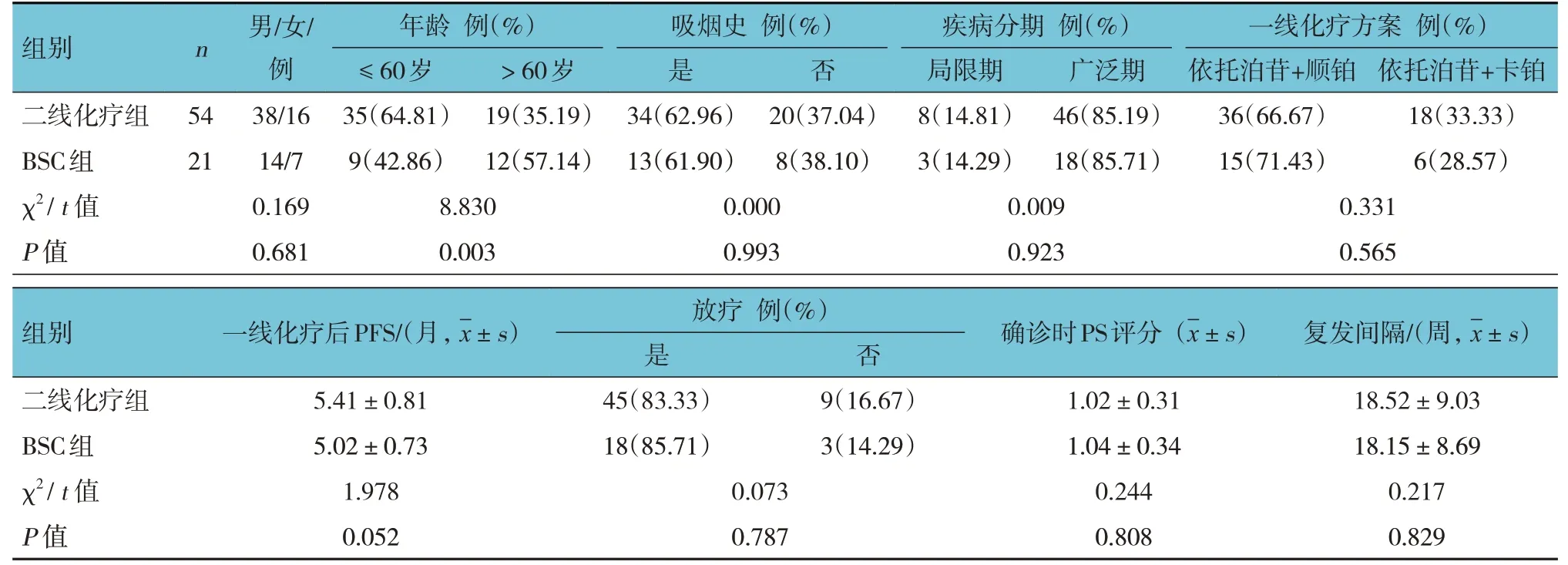
表1 二線化療組與BSC組一般臨床資料比較
2.2 3 組治療前后血清NSE、CEA、CYFRA21-1差值的比較
3 組治療前后血清NSE、CEA、CYFRA21-1 差值比較,差異有統計學意義(P<0.05),BSC 組治療后血清NSE、CEA、CYFRA21-1 水平較治療前略有升高,鹽酸伊立替康組和IP 組治療后血清NSE、CEA、CYFRA21-1 水平較治療前均下降;進一步兩兩比較,鹽酸伊立替康組和IP 組治療后血清NSE、CEA、CYFRA21-1 水平較BSC 組下降(P<0.05),而IP 組與鹽酸伊立替康組下降水平比較,差異無統計學意義(P>0.05)。見表2。
表2 3組治療前后血清NSE、CEA、CYFRA21-1差值的比較 (μg/L,±s)
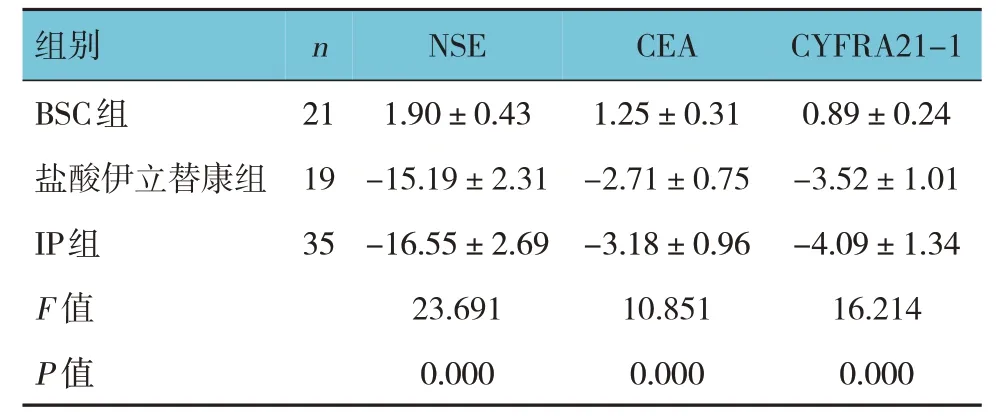
表2 3組治療前后血清NSE、CEA、CYFRA21-1差值的比較 (μg/L,±s)
組別n NSE CEA CYFRA21-1 BSC組鹽酸伊立替康組IP組F 值P 值21 19 35 1.90±0.43-15.19±2.31-16.55±2.69 23.691 0.000 1.25±0.31-2.71±0.75-3.18±0.96 10.851 0.000 0.89±0.24-3.52±1.01-4.09±1.34 16.214 0.000
2.3 二線化療組與BSC組的近期療效比較
二線化療組54 例患者完成二線治療及復查評效,BSC 組21 例患者完成復查評效。兩組的ORR、DCR 比較,差異有統計學意義(χ2=24.269 和39.633,均P=0.000),二線化療組均高于BSC 組。見表3。
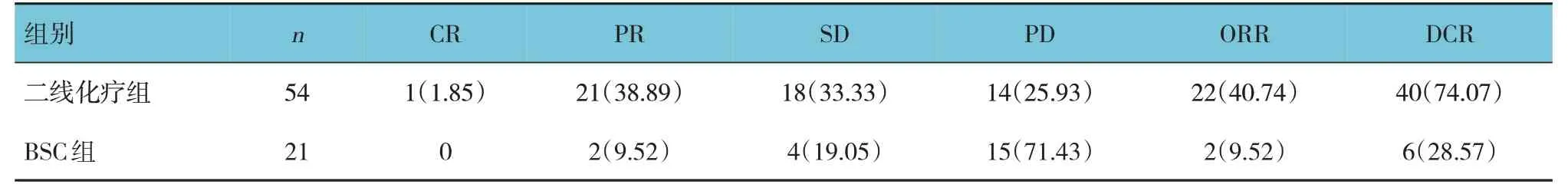
表3 二線化療組與BSC組的近期療效比較 例(%)
2.4 二線化療組與BSC組的生存期比較
最佳支持治療后BSC 組的中位PFS 時間為2.2 個月(95% CI:1.15,6.25),二線化療后二線化療組的中位PFS 時間為4.2 個月(95% CI:1.55,36.00)(1 例患者仍處于疾病緩解狀態,未達PFS),兩組比較,經Log rank χ2檢驗,二線化療組的PFS 長于BSC 組(χ2=21.257,P=0.000)。最佳支持治療后BSC組的中位OS 為6.0 個月(95% CI:4.55,8.54),二線化療后二線化療組的中位OS 為11.5 個月(95% CI:10.45,36.00),兩組比較,經Log rank χ2檢驗,二線化療組的OS 長于BSC 組(χ2=14.017,P=0.000)。
2.5 鹽酸伊立替康組與IP組近期療效比較
鹽酸伊立替康組與IP 組的ORR 和DCR 比較,差異均無統計學意義(χ2=0.526 和1.504,P=0.468 和0.222)。見表4。
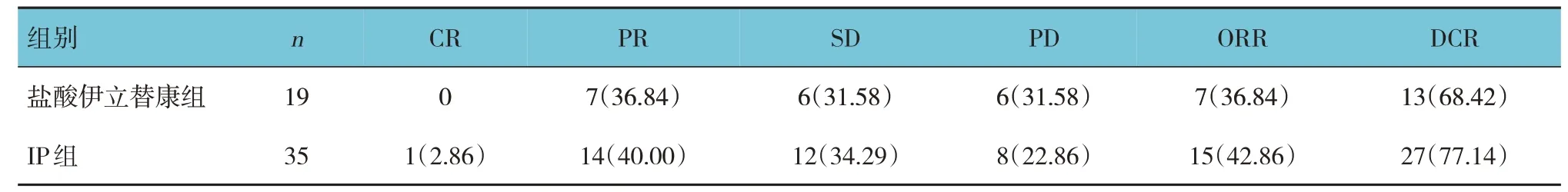
表4 鹽酸伊立替康組與IP組近期療效比較 例(%)
2.6 鹽酸伊立替康組與IP組生存期比較
鹽酸伊立替康組的中位PFS 為3.7 個月(95%CI:1.6,36.0),IP 組的中位PFS 為4.3 個月(95% CI:2.0,36.0),經Log rank χ2檢驗,差異無統計學意義(χ2=1.579,P=0.440);鹽酸伊立替康組的中位OS 為11.0 個月(95% CI:10.2,36.0),IP 組的中位OS 為12.2 個月(95% CI:10.8,36.0),經Log rank χ2檢驗,差異無統計學意義(χ2=1.634,P=0.412)。
2.7 鹽酸伊立替康組與IP組化療副反應比較
所有接受二線化療的患者均未發生化療相關性死亡,未見腎損傷及心電圖異常,化療副反應以骨髓抑制、惡心嘔吐、遲發型腹瀉及肝損傷為主。鹽酸伊立替康組骨髓抑制發生率低于IP 組(P<0.05),兩組其余副反應比較,差異無統計學意義(P>0.05)。見表5。
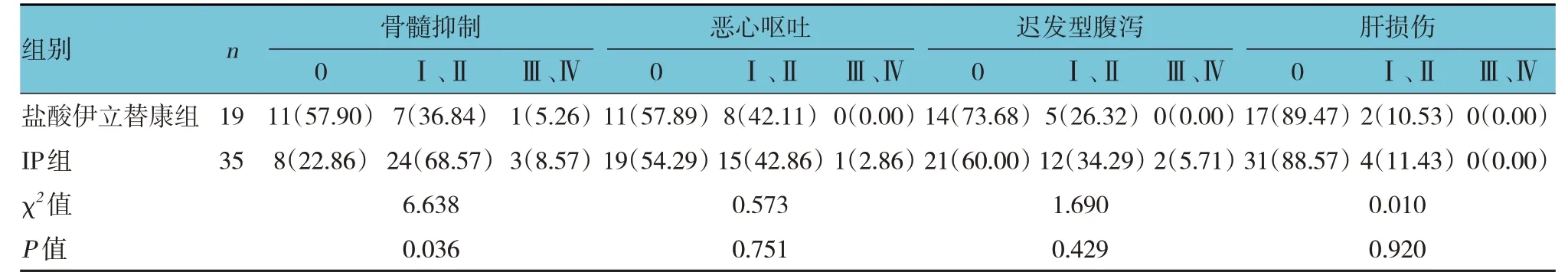
表5 鹽酸伊立替康組與IP組化療副反應比較 例(%)
3 討論
SCLC 具有特殊生物學性質,對化療藥物較為敏感,標準化療方案(依托泊苷+順鉑等)化療后近期緩解率較高,但極易復發,導致遠期生存獲益不理想。文獻報道,SCLC 經EP 方案治療后PFS 為4~7 個月,OS 為9~11 個月,尤其是廣泛期SCLC的5年生存率不足5%[7]。因此,SCLC 的二線治療成為臨床亟待解決的重要問題。通常認為,對于一線治療后3 個月以后復發的SCLC 可能從原治療方案中獲益,但對一線治療無反應或迅速復發的難治性SCLC 目前尚無標準二線治療方案[8]。2018年美國國家癌癥網絡(NCCN)更新了SCLC 的臨床實踐指南,推薦對復發SCLC 患者采用紫杉醇、多西他賽、鹽酸拓撲替康、鹽酸伊立替康等進行治療,但目前尚無充分證據推薦某種特定化療藥物或二線方案治療SCLC[9]。部分研究顯示,多西他賽、紫杉醇、鹽酸拓撲替康等二線治療SCLC 的中位PFS僅為3 個月左右,OS 約6~8 個月,且鹽酸拓撲替康在國內應用相對較少[10]。
鹽酸伊立替康具有強效抗瘤活性,已有研究表明其單用或與鉑類藥物聯用治療SCLC 具有肯定療效,且副反應能夠耐受,國內多用于二線化療[11]。本研究比較了BSC 與二線化療患者的預后,結果顯示,經一線治療失敗的SCLC 患者,接受二線化療具有更明顯的生存獲益,無論是ORR、DCR還是中位PFS、OS,二線化療組均較BSC 組表現出明顯優勢。認為對一線治療失敗的SCLC,在能夠耐受的情況下,仍推薦二線化療方案治療,能夠為患者帶來更好的生存獲益,這與既往研究[12]結論相似。對于接受二線化療的患者,本文分析其近遠期預后顯示,總ORR 和DCR 分別為40.74%、74.07%,與既往報道的10.7%~73.0%相符[4,13],且低于一線化療。進一步比較鹽酸伊立替康單藥及鹽酸伊立替康聯用鉑類藥物化療效果顯示,IP 組的ORR、DCR 分別達42.86%、77.14%,均高于鹽酸伊立替康組的36.84%、68.42%,但差異并無統計學意義。同時,IP 組的中位PFS 和OS 分別為4.3 個月、12.2 個月,雖較鹽酸伊立替康組的3.7 個月、11.0 個月有所延長,但差異仍無統計學意義。推測不同二線化療方案對SCLC 近期預后及生存獲益的差異可能并不大。李治樺等[14]發現,對一線治療失敗的SCLC 患者而言,二線化療的生存獲益優于BSC,但不同化療方案之間的近期緩解率及PFS 差異并不大,這與本研究結論相符。
NSE 屬于糖酵解酶,多分布于神經元及神經細胞中,與神經損傷有關,近年研究顯示其與惡性腫瘤的發生、發展密切相關[15]。SCLC 作為一種神經內分泌腫瘤,具有較高的惡性程度,且存在神經內分細胞特性,故其血清NSE 表達往往高于其他類型的肺癌[16]。CEA 是一種廣譜腫瘤標志物,在SCLC 及NSCLC 均呈明顯高表達[17]。CYFRA21-1 是上皮細胞形成中重要的結構蛋白,多分布于正常層狀組織或鱗狀上皮組織表面,當這類組織發生惡性病變及細胞凋亡情況下,可大量釋放并以溶解片段的形式進入血液循環,故肺癌患者常表現為CYFRA21-1 過表達[18]。 謝冰峰等[19]研究顯示,肺癌患者血清CYFRA21-1 高表達,且與疾病分期呈正相關,化療后可獲得不同程度的下降,CYFRA21-1 可作為病情評估及預后預測的重要參考指標。高洋等[20]發現肺癌患者血清NSE、CEA 及CYFRA21-1 水平均呈高表達,且與病理類型、臨床分期、臨床療效密切相關。本研究中,BSC 組治療后血清NSE、CEA 及CYFRA21-1 水平變化不大甚至有升高趨勢,而接受二線化療的患者血清NSE、CEA 及CYFRA21-1均有不同程度的下降,進一步證實了一線治療失敗的SCLC 患者能夠從二線化療中獲益。IP 組治療前后血清NSE、CEA 及CYFRA21-1 的差值與鹽酸伊立替康組比較,差異無統計學意義,推測是否聯用鉑類藥物對二線治療SCLC 的效果影響不大,也可能與本研究樣本量較小所致偏差有關,需進一步大樣本研究證實。
副反應是化療管理中的重要觀察指標,與其他化療藥物一樣,鹽酸伊立替康的主要毒副反應為血液毒性、惡心嘔吐等。本研究中,二線化療患者的骨髓抑制普遍以Ⅰ、Ⅱ度為主,患者耐受性良好。鹽酸伊立替康組的骨髓抑制率低于IP 組,但兩組Ⅲ、Ⅳ度發生率均較低。兩組惡心嘔吐Ⅲ、Ⅳ度發生率較低,普遍程度較輕,患者耐受性良好,且IP組與鹽酸伊立替康組比較差異無統計學意義。丁朝霞等[21]研究顯示,鹽酸伊立替康聯合洛鉑二線治療老年SCLC 較鹽酸拓撲替康聯合洛鉑具有更少、更輕的血液毒性。腹瀉是鹽酸伊立替康的主要副反應,早發型腹瀉多為一過性反應,可通過應用阿托品有效防治;遲發型腹瀉則多在用藥5~8 d 左右出現,但也可通過使用洛哌丁胺等控制,其發生機制考慮為鹽酸伊立替康的代謝產物SN-38 具有一定的腸結構及功能損傷風險[22]。本研究中,遲發型腹瀉發生率以Ⅰ、Ⅱ度為主。其中,IP 組遲發型腹瀉發生率為40.00%,Ⅲ、Ⅳ度發生率為5.71%,雖較鹽酸伊立替康組升高,但差異無統計學意義,且可使用洛哌丁胺、補液得以緩解。本研究肝損傷發生率較低,未見其他臟器組織功能受損,患者的耐受性良好。
綜上所述,對一線標準方案化療失敗的SCLC患者采用鹽酸伊立替康治療具有良好的疾病控制效果,可下調血清NSE、CEA 及CYFRA21-1 水平,延長PFS,且與鉑類藥物聯用的效果略優于單藥治療,但可能增加不良反應發生風險,建議對一般狀況良好且耐受性較好的患者采取鹽酸伊立替康聯合鉑類藥物二線化療。但本研究樣本較小且隨訪時間較短,缺乏與其他二線化療方案的對照研究,還有待進一步深入研究加以完善。

