蘋果屬PP2C A亞家族基因的克隆及生信分析
許 璇,何鈺賢,姚允聰,盧艷芬
(北京農學院 植物科學技術學院/農業應用新技術北京重點實驗室,北京102206)
脫落酸(ABA)是一種重要的植物激素,已被證明參與植物響應環境脅迫及多種生長發育過程[1],ABA信號通路是植物特有的激素信號途徑[2]。依賴于Mg2+/Mn2+的Ser/Thr蛋白磷酸酶2C(Group A-PP2C)是植物細胞內ABA信號網絡的核心調控因子,其介導的ABA-PYR/PYL/RCAR-PP2Cs-SnRKs ABA信號感知與轉導通路已成為ABA信號轉導領域的重大突破之一。PP2C介導的蛋白質可逆磷酸化是植物體內調控細胞信號轉導的重要方式[3],隨著PYR1/PYLs/RCAR1 被鑒定為ABA受體[4],人們對ABA信號轉導途徑的分子機制有了更深入的了解。ABA通過調節PP2C 活性來調控細胞代謝,ABA受體結合PP2C并抑制PP2C的磷酸化活性,從而激活SnRK2s。SnRK2s進一步磷酸化并激活下游ABA依賴型轉錄因子AREB/ABF[5]。
PP2C對ABA信號的響應已成為一個研究熱點,其中A亞家族PP2C更是ABA信號轉導過程中的關鍵負調控因子[6]。在保衛細胞的細胞核中,A亞家族PP2C會抑制SnRK2激酶活性,進而抑制響應ABA信號的轉錄因子表達。而在脅迫條件下,A亞家族PP2C與ABA受體結合捕獲ABA信號,激活SnRK2及下游基因表達[7]。在擬南芥中已鑒定出9種PP2C A亞家族基因[8],并發現ABA受體PYL5介導的A亞家族PP2C活性的抑制,可以增強植物的抗旱性[9]。在玉米[10]、鳶尾[11]等植物中也表現出相似的結果。
平邑甜茶是優秀的蘋果砧木資源,為蘋果屬湖北海棠(MalushupehensisRehd.)的一個類型,因其無融合生殖的特殊生殖方式,使砧木具有很高的整齊度,具有適應性強、耐高溫潮濕、嫁接親和力強和單株產量高等諸多優良特性[12,被廣泛應用于農業生產和基礎科學研究。但是該砧木PP2C基因家族在ABA信號轉導中的作用尚不明確。本研究以蘋果砧木‘平邑甜茶’作為試驗材料,尋找其中的重要PP2C基因。為今后探究‘平邑甜茶’中脫落酸信號轉導的分子機制提供理論基礎。
1 材料與方法
1.1 試驗材料
蘋果砧木品種‘平邑甜茶’為北京農學院組培中心保存的組培苗,培養于MS培養基(蔗糖:30 g/L、MS粉:4.43 g/L、6-BA:1 mg/L、IBA:0.2 mg/L、pH:5.85~5.90)中,培養溫度為23 ℃±2 ℃,相對濕度保持在60%~70%,光照強度為1 800~2 000 lx,光照時間為16 h/d。
1.2 試驗方法
1.2.1 ‘平邑甜茶’總RNA提取和cDNA反轉錄 ‘平邑甜茶’組培苗總RNA提取方法參照EASY spin Plus多糖多酚/復雜植物RNA快速提取試劑盒(北京艾德萊生物科技有限公司)。通過1%瓊脂糖凝膠電泳檢測所得總RNA質量,并用紫外分光光度計檢測總RNA濃度。總RNA提取后,利用cDNA合成試劑盒(寶日醫生物技術(北京)有限公司)反轉錄合成cDNA。
1.2.2 ‘平邑甜茶’PP2C A亞家族基因克隆 根據NCBI發布的擬南芥PP2C A亞家族基因的4個基因AtABI1(AT4G26080)、AtABI2(AT5G57050)、AtHAB1(AT1G72770)和AtHAB2(AT1G17550),利用薔薇科基因組數據庫GDR查找蘋果同源基因,用Basic Local Alignment Search Tool下載完整CDS區序列,并通過Primer 5設計引物,序列見表1。以反轉錄得到的‘平邑甜茶’cDNA為模板,使用2×Phanta Max Master Mix(Dye Plus)高保真酶(南京諾唯贊生物科技股份有限公司)進行基因克隆,反應體系為50 μL,包含:cDNA模板2 μL;高保真酶Mix 25 μL;上、下游引物(10 μmol/L)各2 μL;ddH2O 19 μL,反應程序為:95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 1 min,35個循環;72 ℃ 延伸5 min;4 ℃保溫。利用FastPure Gel DNA Extraction Mini Kit膠回收/DNA純化試劑盒(南京諾唯贊生物科技股份有限公司)進行PCR產物回收,連接于pEASY-Blunt Cloning Vector(北京全式金生物技術有限公司)后轉化大腸桿菌DH5α感受態(上海唯地生物技術有限公司),挑菌,進行菌液PCR鑒定后,選取陽性克隆進行測序。

表1 引物序列Tab.1 Primer sequences
1.2.3 ‘平邑甜茶’PP2Cs A亞家族基因的生物信息學分析 通過DNAMAN進行多序列比對;MEME進行蛋白質基序分析;利用Cell-PLoc 2.0在線網站預測PP2C A的亞細胞定位;ExPASy ProtParam在線工具分析蛋白質理化性質;TMHMM與SignalP 4.0在線網站分析蛋白質是否存在跨膜結構和信號肽;NPS的SOPMA 工具用于蛋白質二級結構預測;SWISS-MODEL用于預測三級結構并通過NCBI Conserved Domain Search Service在線分析工具分析其蛋白質的保守功能結構域。通過MAGE 7.0軟件構建系統進化樹。
1.2.4 脫落酸處理下MhPP2Cs基因的表達分析 選擇正常生長至3葉期的‘平邑甜茶’組培苗進行脫落酸處理。在正常的‘平邑甜茶’MS培養基中加入100 μM/L的脫落酸進行處理后取樣,根據上文方法提取總RNA后反轉錄為cDNA。利用CFX96TM Real Time RCR System進行實時熒光定量PCR,引物序列見表1,反應體系為20 μL,包含:cDNA模板2 μL ;2×SYBR Green Pro Taq HS Premix 10 μL(湖南艾科瑞生物工程有限公司);上、下游引物(10 μmol/L)各1 μL;ddH2O 6 μL,反應程序為:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30s,40個循環。設置3次重復,使用2Δ-11Ct分析方法計算表達量差異。
2 結果與分析
2.1 ‘平邑甜茶’PP2C A亞家族基因克隆
以質量檢測合格的‘平邑甜茶’葉片總RNA為模板反轉錄得到cDNA,克隆‘平邑甜茶’中的3個PP2C A亞家族基因的CDS序列(圖1)。將這3個產物連接于pEASY-Blunt Cloning Vector后進行測序分析。
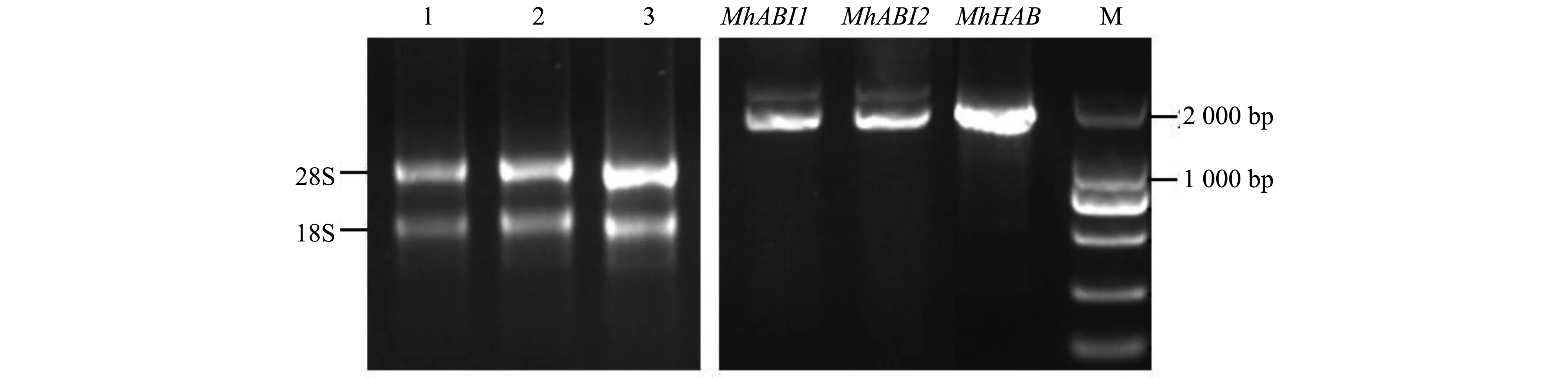
圖1 ‘平邑甜茶’PP2C A亞家族基因擴增Fig.1 The cloning of group A-PP2C genes of ‘Malus hupehensis Rehd.’
2.2 亞家族基因的理化性質分析
通過在線分析網站對這3個基因編碼的蛋白質進行分析,MhABI、MhABI2和MhHAB分別是編碼552、552、544個氨基酸的蛋白;其預測表觀分子量為58.26(MhHAB)~59.44(MhABI2) kDa;等電點為4.52(MhABI2)~5.03(MhHAB),均為偏酸性蛋白;除MhABI1不穩定系數小于40,屬于穩定蛋白外,其余均為不穩定蛋白;脂肪系數為86.87(MhABI2)~93.49(MhHAB);均屬于親水性蛋白;MhABI1僅定位于細胞核,MhABI2同時定位于細胞核及葉綠體,MhHAB定位于葉綠體(表2)。

表2 ‘平邑甜茶’PP2C A亞家族蛋白生物信息學分析Tab.2 Analysis of physicochemical properties of Group A-PP2C proteins in ‘Malus hupehensis Rehd.’
利用CLUSTALW在線多序列分析工具對這3個基因編碼蛋白的氨基酸序列進行同源性分析,發現其同源性為76.66%,且在第225至550個氨基酸間存在較高的相似性(圖2)。進一步利用NCBI Conserved Domain Search Service在線分析工具分析這3個氨基酸的結構域,發現其高同源性區域集中在PP2C 超家族保守功能結構域處。

圖2 ‘平邑甜茶’PP2C A亞家族各氨基酸序列同源性分析Fig.2 Homology analysis of the amino acid sequences of Group A-PP2Cs in‘Malus hupehensis Rehd.’
通過TMHMM與SignalP4.0在線網站預測這3個蛋白質結構發現其氨基酸序列中均不含有跨膜區及信號肽序列。再通過NPS SOPMA 工具預測各蛋白質的二級結構,發現MhABI1結構中含有α-螺旋 30.43%、β-折疊 18.48% 和無規則卷曲 46.92%;蛋白質MhABI2結構中含有α-螺旋 30.07%、β-折疊 19.75%和無規則卷曲 46.01%;蛋白質MhHAB結構中含有α-螺旋 31.62%、β-折疊 14.89%、無規則卷曲 50.18%和β-轉角 3.31%。進一步利用SWISS-MODEL預測其三級結構,對3個PP2C A亞家族各蛋白質進行同源建模,發現其預測結果與二級結構預測結果基本一致,且同源建模一致度大于30%(圖3)。
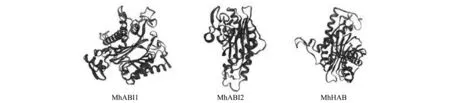
圖3 ‘平邑甜茶’PP2C A亞家族蛋白三級結構Fig.3 The three-level structure prediction analysis of Group A-PP2C proteins in ‘Malus hupehensis Rehd.’
2.3 系統進化分析
由系統發育樹(圖4)發現MhABI1與MhABI2蛋白親緣關系很近,包括MhHAB蛋白在內,三者與白梨的PP2C蛋白的一致性最高,其次與梅、扁桃和月季等植物中的PP2C蛋白也具有很高的一致性。同時分析保守功能域,MEME在線分析工具預測15個蛋白質的基序(motif),設置基序最大發現數為5,長度6~150個氨基酸進行分析。分析得到的5個motif,與已鑒定擬南芥PP2C A亞家族蛋白結果相似,分布于PP2C 超家族保守功能結構域處,其中motif 1~5含有41~142個氨基酸(圖4)。
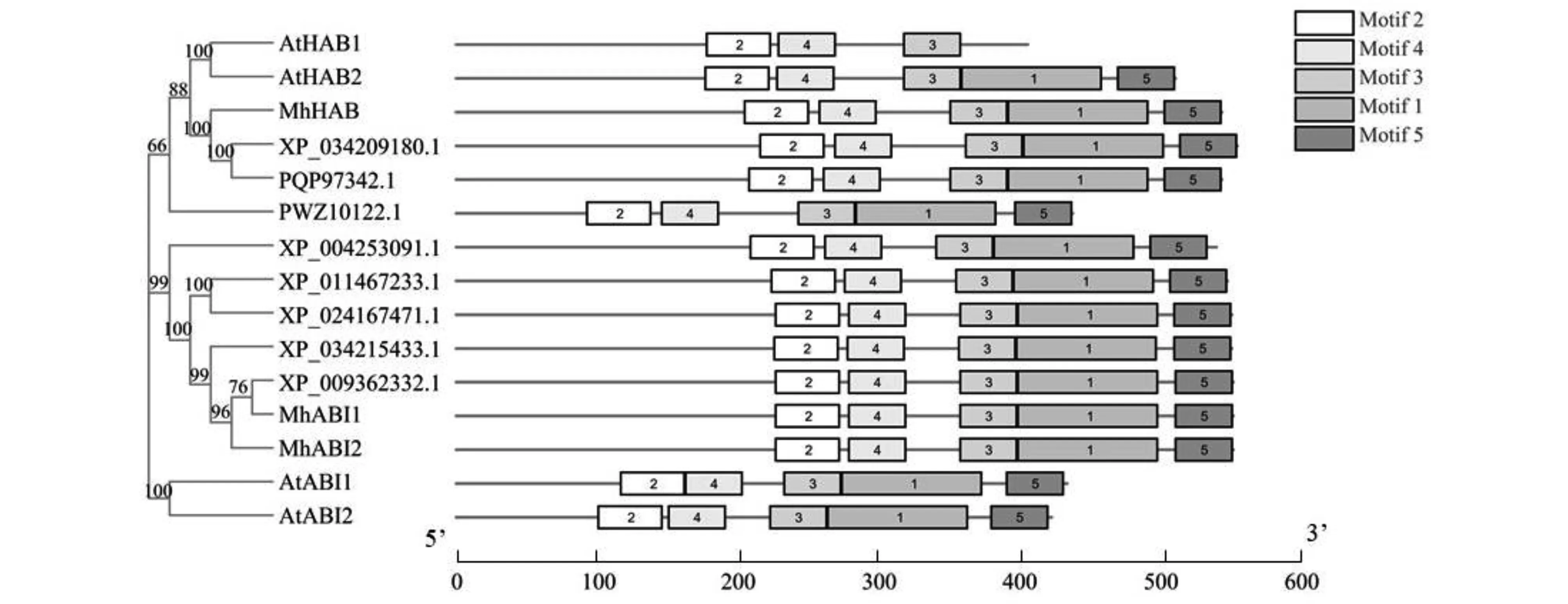
圖4 ‘平邑甜茶’PP2C A亞家族蛋白的系統進化樹分析Fig.4 Phylogenetic analysis of Group A-PP2C proteins in ‘Malus hupehensis Rehd.’
2.4 脫落酸處理下MhPP2Cs基因表達分析
實時熒光定量PCR結果顯示,在脫落酸處理下,3個MhPP2Cs基因的表達量均顯著升高,證明MhABI1、MhABI2、MhHAB在ABA信號轉導過程中發揮重要作用(圖5)。

圖5 ABA處理下PP2C A亞家族基因表達分析Fig.5 Expression analysis of MhPP2Cs under ABA treatment
3 討 論
蛋白磷酸酶2C是重要的蛋白磷酸酶之一,在細胞周期、代謝、蛋白泛素化降解等過程中發揮作用[13]。在植物中,PP2Cs是ABA的共受體,參與ABA信號轉導機制,對植物生長發育、脅迫響應都有著重要意義[14]。蘋果屬植物因其生長特性,易受干旱、冷害等非生物脅迫的影響,造成果實產量降低、品質下降,且由于成年植株高大,不易管理,進一步影響了其經濟效益,對蘋果進行矮化砧木嫁接,已成為目前主流的栽培方式。‘平邑甜茶’為作為目前廣泛應用的蘋果砧木,具有整齊度好、實生苗變異小的優良特性[15]。
本研究以蘋果砧木‘平邑甜茶’為試材,通過與擬南芥的PP2C A亞家族基因進行同源性分析,從組培苗植株葉片cDNA中分離得到3個PP2C A亞家族基因。這3種蛋白均含有PP2C 超家族保守功能結構域,證明其均屬于蛋白磷酸酶PP2C,推測其可能參與ABA信號轉導并進一步調節植株響應干旱脅迫。但通過理化性質分析可以看出,3種PP2C A亞家族蛋白之間存在一定差異,表明其發揮的生物學功能應該不盡相同。通過分析發現3種基因編碼的蛋白質均不含跨膜區及信號肽序列,而亞細胞定位結果表明MhABI1定位于細胞核、MhABI2定位于細胞核和細胞核,而MhHAB定位于葉綠體,推測它們可能通過調節細胞核基因表達或者葉綠體功能來發揮作用。同時,脫落酸處理后的基因表達量分析證實了MhABI1、MhABI2、MhHAB這三個基因在ABA信號轉導途徑中發揮作用。
目前,已有大量報道在擬南芥、煙草和水稻等模式植物中證明蛋白磷酸酶PP2C是ABA信號通路中的重要組成部分[16]。ABA信號轉導遵循“抑制解除”的傳導機制,當沒有ABA存在時,PP2C會結合下游激酶OST1(SnRK2.6)并抑制其活性,阻止響應ABA信號的相關基因的表達;當ABA存在時,ABA會與其受體PYR/ PYL/ RCAR (PYLs) 結合,形成復合物,該復合物進一步與共受體PP2C結合[17],這種互作會暴露PP2C的泛素化位點,使其被降解[18],達成“抑制解除”目的,激活下游基因的表達,幫助植物應對干旱和冷害等非生物脅迫。盡管對PP2C的研究在模式植物中已取得重大進展,但類似研究在蘋果屬植物中仍然較少。本研究克隆并分析蘋果屬植物PP2C A亞家族基因,并對其編碼的蛋白質進行理化性質分析、結構預測及進化樹構建,通過脫落酸處理下的PP2C A亞家族基因表達量,證實在ABA信號轉導中發揮重要作用,可能參與蘋果砧木‘平邑甜茶’響應非生物脅迫過程,闡述了蘋果屬植物PP2C A亞家族成員的分子特性,有助于深入研究蘋果砧木ABA信號轉導途徑的分子作用機制,為進一步培育抗性砧木提供理論參考。

