含烏梅方劑數據挖掘及烏梅-人參治療糖尿病的網絡藥理學分析*
魏稚力,張小波,高蕊,簡勝男,馬曉菊,文躍強,周昕,沈濤
成都中醫藥大學基礎醫學院 四川成都 610072
糖尿病(Diabetes Mellitus, DM)作為全球性公共衛生問題,嚴重危害人類健康。據2017年相關報道,目前全球共有4.25億成人DM患者,而我國這一數字高達1.14億,居世界首位[1]。現降糖藥種類繁多,因其各自臨床特點與不良反應,尋求更加安全有效的治療藥物一直是該疾病的研究熱點[2]。DM屬中醫“消渴”范疇,但二者并不能等同[3]。相較于現代DM以血糖升高為主要診斷依據,消渴則以多飲、多食、多尿、消瘦等“三多一少”癥狀為典型表現[4]。消渴雖不等同于現代DM,但對于DM的治療亦可從“消渴”相關中醫治療獲益。大量研究顯示,中醫藥治療可發揮降低患病風險、降低血糖,改善胰島素抵抗、提高胰島素敏感性、改善DM癥狀及其并發癥損傷等多種治療作用[4-8]。鑒于此,基于中醫藥資源挖掘治療DM的有效藥物組合具有積極研究意義。
有關烏梅功效應用,《本經》[9]云:“下氣,除熱煩滿,安心,肢體痛,偏枯不仁,死肌,去青黑志、惡疾。”《景岳全書》載其:“止消渴……消癰疽瘡毒”[10]。2015年版《中國藥典》[11]載其用于:“虛熱消渴”。現代化學藥理研究報道,烏梅中有機酸成分——蘋果酸、枸櫞酸可降低正常小鼠血糖水平,烏梅果肉中三萜類成分——熊果酸、齊墩果酸具有降血糖作用[12,13]。臨床研究報道,烏梅丸可降低2型DM患者血糖水平[14]。除臨床藥用外,烏梅作為一種藥食同源性資源,亦被廣泛運用于大眾生活當中,如用于各類烏梅飲品及凉果蜜餞的制作等。鑒于烏梅藥用價值及開發應用前景,本研究對《中醫方劑大辭典》中含烏梅方劑進行收集整理,并運用TCMISS進行數據挖掘分析。在此基礎上,選取烏梅-人參核心藥對,并運用網絡藥理學方法進一步探討該藥對治療DM的潛在作用機制,以期為烏梅的臨床運用及后續研究提供更多參考。
資料與方法
1 方劑來源
以“烏梅”為檢索關鍵詞(“烏梅肉”“大烏梅”“烏梅炭”等均作為藥物烏梅納入檢索結果)對《中醫方劑大辭典》[15]中含烏梅方劑進行篩取。
2 數據規范
主要涉及中藥因產地、別名、炮制加工、入藥部位等情況進行藥名規范處理,主要參照2015年版《中國藥典》[11]及《中藥別名大辭典》[16]對所篩方劑進行藥名規范。
3 中醫傳承輔助系統分析
3.1 數據錄入 通過TCMISS“平臺管理”模塊的“方劑管理”功能,將方名、方源、組成、主治疾病等信息錄入系統建立數據庫,并由雙人進行數據核對與校正。
3.2 統計與關聯規則分析 運用TCMISS“數據分析”模塊之“方劑分析”、“數據查詢”等功能,輔以Excel數據表格,對查詢出的目標方劑進行相關統計與關聯規則分析。
4 網絡藥理學分析
4.1 有效成分的收集 借助TCMSP檢索烏梅和人參中的化學成分。一般認為藥物動力學(ADME)性質中口服生物利用度(OB)和類藥性(DL)具有重要意義,滿足OB≥30%和DL≥0.18的化合物通常被認為是潛在的活性成分,故以此為標準進行活性成分的篩選。同時,在TCMSP上下載符合條件成分的分子結構,保存為MOL2格式。4.2 成分潛在靶點預測及疾病靶點獲取 將前一步獲得的成分結構導入Swiss Target Prediction數據庫以獲得各成分的作用靶點,并對獲取的靶點進行合并、去重。在Genecards數據庫中以“Diabetes mellitus”為關鍵詞檢索DM的相關治療靶點,保留相關性得分大于20的靶點。之后將獲得的成分靶點與疾病靶點進行取交集。
4.3 PPI網絡構建 將Swiss Target Prediction數據庫獲得的靶點導入 STRING 網絡平臺,蛋白種類定義為“人”,置信度>0.7設為篩選條件進行篩選,獲得蛋白互作關系,下載TSV格式文件。將TSV文件信息導入Cytoscape3.7.1中,并運用其插件“Network Analyze”分析網絡拓撲參數,以節點度值、介數均超過平均值為標準篩選出核心靶點。
4.4 GO富集分析與KEGG通路富集分析 利用R軟件的Bioconductor數據包對PPI中所涉及的核心調控基因進行GO富集分析與KEGG通路富集分析,并畫出富集分析的氣泡及柱狀圖。
結 果
1 統計與關聯規則分析
本研究共篩取整理出《中醫方劑大辭典》含烏梅方劑1373首,涉及中藥663味。其中用藥頻次前20位的藥物,見表1,可見除甘草外,烏梅最常與人參聯用。根據《中藥學》[17]藥物分類標準,對常與烏梅聯用的前100位藥物進行分類統計,見表2,提示烏梅常與補虛藥、清熱藥、解表藥、理氣藥、溫里藥、化痰止咳平喘藥等聯用。基于關聯規則Apriori算法,分析48首含烏梅治療消渴方劑的用藥規則,得到支持度≥0.29,置信度為1的含烏梅治療消渴的強關聯規則藥對組合(核心藥對),見表3。篩得含烏梅-人參主治消渴的歷代方劑11首,見表4。
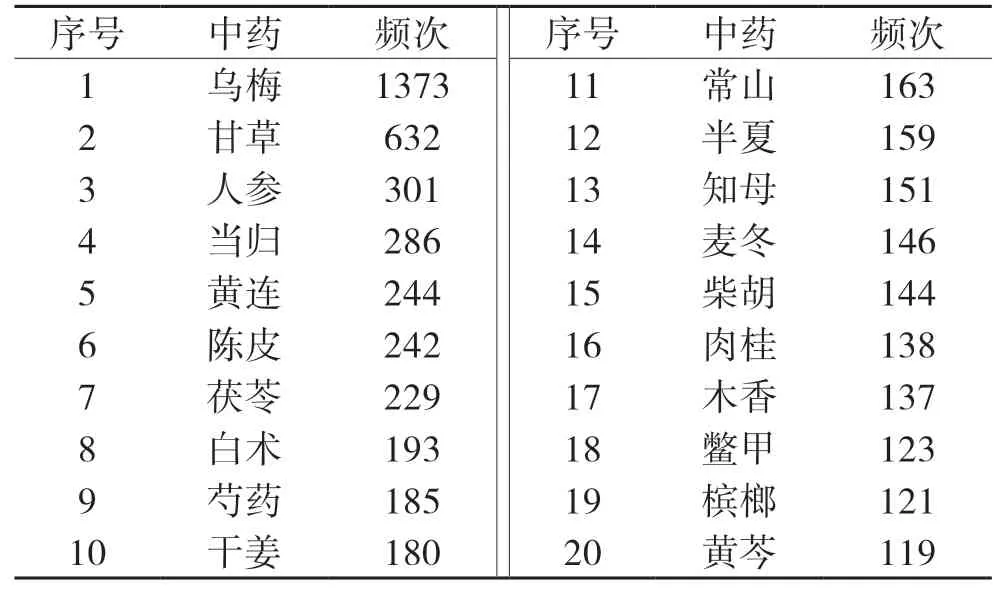
表1 含烏梅方劑前20位常用藥物(頻次≥119)
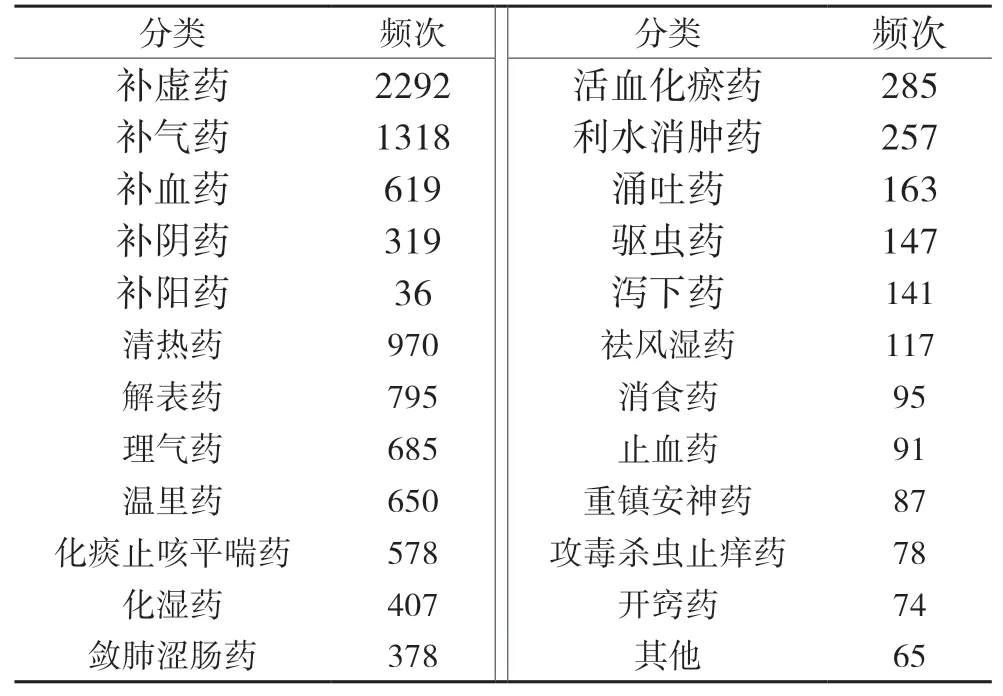
表2 常與烏梅聯用的前100位藥物的分類情況

表3 含烏梅治療消渴的強關聯規則藥對組合(核心藥對)
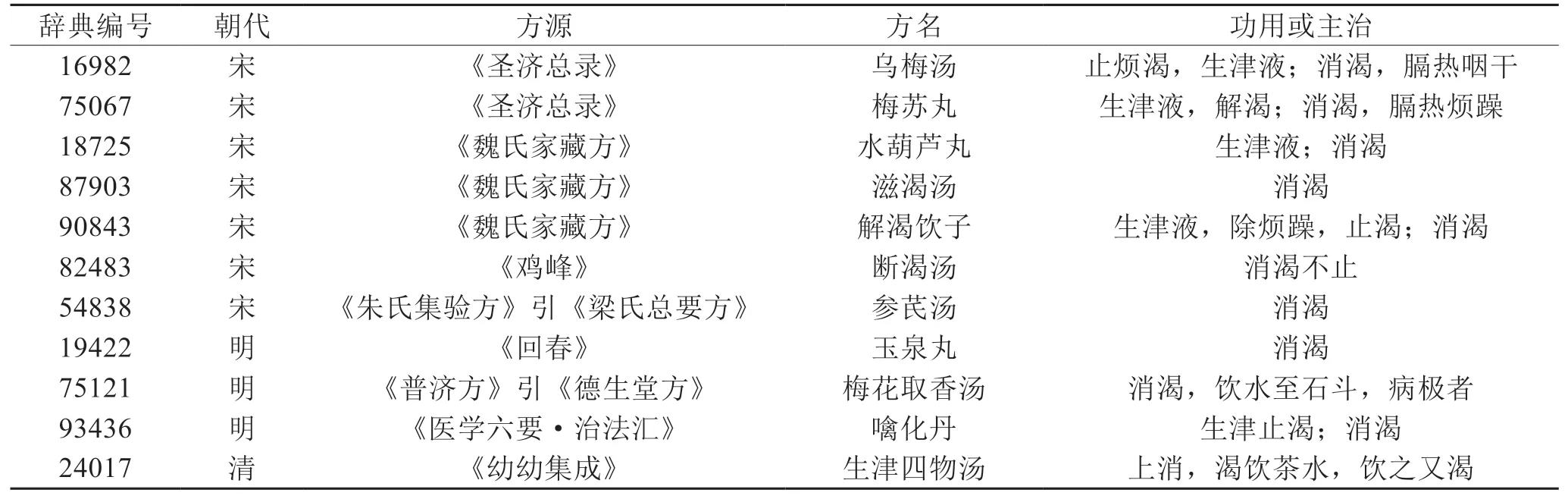
表4 含烏梅-人參主治消渴方劑
2 烏梅-人參藥對治療DM的網絡藥理學分析
2.1 烏梅、人參活性成分 基于TCMSP共獲得27個成分,得到烏梅活性成分8個,人參活性成分22個,其中Stigmasterol、beta-sitosterol和kaempferol為二者共有成分,見表5。
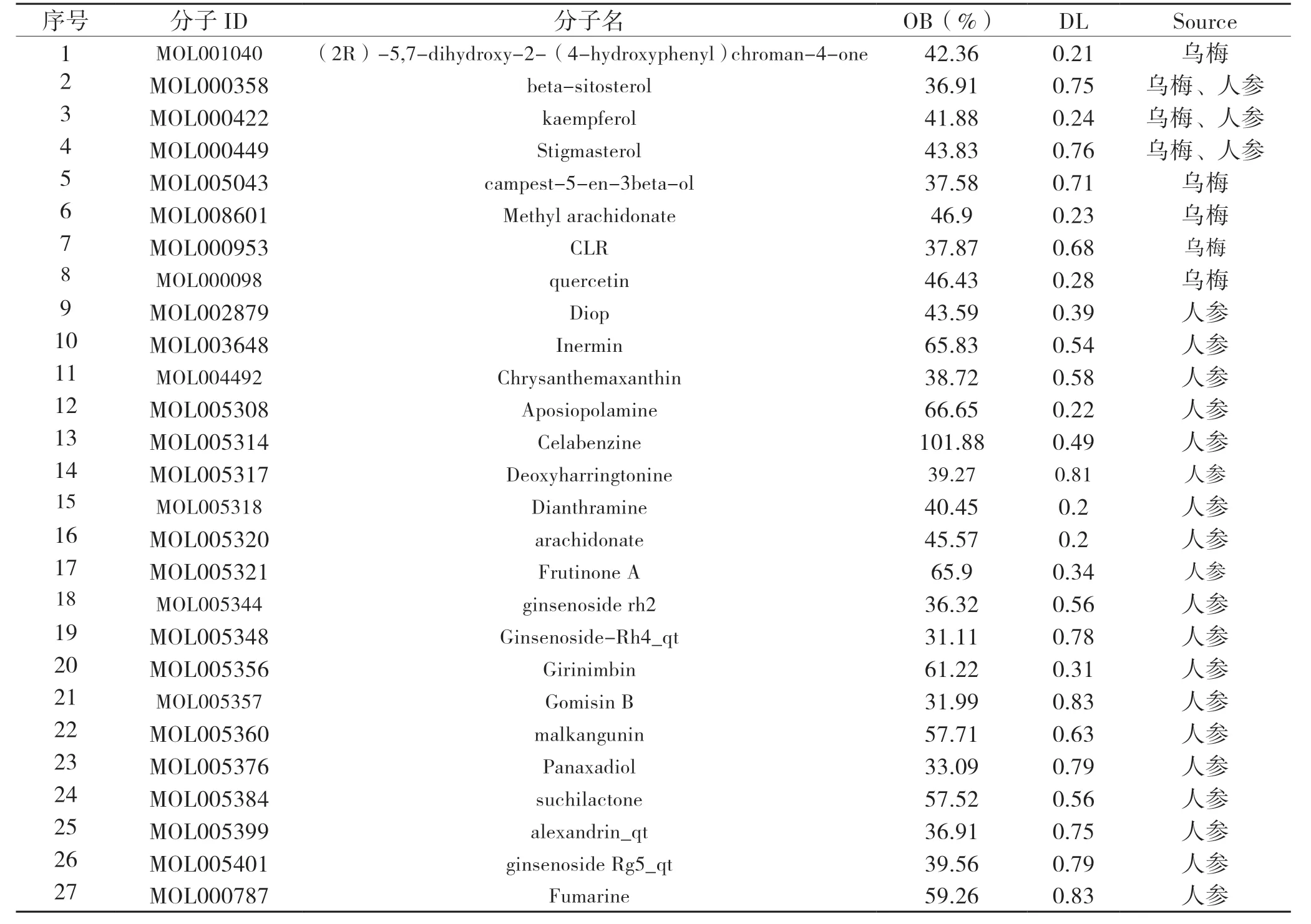
表5 烏梅-人參活性成分基本信息
2.2 成分潛在靶點 通過Swiss Target Prediction預測并提出重復目標后,共得到627個烏梅、人參的治療靶點。Genecards數據庫分析得到DM相關靶點301個。將成分靶點與疾病靶點進行取交集后共得到52個共同靶點,見圖1。

圖1 烏梅-人參疾病-成分靶點韋恩圖
2.3 PPI分析 在PPI網絡中,具有較高“度”值的節點通常認為是關鍵靶標蛋白。如圖2所示,AKT1(21)、TNF(20)、VEGFA(20)、MAPK1(18)、STAT3(18)、TP53(18)、MAPK8(16)、PIK3CA(15)具 有 較 高的度值,在網絡調控中起關鍵作用,其很可能是烏梅-人參藥對治療DM的關鍵靶標蛋白。
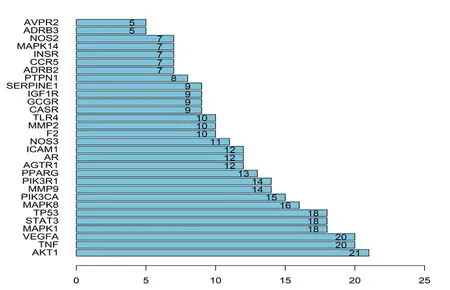
圖2 關鍵靶標蛋白信息條形圖
2.4 GO富集分析和KEGG通路富集分析 GO富集分析描述了一系列復雜的事件,這些事件是由一個或多個層次通過組織良好的協同作用來完成的。如圖3所示,展示了前20條GO途徑,主要集中在激素結合、類固醇激素受體活性、胰島素受體底物結合、核受體活性、胰島素樣生長因子受體結合、胰島素受體結合等方面。KEGG前20條途徑主要集中在DM并發癥中的AGE-RAGE信號通路、HIF-1信號通路、胰島素抵抗、內分泌抵抗、VEGF信號通路、II型糖尿病、TNF信號通路、Rap1信號通路等通路上,見圖4。
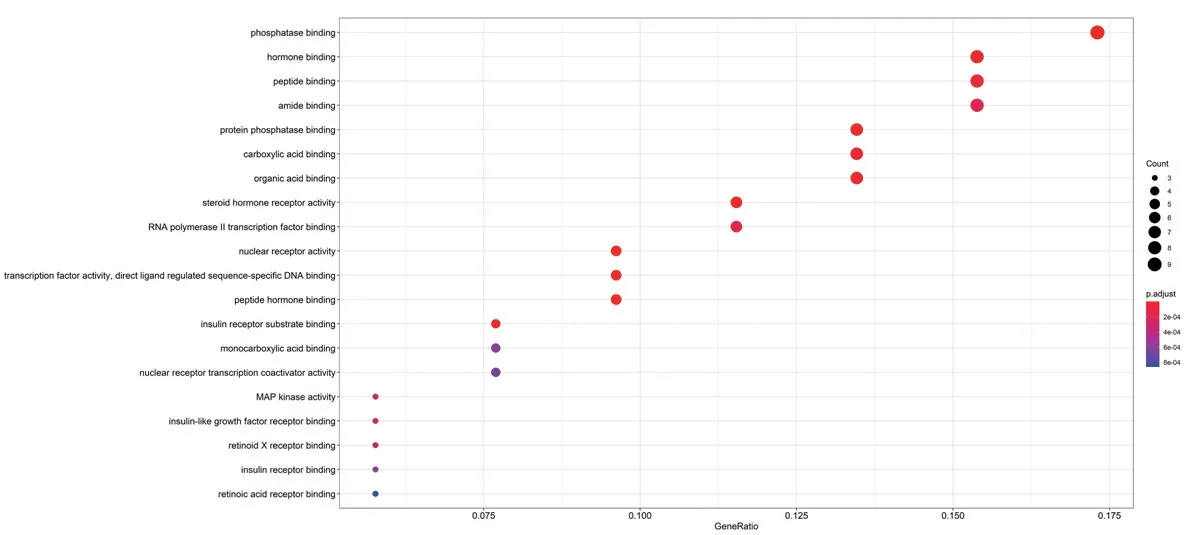
圖3 前20條GO富集途徑

圖4 前20條KEGG通路富集途徑
討 論
中醫藥防治DM多從“消渴”論之。消渴傳統病機以“陰虛燥熱”為主論,治以滋陰清熱,并分消論治[18]。但氣與津液關系密切,津液之生成、輸布、排泄,有賴于氣的推動、固攝及升降出入運動,而氣亦離不開津液之滋潤與運載[19]。《神農本草經疏》[20]云:“消渴者,津液不足之候也,氣回則津液生,津液生則渴自止矣。”隨著現代醫家對DM臨床實踐與認識的不斷深入,對于DM中醫核心病機的概括亦出現了新的認識。沈紹功教授對538例2型DM患者進行辨證調研,發現氣陰兩虛證高達77.51%,明顯高于傳統陰虛燥熱證,之后進一步提出轉變對2型DM “陰虛燥熱”病機的一般認識,并以“氣陰兩虛側重氣虛”為消渴之病機關鍵[21]。張延群等收集2080例DM患者臨床資料,統計顯示氣虛證頻率達88.75%,居首位,高于陰虛證的64.09%[22]。謝春光教授提出“氣陰兩虛”為現代DM發生發展的核心病機,并以益氣養陰為治療原則,自擬方“參芪復方”獲得良好臨床療效[23]。可見“益氣養陰”對于現代DM防治的重要指導意義。
本研究以含烏梅方劑數據挖掘為切入點,從頻次來看,盡管甘草亦屬補氣藥且頻次高于人參,但其在許多方劑中常作調和藥性之用,且在配伍中常與人參同用或輔助人參發揮補益類作用,如炙甘草湯(《傷寒論》)、四君子湯(《局方》)等[24]。此外,在基于關聯規則分析得到的核心藥對中,除人參、甘草外,麥冬、葛根、天花粉并不屬補氣藥。故本研究優先選取烏梅-人參這一核心藥對,并進一步探討其治療DM的潛在作用機制。
烏梅酸斂,生津除煩;人參甘補,益氣生津。二藥相伍,相輔相成,益氣同時養陰生津之功益彰,具“酸甘化陰”之義。酸甘化陰法用治消渴由來已久,首見于仲景所制之腎氣丸,方中山茱萸與干地黃、山藥伍用,酸甘化陰,亦寓陰中求陽之意。此外,諸如口含酸棗丸(《備急千金要方》)、六味地黃丸(《小兒藥證直訣》)、烏梅四物湯(《醫門八法》)、生脈散(《醫學啟源》)、玉泉丸(《雜病源流犀燭》)等典型酸甘化陰法配伍的方劑亦被廣泛用于消渴的臨床治療[25,26]。研究報道,烏梅作君藥的酸甘化陰法方劑可改善氣陰兩虛型2型DM患者中醫證候,并降低空腹血糖、糖化血紅蛋白、胰島素抵抗指數[27]。烏梅-人參藥對切合消渴“氣陰兩虛”病機,亦是中醫酸甘化陰法之典型運用,其對于現代DM的相關研究值得進一步深入。
本研究進一步運用網絡藥理學方法對烏梅-人參藥對進行DM相關作用機制探討。TCMSP搜集得到二藥共有27個成分,可作用于52個DM相關靶點。PPI網 絡 分 析 表 明AKT1、TNF、VEGFA、MAPK1、STAT3、TP53、MAPK8和PIK3CA可能是烏梅-人參治療DM的主要靶點。TNF是一組可以引起細胞死亡的細胞因子,該家族包括兩個成員,TNF-α和TNF-β。其中TNF-α參與了全身炎癥反應,同時它可以通過減弱胰島素的信號轉導途徑,減少脂肪細胞中的葡萄糖轉運,以及抑制脂聯素等方式在胰島素抵抗中發揮重要作用[28]。STAT3是STAT家族中的成員,其除了參與癌細胞的信號傳導,還在調節糖類及脂質代謝, 維持機體內環境穩態等方面扮演著重要角色。研究表明,STAT3可通過抑制肝臟糖異生的關鍵基因Pck1和G6pc來改善胰島素抵抗癥狀[29]。P53蛋白由17號染色體上的P53基因編碼,P53蛋白在維持細胞正常生長、抑制惡性增殖中起著重要作用,并與胰島素抵抗關系密切,是治療DM的新靶點[30]。
KEGG分析顯示,52個與DM相關的靶點主要富集在胰島素及胰島素并發癥相關通路上。胰島素抵抗是引起DM的重要原因。通常,肥胖誘發的慢性炎癥會引起IL-6、TNF-α等炎性因子的增加,而TNF-α會誘導JNK的激活,激活的JNK可以使胰島素信號通路中IRS蛋白上的Ser位點磷酸化,導致其相應Tyr位點的磷酸化降低,從而使下游的PI3K、AKTV蛋白不能被活化,從而產生胰島素抵抗[31]。IL-6可以激活STAT3,誘導SOCS蛋白表達,進而抑制IRS-1酪氨酸磷酸化,使胰島素PI3K信號轉導受阻,最終引起胰島素抵抗[32]。PPI網絡分析表明烏梅-人參藥對可以與關鍵靶點TNF、STAT3和PIK3CA產生作用,因而其可能通過調節胰島素抵抗通路中的TNF-α/JNK/PI3K或IL-6/STAT3/PI3K途徑來治療DM,如圖5所示。

圖5 胰島素抵抗信號通路圖
綜上,本研究通過整理《中醫方劑大辭典》中含烏梅方劑,運用中醫傳承輔助系統對其進行數據挖掘,并以DM “氣陰兩虛”病機為切入點,選取烏梅-人參核心藥對進行DM相關網絡藥理學機制探討,可為烏梅的臨床用藥及后續開發研究提供有益線索。基于中醫藥數據挖掘與網絡藥理學分析可為進一步研究提供方向,但還需要進一步實驗驗證,從而更加系統、科學地闡述烏梅-人參防治DM的機制。

