高分辨率核磁共振在評估腦梗死患者斑塊穩(wěn)定性及成分的應用觀察*
吳經緯 吳水仙 陳斌
(海南醫(yī)學院第二附屬醫(yī)院,海南 海口 570311)
動脈粥樣硬化(Atherosclerosis,AS)形成血栓及管腔狹窄是引發(fā)腦梗死的重要原因之一,患者早期有頭暈、頭痛、言語不清、四肢麻木甚至意識障礙等臨床癥狀[1]。腦梗死救治不及時易引起嚴重后遺癥甚至死亡,故及時診斷在腦梗死的治療中起關鍵性作用。傳統(tǒng)核磁共振血管造影只能顯示動脈血管的狹窄程度,無法明確狹窄血管壁結構及造成血管狹窄的因素[2]。目前,高分辨率核磁共振成像(High-resolution magnetic resonance imaging,HRMRI)因較高的軟組織分辨率,被認為是唯一可活體檢測顱內動脈血管壁結構的無創(chuàng)成像技術,并逐漸應用于顱內AS血管壁和斑塊特征的診斷研究中[3]。本研究旨在運用HRMRI檢測腦梗狹窄動脈血管壁斑塊分布及成分,探究斑塊穩(wěn)定性與腦梗死的關系,為腦梗死的臨床評估及診治提供參考依據,現報告如下。
1 資料與方法
1.1 一般資料 收集2019年6月~2021年6月我院行HRMRI檢測的腦梗死及短暫性腦缺血發(fā)作(Transient ischemic attack,TIA)130例患者。納入標準:①有兩個以上引起AS的危險因素。②入院1周內行HRMRI成像檢查。③HRMRI血管成像提示單側大腦中動脈(Middle cerebral artery,MCA)及勁內動脈(Internal carotid artery,ICA)狹窄[4-5]。排除標準:①合并血液循環(huán)系統(tǒng)疾病、自身免疫性疾病。②有HRMRI檢査禁忌證。③有非AS血管病變者,如血管炎癥、冠狀動脈肌纖維發(fā)育不良等。④栓塞風險的患者,如房顫、深靜脈血栓等[6-7]。按上述標準收集2019年6月~2021年6月入院行HRMRI檢測的腦梗死及TIA患者的臨床病例資料130例,將72例腦梗死患者作為觀察組,58例TIA患者作為對照組。
1.2 研究方法 所有患者均采用Ingenia Ⅱ 3.0T磁共振掃描儀(飛利浦公司,荷蘭,國械準字20153282757)仰臥位進行動脈掃描[8]。設置掃描參數包括重復時間(Repetition time,TR)、回波時間(Echo time,TE)、激勵次數(Number of excitation,NEX)、矩陣、厚度及間距等[9]。MCA的顱內HRMRI行黑血技術中的T1加權成像序列(T1 weighted imaging,T1WI),T2加權成像序列(T2 weighted imaging,T2WI),液體衰減反轉恢復序列(Fluid attenuated inversion recovery,FLAIR)及彌散加權成像(diffusion weighted imaging,DWI)。掃描參數:①T1WI序列TR 1000 ms、TE 9 ms、NEX 2次、矩陣為180 mm×144 mm、層厚2 mm、層間距0 mm。②T2WI及FLAIR序列TR 8000 ms、TE 105 ms、NEX 1次、矩陣為180 mm×144 mm、層厚2 mm、層間距0 m。③DWI序列TR 6000 ms、TE 72 ms、NEX 1次、矩陣為128 mm×128 mm、層厚6 mm、層間距1 mm。ICA采用8通道專用線圈行“亮血”技術中的三維時間飛躍法(3D-time of flight,3D-TOF)及磁共振血管成像(MR angiography,MRA)。掃描方式:先行3D-TOF進行動脈血管成像掃描定位,然后于MCA狹窄橫軸位處行黑血高分辨率T1WI、T2WI序列掃描。掃描參數:①TOF-MRA的TR 22 ms、TE 3.5 ms、NEX 1次、矩陣為330 mm×220 mm、層厚0.6 mm、層數140。②T1WI序列TR 800 ms、TE 10 ms、NEX 2次、矩陣為180 mm×144 mm、層厚2 mm、層間距0 mm。③T2WI及FLAIR序列TR 4000 ms、TE 50 ms、NEX 1次、矩陣為180 mm×144 mm、層厚2 mm、層間距0 mm。利用規(guī)格為20 mL(0.5 mol/L)的X線造影劑釓噴酸二甲葡胺(康臣藥業(yè)有限公司,廣州,國藥準字H10950270)靜脈注射,0.1 mmoL/kg。注射后5 min強化成像,再注射等量0.9%氯化鈉注射液(福星生物藥業(yè)有限公司,武漢,國藥準字H42022222)進行沖洗。所得圖像均進行相應處理,由2名專業(yè)影像科醫(yī)師進行閱片,評估、分析患者動脈血管斑塊情況。
1.3 觀察指標 ①斑塊位置。根據HRMRI圖像分析動脈血管壁斑塊的位置,將其分為前、后、上、下壁。②動脈斑塊分型標準[10]。Ⅰ~Ⅱ型:血管壁厚度近似正常,無鈣化;Ⅲ型:血管內膜彌漫性或偏心性增厚或有較小斑塊,無鈣化;Ⅳ~Ⅴ型:可見較大斑塊且內含纖維包裹的脂質核心,可見少量鈣化;Ⅵ型:斑塊成分復雜,表面潰瘍出血或內部形成血栓;Ⅶ型:斑塊呈鈣化;Ⅷ型:無脂核核心纖維斑塊,可見少量鈣化。其中Ⅰ~Ⅲ型、Ⅶ~Ⅷ型為穩(wěn)定性斑塊,Ⅳ~Ⅵ型為不穩(wěn)定性斑塊,易破損出血導致腦缺血。③動脈斑塊負荷參數:對比兩組最狹窄處血管總面積(Total vascular area,TVA)、管腔面積(Lumen area,LA)、管壁面積(Wall area,WA)、管壁標準化指數(Normalized wall index,NWI)、血管重構指數(Remodeling index,RI)。④記錄兩組壞死脂質核心、斑塊內出血、纖維帽破裂及管腔狹窄發(fā)生情況。
2 結果
2.1 兩組一般資料比較 將腦梗死患者作為觀察組,共72例,TIA患者為對照組,共58例。觀察組中男性47例,女性25例;平均年齡(55.86±15.57)歲;高血壓60例,糖尿病15例,冠心病5例;吸煙35例;飲酒31例;對照組中男性35例,女性23例;平均年齡(56.12±16.33)歲;高血壓42例,糖尿病11例,冠心病3例;吸煙26例;飲酒20例。兩組患者在性別、年齡、合并癥、吸煙及飲酒史等比較無統(tǒng)計學意義(P>0.05)。
2.2 兩組斑塊位置比較 觀察組斑塊多集中于后壁及上壁,對照組集中在前壁及下壁,兩組斑塊位置比較差異有統(tǒng)計學意義(P<0.05),見表1。
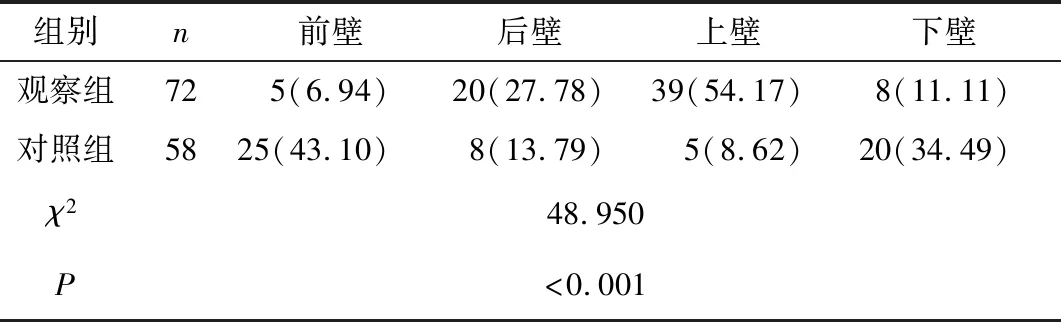
表1 兩組斑塊位置對比[n(×10-2)]Table 1 Comparison of plaque location between the two groups
2.3 兩組斑塊穩(wěn)定性比較 觀察組不穩(wěn)定性斑塊的占比明顯多于對照組,差異具有統(tǒng)計學意義(P<0.05),見表2。
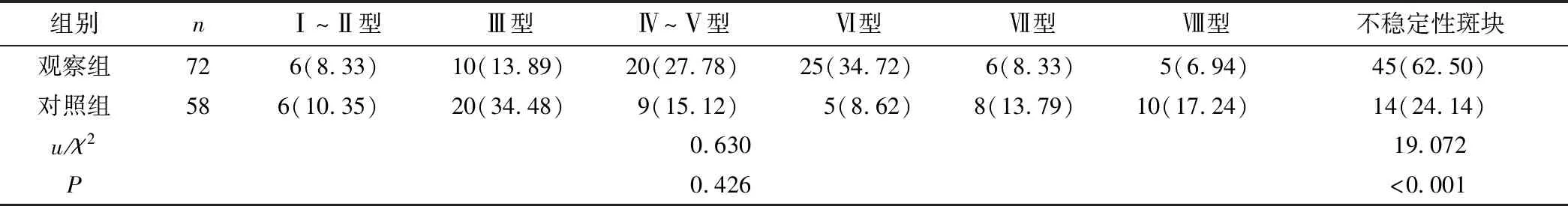
表2 兩組斑塊穩(wěn)定性對比[n(×10-2)]Table 2 Comparison of plaque stability between the two groups
2.4 兩組動脈斑塊負荷參數比較 觀察組LA明顯小于對照組,NWI、RI明顯高于對照組(P<0.05);兩組TVA、RI比較差異無統(tǒng)計學意義(P>0.05),見表3。
表3 兩組動脈斑塊負荷參數對比Table 3 Comparison of arterial plaque load parameters between the two groups
2.5 兩組血管成分比較 觀察組壞死脂質核心、斑塊內出血及纖維帽破裂的例數及比率明顯高于對照組(P<0.05);兩組管腔狹窄率比較差異無統(tǒng)計學意義(P>0.05),見表4。
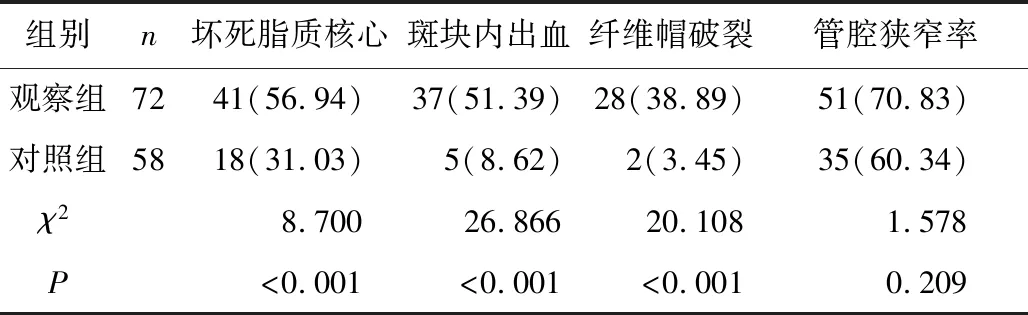
表4 兩組斑塊位置對比[n(×10-2)]Table 4 Comparison of plaque location between the two groups
2.6 典型腦梗死HRMRI成像 大腦中動脈(MCA)的HRMRI成像(圖1),頸動脈(ICA)的HRMRI成像(圖2)。
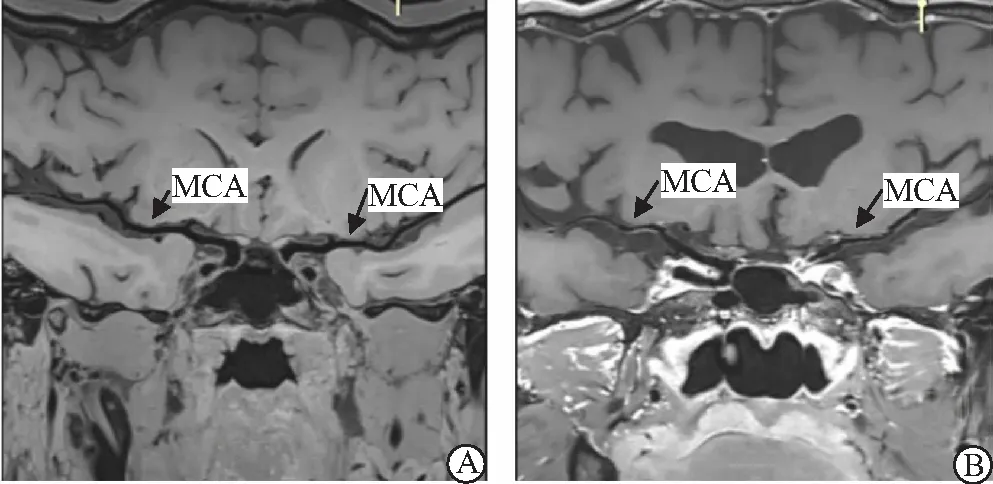
圖1 大腦中動脈HRMRI成像Figure 1 HRMRI imaging for middle cerebral artery注:A.正常雙側大腦中動脈成像,管壁無增厚、管腔無狹窄及斑塊;B.男性患者,年齡58歲,診斷為左側大腦中動脈腦梗死,HRMRI成像顯示大腦中動脈M1段管壁增厚,管腔狹窄,上壁斑塊呈鈣化
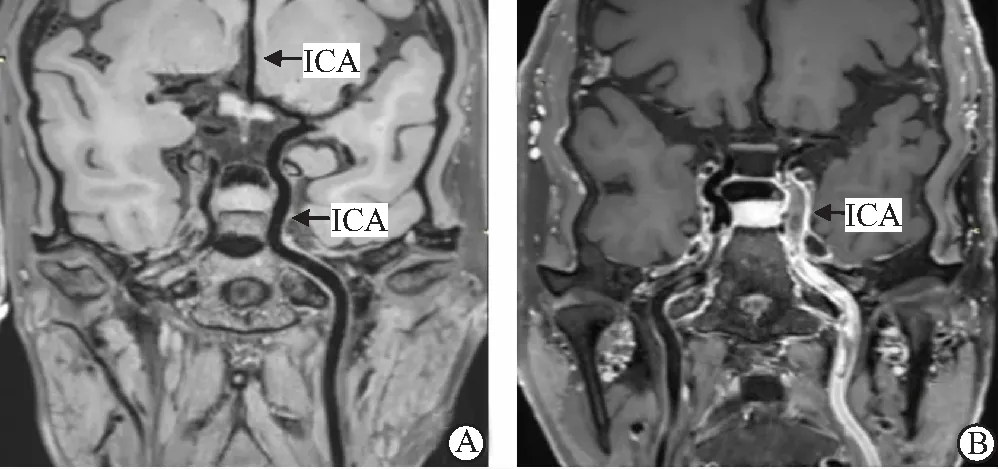
圖2 頸動脈HRMRI成像 Figure 2 HRMRI imaging of internal carotid artery注:A.正常左頸內動脈及大腦前動脈成像,管壁無增厚、管腔無狹窄及斑塊;B.男性患者,年齡61歲,診斷為左頸內動脈腦梗死,HRMRI成像顯示左頸內動脈管壁增厚,血流動力學變化,斑塊呈高信號,管腔內血栓且提示血栓增強
3 討論
AS指動脈血管壁內皮組織因各種損傷而發(fā)生管腔狹窄或形成血栓的一種慢性炎癥反應,是腦梗死和TIA最常見病因[11]。AS造成MCA或ICA狹窄、血流動力學改變、血栓等情況的出現,易引發(fā)血管內形成斑塊,腦梗死及TIA除具有相同的病因及危險因素外,皆有血管內斑塊的存在引起缺血性事件發(fā)生,且TIA易繼發(fā)腦梗死[12]。HRMRI不僅能反映斑塊形態(tài)及成分,也能呈現斑塊具體分布特性,為AS疾病的評估提供更全面、準確的斑塊相關內容。臨床研究多用MRI或HRMRI對腦梗死及TIA進行影像學特征的對比分析[13]。故早期對AS患者的斑塊特性進行明確的影像學診斷,不僅可以鑒定非TIA繼發(fā)性腦梗死,而且有助于腦梗死的防治,減輕斑塊對患者的損害[14]。
研究[15]表明,遠端血管分支能受到斑塊分布的潛在影響,特別是MCA、ICA等分支較多的血管,若此類血管分支開口處出現斑塊,其脫落可導致分支開口處動脈血栓形成,增加腦梗死的風險,而臨床傳統(tǒng)血管影像學技術無法明確斑塊在分支動脈開口處的位置,HRMRI可能彌補其在斑塊診斷中的不足。本研究結果顯示,腦梗死患者的斑塊主要分布于后壁及上壁,TIA患者的斑塊集中在與分支開口處相對的前壁及下壁,兩者斑塊位置位置比較差異有統(tǒng)計學意義(P<0.05),提示通過HRMRI檢測到的斑塊分布可以鑒別腦梗死或TIA,有利于診斷非分支開口處血管病變患者,對早期形成的AS斑塊進行有效干預。可能原因為斑塊形成于血管后壁或上壁時,阻塞分支小血管造成長期缺血梗死的可能性更大,而當斑塊存在于分支開口相對處的前壁及下壁時,分支開口受阻風險小,伴隨患者活動而出現阻塞動脈管腔引起局部缺血癥狀,與TIA的癥狀相符。以往研究[16]曾報道,斑塊脫落與血管部位及血管狹窄程度互相成為促進因素,形成惡性循環(huán),斑塊在長期血流沖擊下脫落,栓塞遠端細小血管,引發(fā)TIA或腦梗死。因此,HRMRI可解釋AS斑塊分布位置及與動脈小血管分支開口的關系,幫助AS患者制定診療方案,為進一步確診腦梗死提供診斷依據。
臨床常根據HRMRI圖像中呈現的斑塊內鈣化成分、脂質核心、纖維帽及出血等結果,評估斑塊的穩(wěn)定性[17]。陳偉紅等[18]將HRMRI應用于后循環(huán)缺血性卒中的AS影像學分析中,通過高分辨率的斑塊特征得出斑塊出現高信號可能與血栓栓塞有關,他們認為炎性反應使內皮細胞通透性和細胞外間質體積增加致斑塊鈣化,這可能是同一血管區(qū)發(fā)生腦梗死的原因。本研究結果顯示腦梗死患者AS斑塊的不穩(wěn)定性率比TIA患者高,管腔狹窄情況比TIA患者嚴重,NWI及RI都比TIA患者高,說明HRMRI可評估腦梗死患者AS血管內斑塊情況,且腦梗死與TIA有不同斑塊特性,腦梗死患者斑塊穩(wěn)定性更差。分析其原因可能為HRMRI的優(yōu)勢在于其擁有傳統(tǒng)MRI欠缺的黑血序列技術及亮血序列技術。黑血技術中的T1WI序列所顯示的圖像更加清晰,能有效捕捉管腔內血流強弱信號,清晰呈現動脈管壁情況,精確對比斑塊差異,提高醫(yī)師對斑塊成分鑒定、測量評估的準確率;亮血技術中的3D TOF及MRA掃描可定位斑塊,尤其是動脈分叉處,可解釋斑塊分布于動脈分叉的關系,及早區(qū)分腦梗死及TIA,兩種技術在診斷動脈粥樣硬化方面具有較高的應用價值[19]。另外,本研究結果顯示,腦梗死患者的斑塊內岀血、纖維帽破裂及脂質核心壞死發(fā)生率比TIA高,說明早期檢測斑塊成分及特征情況對腦梗死的預防有重大意義。原因在于脂質核心壞死對斑塊穩(wěn)定性有較大影響,脂質核心占比高時斑塊極易破裂,就病理特征而言,斑塊內出血與腦梗死臨床表現密切相關,纖維帽破裂或脫落阻塞顱內血管從而造成腦梗死,脂質核心、斑塊出血及纖維帽破裂同為易損斑塊的評價指標[20]。因此,早期通過HRMRI識別易損斑塊,能及時進行有效干預,避免斑塊嚴重病變。
4 結論
高分辨率核磁共振可以清晰呈現血管斑塊的影像學特征,客觀準確地對斑塊的穩(wěn)定性及成分進行多方位成像,對早期評估與診斷腦梗死具有重要意義,對及時改善患者腦梗死情況有全面參考價值,可廣泛應用于臨床中。

