食物中毒樣品中大腸埃希氏菌的分離、檢測和鑒定
◎ 龍 慧,龍永艷,王 偉,吳 葵,樊國印
(南昌市疾病預防控制中心,江西 南昌 330038)
大腸埃希氏菌是一種革蘭氏陰性桿菌,有周生鞭毛、無芽孢、兼性厭氧,其廣泛分布在人和溫血動物腸道內[1]。誤食被大腸埃希氏菌污染的食物,通常會引起腹瀉、嘔吐等癥狀,尤其是對于新生兒、老年人等免疫力較低的人群,在感染大腸埃希氏菌后不給予處理治療,會嚴重影響患者的身體健康[2-3]。建立靈敏、準確的檢測方法對于預防和控制大腸埃希氏菌引起的食品安全事件尤為重要。目前,《國家食品安全標準 食品微生物檢驗 大腸埃希氏菌計數》(GB 4789.38—2012)明確規定大腸埃希氏菌的檢驗方法,通過LST肉湯多管發酵進行檢測,最少需要2 d才能對結果進行初步的判定,具有一定的滯后性,無法滿足食物中毒樣品快速檢測的需求[4]。熒光定量PCR是通過擴增特定的靶基因實現指數放大,然后收集熒光信號構建標準曲線用于靶標定量,整個檢測過程耗時短,且能夠滿足快速檢測的需求,適用于食物中毒樣品的應急檢測[5-7]。熒光定量PCR主要分為染料法和探針法,染料法是對擴增后的雙鏈DNA進行結合產生熒光信號,非特異性的擴增的二聚體會影響熒光信號造成假陽性[8-10]。
本研究使用探針法進行檢測,選取大腸埃希氏菌的uidA基因設計引物和探針序列,構建熒光定量PCR檢測體系并評價方法的檢測性能,進一步應用建立的檢測方法對食物中毒樣本進行分析,并對檢測為大腸埃希氏菌陽性的樣本進行分離鑒定和藥敏實驗。這為熒光定量PCR用于食品中檢測大腸埃希氏菌提供科學依據,能夠及時掌握食源性大腸埃希氏菌的生化及耐藥信息。
1 材料與方法
1.1 試劑和儀器
營養瓊脂(北京陸橋技術股份有限公司)、腦心浸出液(北京路橋技術股份有限公司)、Premix Ex Taq?(TAKARA,寶日醫生物技術有限公司)、革蘭氏陰性菌細菌鑒定卡(梅里埃)、細菌藥敏鑒定卡(梅里埃);高速冷凍離心機(賽默飛世爾科技)、恒溫恒濕培養箱(上海一恒科技有限公司)、熒光定量PCR儀-CFX96 Touch[伯樂生命醫學產品(上海)有限公司]。
1.2 實驗方法
1.2.1 引物和探針設計
根據NCBⅠ數據庫報道的大腸埃希氏菌特異性基因uidA序列,使用Beacon designer 8設計引物和探針,并利用NCBⅠ BLAST驗證引物的特異性,確定不存在非目標菌的基因匹配,引物和探針序列委托通用生物(安徽)股份有限公司合成。
1.2.2 基因組DNA提取
細菌基因組DNA的提取采用水煮沸法。取菌懸液1 mL加入到1.5 mL無菌離心管中,放置在高速離心機中12 000 r·min-1離心3 min,去除上清液,然后加入1 mL PBS緩沖液重懸,12 000 r·min-1離心3 min,重復一次,最后重懸在500 μL超純水中,獲取菌懸液;將菌懸液放置在沸水中,煮沸15 min,使細菌破裂暴露出基因組DNA,然后放置在冰水浴中5 min,最后通過12 000 r·min-1離心5 min,上清液即為基因組DNA。
1.2.3 方法的建立和性能評價
根據Beacon designer 8軟件提供的引物和探針Tm值,設置退火和延伸溫度范圍為55.0~65.0 ℃,進行梯度PCR,根據不同溫度對應的相對熒光強度確定最佳的退火和延伸溫度。qPCR擴增體系總體積為25 μL,包含 12.5 μL(2×)Premix Ex Taq?,0.5 μL 上游引物uidA-F(10 μmol·L-1)、0.5 μL 下 游 引 物uidA-R(10 μmol·L-1),0.5 μL 探針uidA-P(10 μmol·L-1),5 μL基因組DNA模板,6 μL超純水;擴增程序,95 ℃預變性3 min,95 ℃變性15 s,57.0 ℃退火和延伸30 s,在退火和延伸階段采集熒光信號。
取純菌液按照2.3的方法提取基因組DNA,并進行梯度稀釋,獲取菌濃度為101~108CFU·mL-1的基因組DNA,然后對基因組DNA進行qPCR擴增,根據不同細菌濃度對應的Ct值建立標準曲線,確定線性相關性和擴增效率以及檢測靈敏度。
選取2株目標菌、8株非目標菌的純菌液,按照2.3的方法提取基因組DNA,通過qPCR擴增,驗證該方法的特異性。
1.2.4 生化鑒定
取qPCR鑒定為大腸埃希氏菌的陽性樣本進行分離培養,獲取4株大腸埃希氏菌單菌落,然后接種在腦心浸出液中進行過夜培養得到菌懸液。將菌懸液進行稀釋,使菌濃度大約在0.5麥氏單位,然后按照全自動細菌生化鑒定系統(VⅠTEK 2)要求進行操作。
1.2.5 藥敏實驗
取qPCR和生化鑒定為大腸埃希氏菌的菌懸液,將菌懸液稀釋至濃度約為0.5麥氏單位,使用革蘭氏陰性菌藥敏卡片(AST-GN16)進行藥敏實驗,確定大腸埃希氏菌分離菌的耐藥信息。
2 結果與分析
2.1 檢測方法的建立
qPCR體系建立為快速靈敏的檢測目標菌提供了基礎,本研究成功建立了熒光定量PCR檢測大腸埃希氏菌。退火溫度優化的結果如圖1所示,當溫度為55.0~57.0 ℃時,RFU值逐漸增加,57.0~65.0 ℃時RFU值逐漸降低,根據優化結果,選取57.0 ℃為最佳退火溫度。
qPCR擴增曲線結果如圖2所示,擴增曲線為典型的S型曲線,基線期、指數期和平臺期明顯,曲線平滑無分叉現象,整個檢測過程在2 h內完成,表明qPCR檢測體系的成功建立。
2.2 方法檢測限的評價
方法檢測限是評價檢測方法性能的重要指標,在最優條件下對不同濃度的目標菌進行檢測,通過qPCR擴增結果,以不同細菌濃度對應的Ct值建立標準曲線,結果如圖3所示,線性方程Y=-3.116X+42.85,擴增效率為109%,線性相關性R2=0.996 6,線性范圍為10~108CFU·mL-1,檢測靈敏度為10 CFU·mL-1。結果表明,本研究建立的qPCR檢測體系,檢測靈敏度高、線性范圍寬,具有較好的擴增效率。
2.3 方法特異性評價
選取2株大腸埃希氏菌(ATCC 25922、ATCC 8739),8株非目標菌[鼠傷寒沙門氏菌(CMCC 50115)、副傷寒沙門氏菌(CMCC 80094)、腸炎沙門氏菌(ATCC 13076)、金黃色葡萄球菌(CMCC 26001)、金黃色葡萄球菌(CMCC 26003)、阪崎克羅諾桿菌(ATCC 29544)、蠟樣芽孢桿菌(ATCC 11778)和銅綠假單胞菌(ATCC 9027)]檢測特異性驗證,檢測結果如圖4所示,uidA基因只能擴增大腸埃希氏菌,其他非目標菌無擴增曲線,結果表明,本研究建立的qPCR檢測體系能夠特異性檢測大腸埃希氏菌。
2.4 大腸埃希氏菌的生化鑒定
根據VⅠTEK生化鑒定結果顯示,進一步確定從食物中毒樣品中分離的4株菌為大腸埃希氏菌。具體的生化鑒定結果如表1所示,大部分生化結果都相同,只有少數生化項目存在差異,其中分離株C2能夠分解D-麥芽糖和蔗糖且酪氨酸芳胺酶陽性,分離株C3能夠分解D-麥芽糖且γ-谷氨酰轉移酶陰性,分離株C4能夠分解D-麥芽糖和蔗糖。
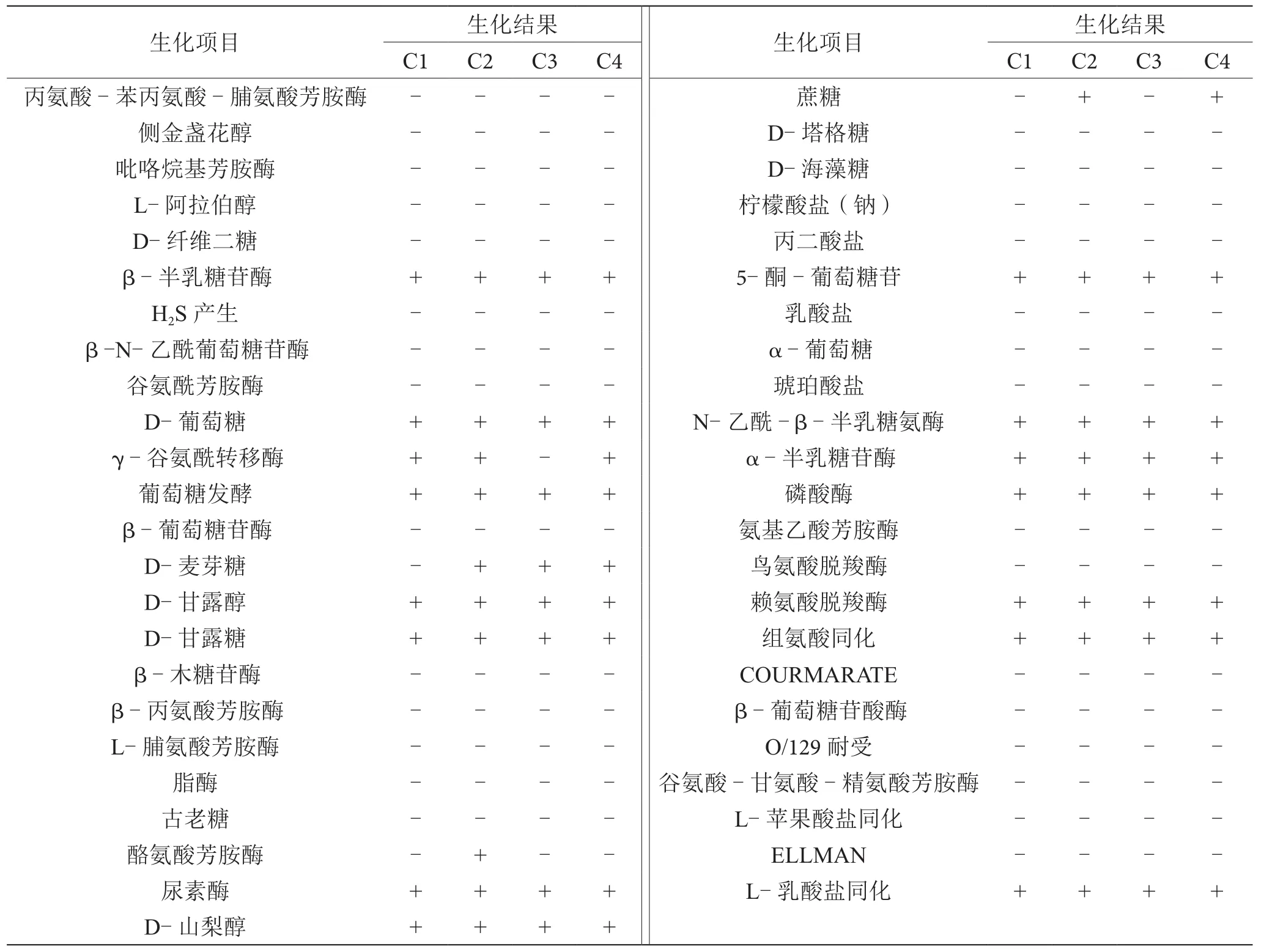
表1 生化鑒定結果表
2.5 大腸埃希氏菌藥敏實驗
大腸埃希氏菌藥敏實驗結果見表2。4株大腸埃希氏菌分離株均表現出對氨芐西林、阿莫西林-棒酸、哌拉西林-他唑巴坦、頭孢唑啉、頭孢西丁、頭孢曲松、頭孢匹美、氨曲南、厄他培南、亞氨培南、阿米卡星、環丙沙星、呋喃妥因和復方新諾明等抗生素耐藥,對慶大霉素、妥布霉素、左旋氧氟沙星和替加環素等抗生素表現出不同的耐受情況,且不同分離株對一些抗生素的最低抑菌濃度(MⅠC)表現出不同。
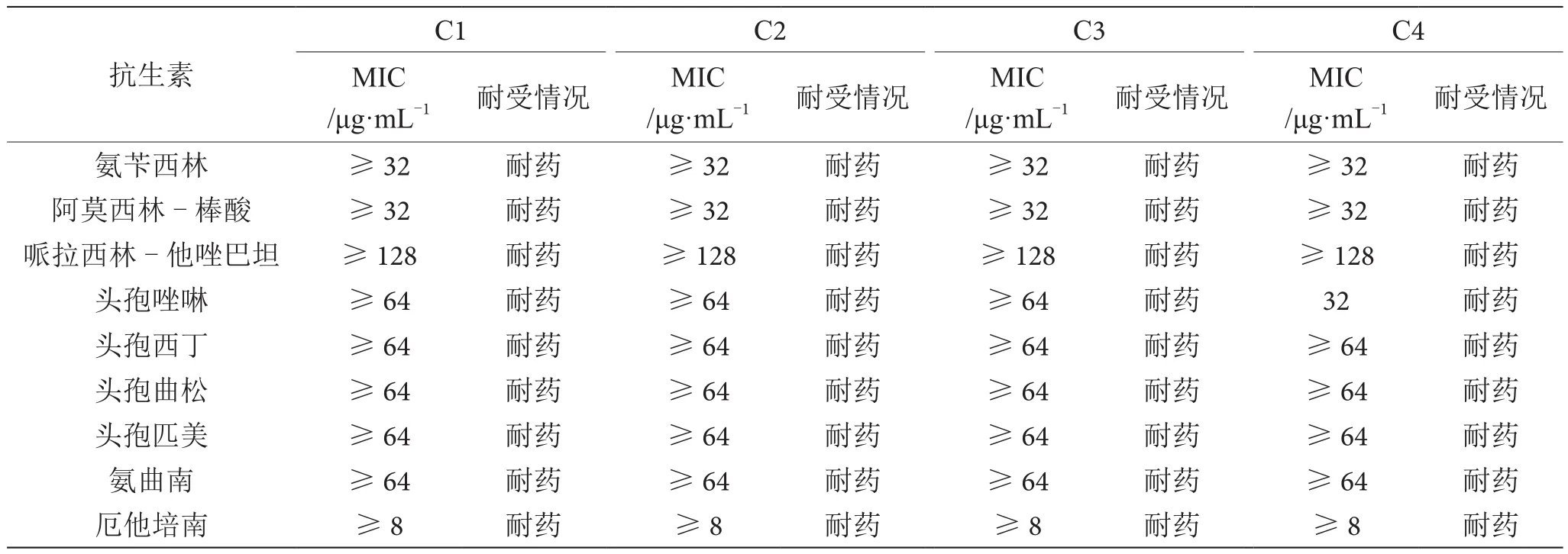
表2 藥敏實驗結果表
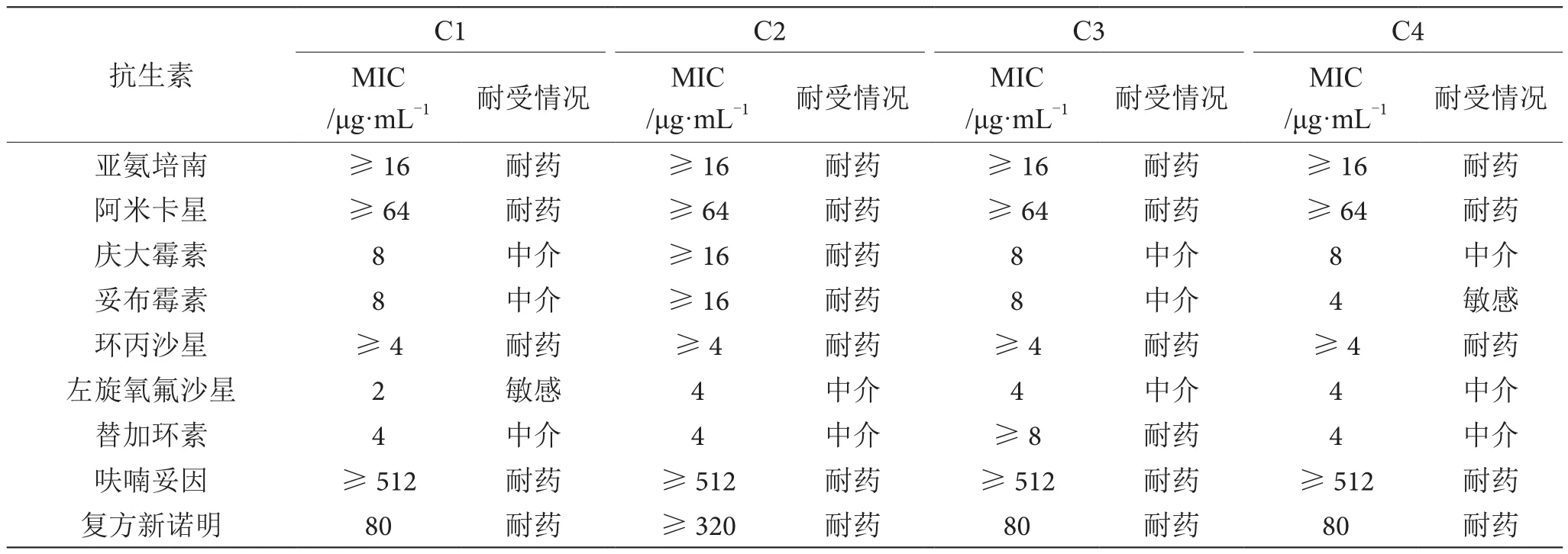
續表2
3 結論
本研究選取大腸埃希氏菌特異性基因uidA設計引物和探針序列,構建熒光定量PCR檢測體系,實現靈敏、快速、準確的檢測大腸埃希氏菌,檢測限低至10 CFU·mL-1。使用本研究建立的熒光定量PCR檢測體系對10份食物中毒樣品進行分析,發現4份大腸埃希氏菌陽性樣本,對陽性樣本進行純培養分離獲取了4株大腸埃希氏菌。VⅠTEK生化鑒定進一步表明這4株分離株為典型的大腸埃希氏菌,而且這4株分離株的生化鑒定結果基本一致,比對樣本來源信息發現,這4份樣本的采樣來自相同環境。藥敏實驗結果顯示4株分離株對大部分的抗生素表現出相同的耐藥情況,只有少部分存在差異。
大腸埃希氏菌是一種常見引發食物中毒的病原菌,人們誤食被污染的食品后會引發一系列的疾病,建立快速準確的檢測方法,對預防和控制由大腸埃希氏菌引發的食物中毒具有重要意義。進一步生化和藥敏分析能夠掌握中毒樣品中大腸埃希氏菌的生物學特性,這為患者治療提供了科學依據。

