Ti/SnO2-Sb-Yb電極電催化氧化吡啶廢水的研究
胡 馨,王春榮,*,李海燕,2
(1.中國礦業大學(北京) 化學與環境工程學院,北京 100083;2.貴州工程應用技術學院 土木建筑工程學院,貴州 畢節 551700)
0 引 言
隨著鋼鐵行業的發展,焦炭的需求激增,到2020年,中國焦炭產量將超過4億噸[1]。在焦炭生產過程中產生的高濃度焦化廢水具有毒性大、性質不穩定、污染環境等特點[2],且焦化廢水難以生物降解,經過厭氧-好氧聯合處理后,大部分烯烴和炔烴能夠降解,但如吡啶、吲哚等生化性質較差的物質經生化處理后仍有很大的殘留[3]。吡啶具有強刺激性,能夠引發多發性神經病,且具有致癌風險,對人類健康和生存環境都存在極大的威脅[4]。電化學氧化技術具有氧化性能強、處理條件溫和、環境相容性好等優點,是一種有效的深度處理難降解有機污染物的技術[5]。目前電化學氧化技術處理難降解廢水所用的電極主要有非金屬電極、金屬電極及金屬氧化物電極。其中非金屬電極導電性高,但其硬度小、機械強度差、電流礦化效率低;金屬電極機械強度大但易鈍化;Ti/SnO2-Sb電極是一種金屬氧化物電極,由于陽極表面相互作用力小,所以有機物去除率相對較高,但其穩定性較差。大多數稀土元素沒有5d電子,可以提供良好的電子轉移軌道,為“催化作用”作電子轉移站,因此,稀土元素及其化合物具有較高的催化活性[6]。本文采用Ti/SnO2-Sb-Yb陽極電催化氧化吡啶廢水,分析陽極氧化體系中運行參數對吡啶以及TOC降解效率的影響,并以Ti/SnO2-Sb陽極為對比,進行電化學反應動力學以及能耗分析。
1 試驗材料和方法
1.1 試劑與材料
Ti/SnO2-Sb-Yb陽極與Ti/SnO2-Sb陽極(50 mm×50 mm×1 mm)均由本課題組制備,制備方法為熱分解法。首先將鈦板進行打磨、堿洗、酸蝕,然后將經過預處理后的鈦板放入制備好的前驅體溶液中進行涂膜,經過多次涂膜、熱處理、焙燒工藝,最終制得電極。甲醇為高效液相色譜(HPLC)級,吡啶、硫酸鈉、氫氧化鈉和硫酸(95%~98%)均為分析級,所有溶液均在去離子水中配制。
1.2 實驗裝置
分別以Ti/SnO2-Sb-Yb與Ti/SnO2-Sb兩種電極為陽極,相同面積的鈦板作為陰極,外接直流電源用來控制電流,電解槽容積為50 mL,實驗裝置如圖1所示。
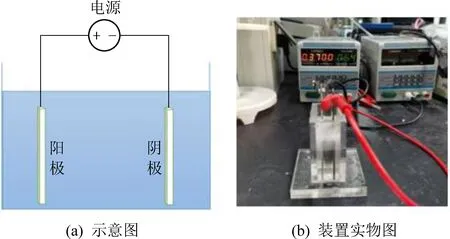
圖1 反應裝置圖Fig.1 Reaction device diagram
1.3 測試方法
吡啶濃度采用帶有C-18色譜柱(250 nm × 4.6 nm × 5 nm)的高效液相色譜儀(Ultimate 3000)進行測定,檢測波長λ=254 nm,柱溫為35 ℃,流動相為甲醇和水的混合液(體積比為70∶30),流速為1.0 mL/min,進樣量為20 uL。TOC的濃度采用總有機碳分析儀進行測定。本試驗設置3組平行試驗、1組對照試驗、1組空白試驗并且在每次試驗前均進行儀器的校準來減少實驗誤差。
2 結果與分析
2.1 Ti/SnO2-Sb-Yb陽極電催化氧化吡啶的研究
2.1.1 電流密度的影響
污染物的去除率在一定范圍內隨著電流密度的增加而快速增加,所以增加電流密度可以縮短反應時間,但縮短反應時間的同時也會加劇副反應發生,造成電極使用壽命的減少及電能損失;當電流密度低時,則需要通過增大極板面積或延長反應時間來增加去除率,導致處理周期及成本的增加,所以選擇適宜的電流密度可以確保反應經濟有效地運行。本文在電解質濃度為40 mmol/L,極板間距為10 mm,初始pH為7,吡啶初始濃度為50 mg/L的條件下探究了10、15、20、25、30 mA/cm2五種電流密度影響因素對電化學降解吡啶效果的影響,試驗結果如圖2所示。


圖2 不同電流密度對吡啶和TOC去除效果圖Fig.2 The effect of different current density on the removal of indole and TOC
2.1.2 電解質濃度的影響
電解質能夠增加溶液導電率,節省電能消耗。有機廢水導電性較弱,添加一定量電解質可以增加反應體系的導電性,降低槽電壓。Cl-在弱堿性條件下容易形成次氯酸而有助于氧化反應的進行,但由于在活性電極電催化氧化有機物的體系中,·OH發揮主要作用,而Cl-被氧化為Cl2會消耗大量·OH以及電子,從而影響電流效率,故實驗中選取Na2SO4為電解質。在電流密度為20 mA/cm2,極板間距為10 mm,初始pH為7,吡啶初始濃度為50 mg/L的條件下,設置了10、20、30、40、50 mmol/L五種不同水平的Na2SO4濃度,對吡啶去除效果進行探究,試驗結果如圖3所示。
由圖3可知,當電解質濃度由10 mmol/L增加到50 mmol/L時,吡啶去除率呈現先增加后降低的趨勢。電極分散層的分散性隨電解質濃度的增加而減小,所以去除率在一定程度上隨電解質濃度的增加而增加。但當電解質濃度增加到一定程度時,吡啶去除率反而有所下降,TOC的去除也不能得到有效提高。原因有二:一是由于隨著電解質濃度逐漸增大,去除率主要取決于反應體系中有機物到陽極表面的擴散速度,大量電解質電解產生的陰陽離子以及反應過程中產生的中間產物都會增大污染物向陽極附近遷移的傳質阻力,在高電解質濃度溶液中,隨著反應的進行,催化層附近的吡啶濃度逐漸降低,而更多遠處的污染物便因不能克服這些傳質阻力而無法到達催化層參加反應導致去除率降低。二是由于電解質濃度增加到一定程度時,通過溶液的電流會超過其限制電流,離子擴散效應降低,傳質惡化[9],去除率下降。相比其它因素,電解質濃度對吡啶降解效果的影響不是很明顯。所以本試驗電解質濃度選取40 mmol/L較為合適。
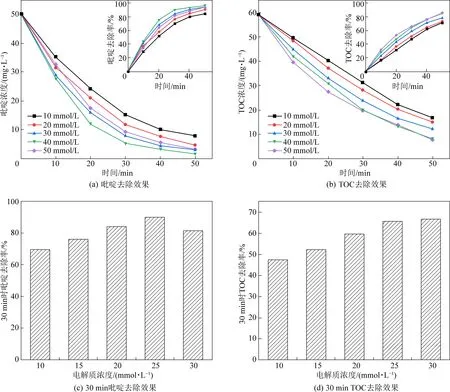
圖3 不同電解質濃度對吡啶和TOC去除效果圖Fig.3 The effect of different electrolyte concentrations on the removal of pyridine and TOC
2.1.3 極板間距的影響
在實際工程應用中,極板間距不僅影響反應器占地面積和運行成本,而且還會對電化學反應體系的傳質產生影響[10]。在電流密度為 20 mA/cm2,初始pH為7,電解質濃度為40 mmol/L,初始吡啶濃度為 50 mg/L的試驗前提下,設置了5、10、15、20、25 mm五種不同水平的極板間距,探究其對吡啶去除效果的影響,試驗結果如圖4所示。
由圖4可知,吡啶與TOC的去除率均隨極板間距的增大而降低,這是由于反應體系的電阻隨極板間距的增大而增大,電阻的增大導致電流效率降低、槽電壓升高,從而使得去除效果變差。極板間距由10 mm減小到5 mm時,TOC與吡啶去除效果不會得到明顯改善,這是因為極板間距過小時,溶液的擴散速度遠小于電解速度,濃差極化現象嚴重,電子的傳遞速率降低。除此之外,陰陽兩極析出的離子也可構成與外加電場方向相反的原電池,極板間距過小,陰陽兩極析出離子較多,原電池電勢差較高,使得電流效率降低,污染物降解效果得不到有效提高。因此,本試驗選用極板間距為10 mm較為合理。
2.1.4 初始pH值的影響
吡啶在溶液中的形態、電極的電化學性質和析氧電位等均會受到pH值的影響,從而使得吡啶在溶液中的吸附甚至污染物的降解路徑發生改變,在電流密度20 mA/cm2,極板間距為10 mm,電解質濃度為40 mmol/L,吡啶初始濃度為50 mg/L的試驗前提,設置了3、7、11三種不同水平的初始pH值,探究其對吡啶去除效果的影響,試驗結果如圖5和表1所示。
由表1可知,吡啶的去除率在pH為7時最高,pH為3時最低。這是因為在酸性條件下會加劇析氫反應的發生,使得電流效率降低。此外,強酸性條件也會使得電極活性層的金屬氧化物流失,從而影響電極使用壽命。據文獻報道,在中性或堿性條件下, HO-更易失去電子轉化成·OH,
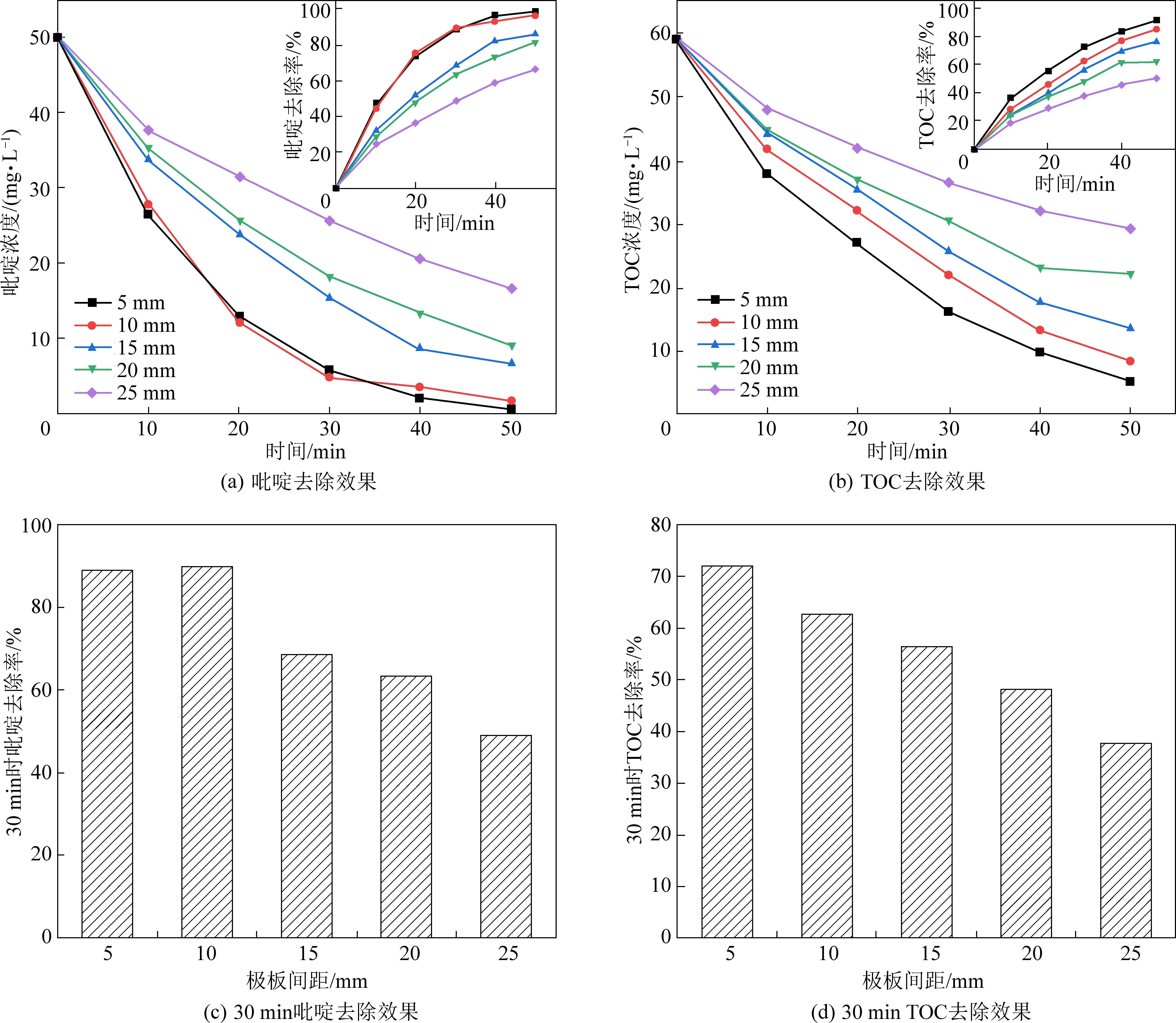
圖4 不同極板間距對吡啶和TOC去除效果圖Fig.4 The effect of different electrode spacings on the removal of pyridine and TOC
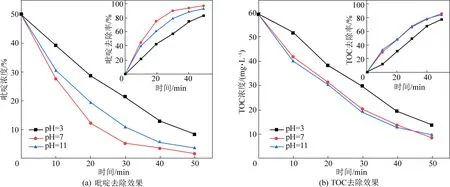
圖5 不同pH對吡啶和TOC去除效果圖Fig.5 The effect of different pH on the removal of pyridine and TOC

表1 不同pH體系反應30 min時的吡啶以及TOC去除率Table 1 Pyridine and TOC removal rates whendifferent pH systems react for 30 min
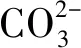

(1)

(2)
η=ε-ε0=ε-0.961-0.059pH
(3)
2.1.5 吡啶初始濃度的影響
在電流密度為20 mA/cm2,電解質濃度為40 mmol/L,極板間距為10 mm,初始pH為7的條件下,選取吡啶初始濃度為30、50、80、120 mg/L這4個水平,研究不同初始濃度下電催化氧化吡啶的降解效果。試驗結果如圖6和表2所示。
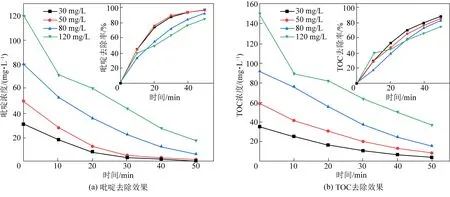
圖6 不同初始濃度對吡啶和TOC去除效果圖Fig.6 The effect of different initial concentrations on the removal of pyridine and TOC

表2 不同吡啶初始濃度體系反應30min時的吡啶以及TOC去除率Table 2 Pyridine and TOC removal rates when differentpyridine initial concentration systems react for 30 min
由表2可知,吡啶初始濃度由30 mg/L增加到120 mg/L時,吡啶去除率分別為97.37%、96.8%、92.56%、85.41%,TOC去除率分別為88.53%、85.62%、83.09%、75.17%,吡啶去除量從29.83 mg/L增加到102.49 mg/L,TOC去除量從31.18 mg/L增加至112.64 mg/L。 吡啶和TOC的去除率都隨著初始濃度的增加而降低,這是由于當電流密度一定時,產生活性基團的量大致相等,活性基團是吡啶被降解的必要條件,濃度低時,吡啶可以與電極迅速接觸而被氧化。另外發現,初始濃度高時吡啶和TOC的去除量比初始濃度低時要大得多。這是由于在低初始濃度的溶液中,較少的有機物量會加劇析氧副反應的發生。反應時間一定時,較高的有機物濃度會提高活性基團的利用率,減少析氧反應的發生,吡啶去除的絕對量較大。另外還發現,TOC與吡啶的去除速率都呈現先增加后減少的趨勢,在120 mg/L的高初始濃度條件下更為顯著。這是由于電解在剛開始的一段時間內,中間產物會大量產生并附著在電極表面,阻礙有機物與催化層的接觸,使催化層不能有效發揮作用。在120 mmol/L的高初始濃度中,有機物與活性基團發生碰撞的概率很大,故開始階段降解速率很高,然而也會有大量的中間產物積累,使其后續反應速率降低。楊耀輝[13]在鈰摻雜的Ti/SnO2-Sb陽極電催化氧化苯酚的研究中也出現了類似的結果。
2.2 Ti/SnO2-Sb-Yb陽極電催化氧化吡啶反應動力學分析
在上文所示的最佳試驗條件下,分別以Ti/SnO2-Sb與Ti/SnO2-Sb-Yb作為陽極,電化學處理初始濃度為50 mg/L的吡啶廢水,對試驗數據進行擬合發現吡啶的降解基本符合擬一級動力學,反應動力學各參數可由式(4)計算。
(4)
式(4)中:C代表不同時刻反應體系中的吡啶濃度;C0代表初始吡啶濃度;K為擬一級反應表觀速率常數;Km為表觀傳質系數;S為有效電解面積;V為電解液體積。擬合結果如圖7與表3所示。

圖7 吡啶降解的偽一級反應動力學擬合曲線Fig.7 Pseudo first-order reaction kinetics fitting curve of pyridine degradation
兩條擬合線的R2均在95%以上,說明擬合效果良好,線性關系明顯。相同條件下,反應速率與表觀速率常數成正比,而且傳質系數越大,傳質效果越好。Ti/SnO2-Sb-Yb陽極的表觀傳質系數與表觀速率常數均大于Ti/SnO2-Sb電極,這表明稀土Yb的摻雜有利于反應速率的增加。曾雪媛[14]在以Ti/SnO2-Sb-Er為陽極電化學降解初始濃度為50 mg/L啶蟲脒廢水的試驗中,計算發現其反應體系的表觀速率常數為0.007 25,低于本實驗中的表觀速率常數,這也說明Ti/SnO2-Sb-Yb陽極對吡啶有著很好的降解效果。李國華[15]在以Ti/SnO2-Sb-Nd為陽極電催化氧化苯酚廢水的試驗中,計算發現其反應體系中的表觀速率常數為0.096,是本實驗中Ti/SnO2-Sb-Yb陽極電化學降解吡啶廢水反應體系中表觀速率常數的2.5倍,這是由于苯酚這種有機物比較容易被降解。

表3 不同電極電催化氧化吡啶的反應動力學常數
2.3 Ti/SnO2-Sb-Yb陽極電催化氧化吡啶廢水能耗分析
為了評估Ti/SnO2-Sb-Yb電極的經濟性,本試驗在上文確定的最佳試驗條件下,分別用Ti/SnO2-Sb與Ti/SnO2-Sb-Yb陽極處理吡啶廢水,計算反應過程中的電流礦化效率(MCE)與電能消耗,并進行比較分析。電能消耗(以TOC計)如(5)所示,電流礦化效率如式(6)所示,其結果如圖7所示。
(5)
(6)
式(5)中:E為電能消耗,kW·h/kg TOC;Ucell為槽壓,V;I為電流,A;t為電解時間,h;ΔTOC為t時間內TOC去除量,mg/L。式(6)中: MCE 表示電流礦化效率,%;F為法拉第常數,96 487 C/mol;Vs為電解液體積,L;ΔTOCexp為TOC變化,mg/L;m為有機污染物中碳原子數量,吡啶(C5H5N)分子中m為5;I為電流,A;t為處理時間,h;n為每個污染物分子轉化成CO2和H2O 所需的電子,每個吡啶分子完全礦化需要22個電子。
由圖8中可以看出,反應進行50 min時,Ti/SnO2-Sb與Ti/SnO2-Sb-Yb陽極的TOC去除率分別為74.46%、85.73%,稀土Yb的摻雜使得TOC的去除率提高了11.27%。為了使電流礦化效率的變化趨勢更明顯,延長反應時間至90 min。電流礦化效率隨著反應時間延長而降低,反應90 min 后,Ti/SnO2-Sb與Ti/SnO2-Sb-Yb陽極的電流礦化效率分別從反應10 min時的7.23%、10.11%降低至3.63%、3.71%,后者的MCE值均高于前者。延長反應時間后,TOC的降解速率與MCE值的變化均不明顯,說明本反應體系并未使吡啶完全轉變為CO2、H2O等無機物,有一部分以小分子有機羧酸等含碳有機物的形式存在。耿聰[16]在Ti/SnO2-Sb-Mo陽極電催化氧化苯酚廢水的研究中表明,與Ti/SnO2-Sb陽極相比,其電流礦化效率可以提高4%,這與本文的研究結果也相符合。
經過計算可得,反應時間為50 min時,Ti/SnO2-Sb與Ti/SnO2-Sb-Yb陽極處理吡啶廢水的能耗分別為719.69 kW·h/kg TOC和559.28 kW·h/kg TOC,后者能耗更低。Yb的摻雜增加了表觀傳質系數,使得電流效率有效提高,而且稀土元素的摻雜還可以降低電極的電阻,使得有機物降解速率加快[17],從而導致反應能耗降低。

圖8 TOC濃度與礦化電流效率(MCE)比較Fig.8 Comparison of TOC concentration and mineralization current efficiency (MCE)
3 結 論
本文系統研究了Ti/SnO2-Sb-Yb陽極在不同運行條件下對吡啶的降解效果,討論了電流密度、電解質濃度、pH值、極板間距以及初始污染物濃度對陽極氧化效果的影響,并以Ti/SnO2-Sb陽極為對比,對反應過程中的能耗以及反應動力學各參數進行比較分析。實驗結果表明:
(1)在一定范圍內,吡啶降解效果隨著電流密度和電解質濃度的增加而增強;在中性條件下,吡啶降解效果更好;該陽極對于低濃度及高濃度的吡啶都有很好的降解效果,在吡啶初始濃度低時,其降解效果更好。
(2)在吡啶初始濃度為50 mg/L,電流密度為20 mA/cm2,電解質濃度為40 mmol/L,極板間距為10 mm,初始pH為7的條件下反應50 min,吡啶和TOC的去除率分別為96.8%、85.62%。
(3)在Ti/SnO2-Sb-Yb和Ti/SnO2-Sb電極電催化氧化吡啶的反應體系中,吡啶的降解基本符合擬一級動力學,與Ti/SnO2-Sb陽極相比,稀土Yb的摻雜使得反應體系中表觀速率常數與表觀傳質系數、TOC去除率以及電流礦化效率得以增加,電能消耗得以降低。

