高分辨率CT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度的相關性
侯新新 李 培 關文華 袁 亮
2011年肺癌分類將肺腺癌分為浸潤前病變、微浸潤腺癌(minimally invasive adenocarcinoma,MIA)、浸潤性腺癌(invasive adenocar cinoma,IAC),且隨著影像學技術進步及人們對肺癌的警惕性提高,肺磨玻璃結節(ground Glass Nodule,GGO)的檢出率不斷提高,并有研究指出,應根據影像學預測肺腺癌病理亞型選擇合理的手術策略,以改善患者預后[1-2]。既往,研究多應用電子計算機斷層掃描(Computed Tomography,CT)特征參數,如結節大小、邊緣征象、CT值等來鑒別GGO的浸潤性,但準確性并不理想[3]。近年來,高分辨率CT(high resolution CT,HRCT)在腫瘤的診斷、分期及療效評估等方面應用價值逐漸提高,且HRCT定量測量可量化結節特征,其中標準化攝取值(standardized uptake valu,SUV)是HRCT中常用的半定量指標,臨床工作中常依靠SUV值協助疾病的良惡性診斷;而磨玻璃成分CT值(CT value of ground glass opacity,CTGGO)是反映病灶密度的指標,因浸潤前病變、MIA、IAC的病灶密度并不相同,或可將CTGGO用于患者浸潤情況的評估[4-5]。但目前并無相關研究證實HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度的關系,為驗證研究假設,本研究將重點觀察HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度的相關性。
1 材料與方法
1.1 一般資料
回顧性分析2018年6月~2019年12月在醫院接受手術治療的75例早期肺腺癌患者資料。納入標準:①經手術病理或支氣管鏡或經皮肺穿刺活檢證實;②接受HRCT檢查,HRCT檢查于術前1個月內進行;③HRCT檢查參數及臨床資料完整。排除標準:①在檢查前已接受相關治療;②合并其他惡性腫瘤;③合并肝病、糖尿病;④存在全身感染;⑤合并重要臟器損傷。75例早期肺腺癌患者中男性44例,女性31例;年齡42~77歲,平均年齡(58.28±3.26)歲;手術方式:肺葉切除術47例,肺段切除術20例,楔形切除術8例。
1.2 方法
1.2.1 HRCT檢查方法 采用德國Siemens Biograph mCT(64)型PET-CT儀,檢查前患者空腹4~6 h,控制血糖≤10 mmol/L,按體重3.70~7.77 MBq/kg靜脈注射顯像劑18F-氟脫氧葡萄糖(fluorodeoxyglucose,FDC),靜臥1 h后采集圖像,患者仰臥位,雙手抱頭,采集時間:2 min/床位,范圍從頭部到股骨中段,采用TrueD軟件進行圖像重建。PET-CT顯像后,使用同一設備對可疑GGO部位進行屏氣下HRCT掃描,采集及重建條件:管電壓140 kV,管電流根據人體解剖結構和組織密度自動調整,旋轉時間為0.5 s/圈,螺距0.6,層厚1.0 mm,層間距0.5 mm,矩陣512×512,肺窗(窗位-600 HU,窗寬1200 HU),縱膈窗(窗寬350 HU,窗位40 HU)。由2名5年以上工作經驗的影像學醫師進行閱片,若意見不一時,由更高級別的影像學醫師閱片得出結論。觀測記錄手術切除GGO數量,記錄GGO的HRCT資料,包括結節數量(孤立性、多灶性)、空泡征(有、無)、位置(外周、實質)、形狀(圓形/類圓形、不規則形)、邊緣(光滑、分葉)、支氣管走行(自然、擴張扭曲/截斷)、結節磨玻璃成分平均CT值(CTGGO,在HRCT圖像肺窗橫斷面選擇3個不同層面繪制圓形感興趣區,計算取平均值)、標準化攝取值(SUV,在CT肺窗與PET融合圖像上進行測量,選擇可將結節完全包含在內的圓形感興趣區,逐層測量,記錄SUV)。
1.2.2 早期肺腺癌浸潤程度 參照相關標準[6],包括不典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH,低密度純磨玻璃結節),原位腺癌(adenocarcinoma in situ,AIS,密度上高純磨玻璃結節),微浸潤腺癌(minimally invasive adenocarcinoma,MIA,混合磨玻璃結節),浸潤性腺癌(invasive adenocar cinoma,IAC,混合磨玻璃結節或實質結節)。根據病理亞型將AAH、AIS納入浸潤前組,MIA納入MIA組,IAC納入IAC組。
1.3 統計學方法

2 結果
2.1 早期肺腺癌浸潤程度
75例早期肺腺癌患者手術共切除86個GGO,其中GGO為AAH 6個、AIS 12個,納入浸潤前組,占20.93%(18/86);GGO為MIA 44個,納入MIA組,占51.16%(44/86);GGO為IAC 24個,納入IAC組,占27.91%(24/86)。
2.2 浸潤前組、MIA組與IAC組GGO的HRCT影像學資料比較
IAC組GGO的HRCT定量參數CTGGO、SUV水平均高于浸潤前組、MIA組,差異有統計學意義(P<0.05);浸潤前組與MIA組的GGO的HRCT定量參數CTGGO、SUV水平比較,差異無統計學意義(P>0.05);3組間其他GGO HRCT影像學資料比較差異無統計學意義(P>0.05),見表1。
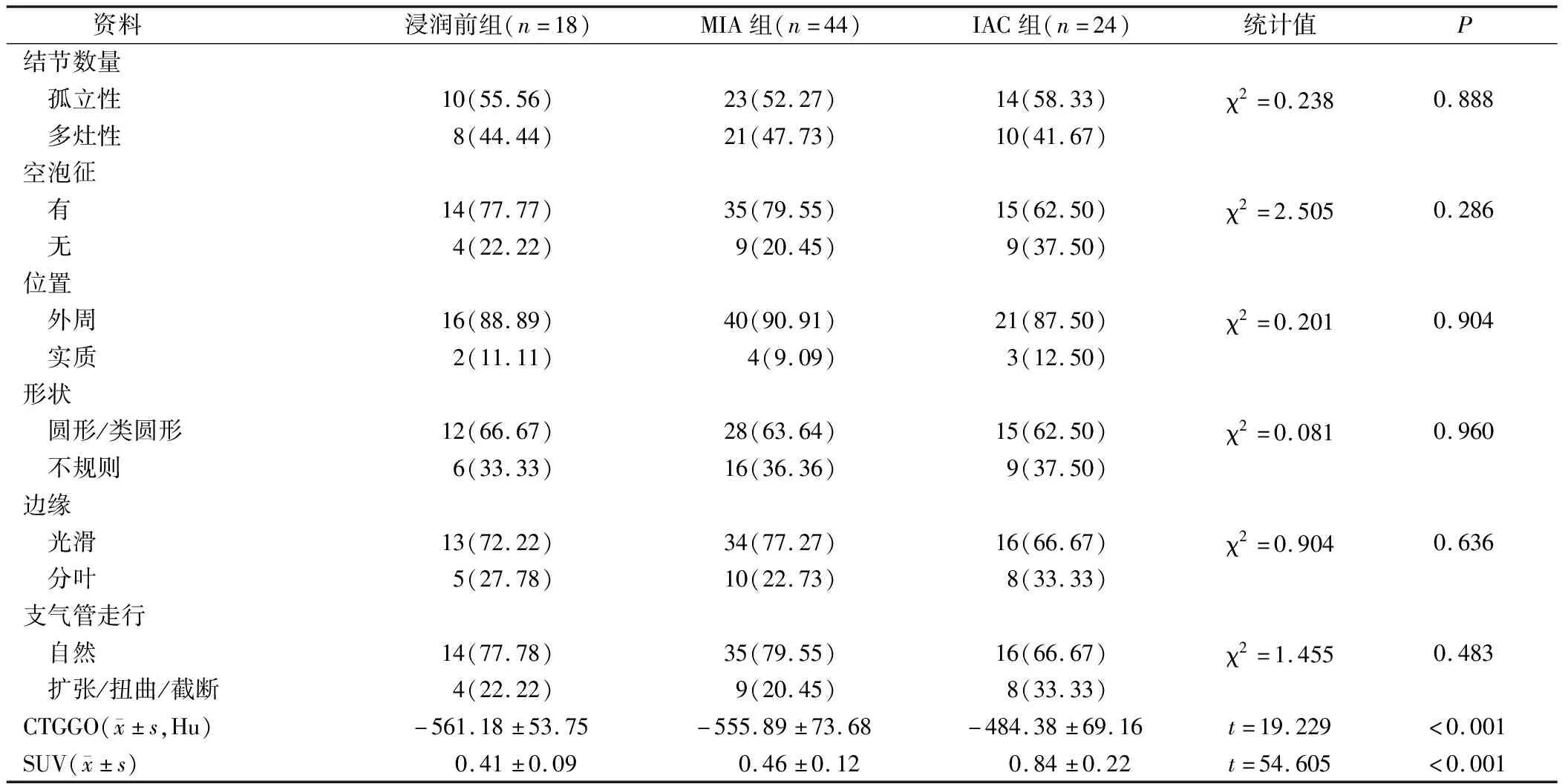
表1 浸潤前組、MIA組與IAC組GGO的HRCT影像學資料比較(個,%)
2.3 GGO HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度關系分析
經Kendall's tau-b相關性分析,結果顯示,GGO的HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度呈正相關(γ>0,P<0.05)。見表2。
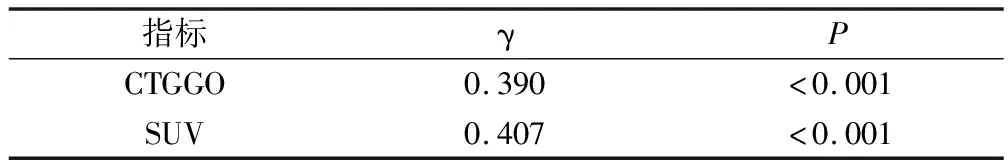
表2 GGO HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度相關性γ
2.4 GGO HRCT定量參數CTGGO、SUV水平預測GGO為IAC浸潤的價值分析
將GGO的HRCT定量參數CTGGO、SUV水平作為檢驗變量,GGO浸潤程度作為狀態變量(1=IAC,0=浸潤前、MIA),繪制ROC曲線(圖1)結果顯示,GGO HRCT定量參數CTGGO、SUV水平單獨及聯合預測GGO為IAC浸潤的AUC均>0.80,預測價值均較理想,且以聯合檢測價值最佳。各指標對應cut-off值、特異度、靈敏度及約登指數見表3。
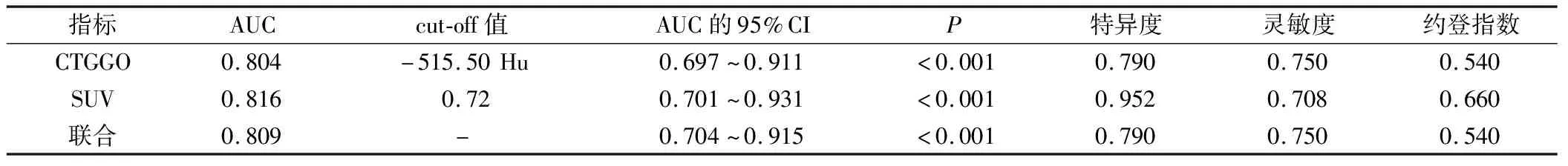
表3 GGO HRCT定量參數CTGGO、SUV水平預測GGO為IAC浸潤效能分析結果

圖1 GGO HRCT定量參數CTGGO、SUV水平預測GGO為IAC浸潤價值的ROC曲線圖
3 討論
GGO臨床表現無特異性,多見于分化較好的癌前病變,一般生長較為緩慢,若表現為肺癌,說明病理分期早,有手術治療機會,預后良好[7]。并有研究指出,GGO浸潤程度不同所采用的手術方式及預后均不同[8]。因此,早期預測GGO浸潤情況,對手術方式的選擇及保證良好的預后有重要意義。既往關于GGO的浸潤性鑒別研究多基于結節的形態學表現,如結節的形狀不規則、分葉等均是IAC浸潤的特征性表現[9]。但AAH、AIS、MIA、IAC在形態學中有大部分重疊,采用結節的形態特征鑒別GGO浸潤性的靈敏度及特異度均較低[10]。
HRCT可客觀量化結節的特征,如CT值參數、結節內實質性成分直徑、結節直徑等,其中CT值是既往臨床評估早期肺腺癌浸潤程度的重要指標,但有研究指出,部分早期肺腺癌患者采用CT值評估浸潤程度準確性并不高[11]。而CTGGO的測量方法是在HRCT圖像肺窗橫斷面選擇3個不同層面繪制圓形感興趣區,計算取平均值,相比于傳統CT值準確性更高[12]。SUV也是常見的HRCT指標,也可用于早期肺腺癌患者的評估中,且有國外報道指出,SUV值是一種葡萄糖代謝率的半定量指標,反映該處組織代謝的活躍程度,與腫瘤分裂增殖速度有關[13-14]。且有研究指出,SUV值預測肺癌患者預后不良風險有一定價值[15]。由此,猜測HRCT定量參數CTGGO、SUV水平可能與早期肺腺癌浸潤程度有關。
本研究結果顯示,IAC組HRCT定量參數CTGGO、SUV水平均高于浸潤前組、MIA組,初步說明GGO HRCT定量參數CTGGO、SUV水平的過表達可能與早期肺腺癌浸潤程度密切相關,且在進一步的Kendall's tau-b相關性中證實GGO HRCT定量參數CTGGO、SUV水平與早期肺腺癌浸潤程度呈正相關,即GGO HRCT定量參數CTGGO、SUV水平過表達,提示浸潤程度加重。簡單分析可能的原因,AAH、AIS、MIA、IAC在密度上是一個遞增過程,CTGGO可客觀反映病灶內部密度改變,在GGO IAC浸潤時,腫瘤細胞堆積層數較多、纖維成分受刺激增生或腫瘤細胞發生浸潤,病灶密度增加,病灶的CTGGO值顯著升高[16-17]。同時,腫瘤生長需要通過更多的糖代謝提供能量,來維持癌細胞的存活及不斷的增殖分化,在HRCT檢查前注射顯像劑18F-FDC,該顯像劑可參與人體代謝,而腫瘤病灶部位代謝旺盛,顯像劑在病灶部位高度聚集,通過HRCT檢查顯示出來,SUV值越大腫瘤攝取顯像劑的能力越強,而在GGO為IAC浸潤時因病灶進展,所需更多糖代謝,此時SUV水平更高[18-19]。因此不同的參數水平所表現的浸潤程度不同,或可考慮將上述參數用于早期肺腺癌浸潤程度的預測與評估。為驗證假設,本研究進一步繪制ROC曲線,結果顯示,HRCT定量參數CTGGO、SUV水平單獨及聯合預測GGO為IAC浸潤的AUC均>0.80,預測價值均較理想,且以聯合預測價值最佳,該結果證實HRCT定量參數CTGGO、SUV水平可用于早期肺腺癌浸潤程度的預測,對此可為未來早期肺腺癌患者的治療提出建議,入院時,可為患者測定GGO HRCT定量參數CTGGO、SUV水平,若提示二者水平異常過表達,可能提示GGO為IAC浸潤,可指導手術切除計劃的合理調整。
綜上所述,早期肺腺癌患者GGO HRCT定量參數CTGGO、SUV值與浸潤程度有關,隨著兩者檢測值升高,浸潤程度增加,且將兩者用于預測IAC有一定應用價值,可指導早期疾病手術方案的合理擬定。

