骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果不相符分析
金詠梅,劉雨涵,廖紅艷,蔣能剛
四川大學華西醫院實驗醫學科,四川成都 610041
白血病是造血系統的一種惡性疾病,在我國各年齡段惡性腫瘤的病死率較高,35歲以下人群病死率占據首位[1]。由于白血病是累及造血干細胞的異常克隆性病變,具有高度異質性,傳統的法、美、英分型系統(即FAB分型系統)的形態學分型是一種診斷白血病分型的重要方法。隨著科學技術的發展進步,應用形態學、免疫學、細胞遺傳學、分子生物學方法對白血病進行分型,提高了對其診斷效率,在白血病療效觀察和預后監測方面也具有重要的臨床意義[2]。骨髓涂片細胞學檢查雖然誤診率、漏診率較高,但其對于具有典型細胞特征的疾病有著較好的識別度。本文旨在通過對5 373例疑診血液病患者骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果不相符的原因進行回顧性分析,以達到提高二者的一致率、改進檢驗服務質量的目的。
1 資料與方法
1.1一般資料 選取2019年3月至2020年3月由本科接收且具有骨髓涂片細胞學檢查及流式細胞免疫分型檢測結果的疑診血液病患者5 373例作為研究對象。所有研究對象診斷結果由實驗室信息系統導出,且均為本院根據形態學、細胞組化、細胞免疫學、分子遺傳學等方法確診的門診或住院患者。
1.2標本采集 研究對象俯臥位取髂后上棘,特殊情況取髂前上棘無菌操作抽取0.2 mL骨髓制作骨髓涂片供細胞形態分析。另將2.0 mL骨髓液注入肝素鈉抗凝管中,混勻后進行流式細胞免疫分型檢測。
1.3儀器與試劑 流式細胞儀使用美國BD公司的產品,型號為FACS CantoⅡ。儀器使用的鞘液、破膜劑、溶血劑及單克隆抗體均由美國BD公司提供。
1.4方法
1.4.1骨髓涂片細胞學檢查 骨髓涂片加瑞氏姬姆薩混合染液3~5滴,覆蓋骨髓膜整體,稍等20 s 后加緩沖液6~8滴混勻,染色時間為15~20 min,用流動的水從玻片的一側沖洗染液,待其自然干燥或者用吸水紙吸干后鏡檢。(1)低倍鏡:觀察材料、涂層、染色是否合格,根據鏡下骨髓渣旁造血組織、脂肪組織的比例判斷有核細胞增生情況。首先觀察巨核細胞的數量及骨髓涂片邊緣和尾部是否有大的或多個特殊的病理細胞。(2)使用油鏡分類200個有核細胞(不包括有絲分裂的細胞和破碎的細胞)。根據各種細胞的類型和發育階段的記錄,計算其百分率,并仔細觀察各個系、各個階段的細胞形態是否處于正常。根據有核細胞增生程度和白血病細胞所占比例,通過世界衛生組織(WHO)形態學分型標準對細胞形態進行分析。
1.4.2流式細胞免疫分型檢測 采用SSC/CD45設門和若干個帶熒光標記的單克隆抗體檢測患者骨髓細胞的抗原表達。陽性判斷標準:對一般細胞膜抗原陽性細胞>20%為陽性,對CD34和胞漿抗原>10%為陽性。確定細胞類型參照歐洲白血病免疫學分型研究組制定的積分系統,計算各個抗原的細胞系列積分并進行判斷。
2 結 果
2.1檢測結果總不相符的病例情況 研究對象中骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果總不相符的病例共352例(6.55%),其中包括急性白血病病例、檢出異常細胞病例、其他病例。
2.2檢測結果不相符的急性白血病病例情況 研究對象中骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果不相符的急性白血病病例共32例,包括24例急性髓系白血病(AML)病例,8例急性淋巴細胞白血病(ALL)病例。見表1。
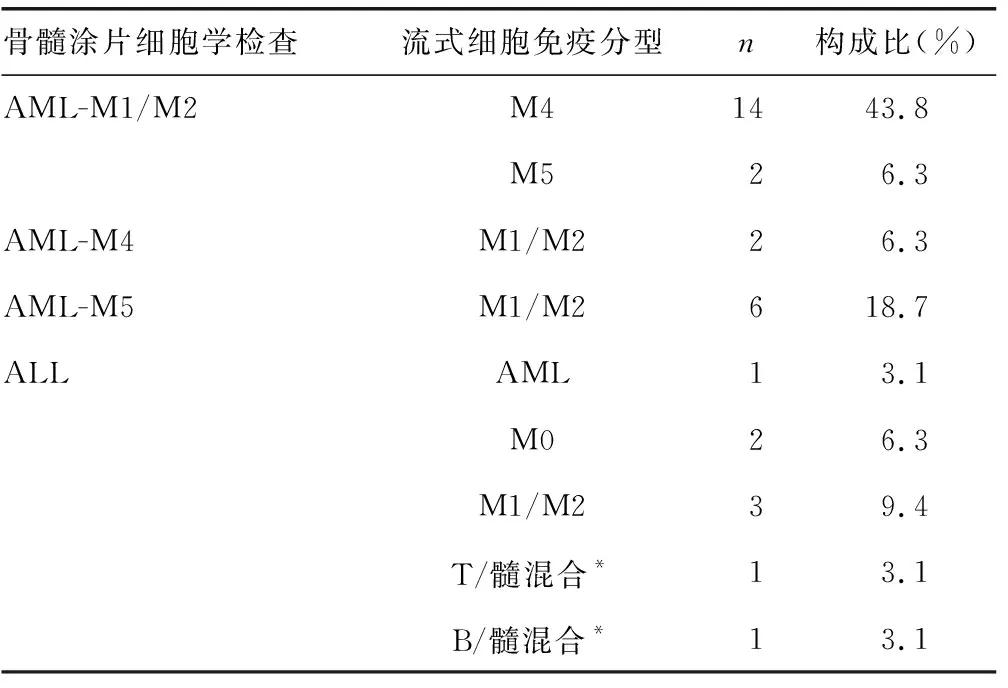
表1 檢測結果不相符的急性白血病病例情況
2.3檢測結果不相符的異常細胞病例情況 研究對象中骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果不相符的異常細胞病例共318例,占總不相符病例的90.34%。其中骨髓涂片細胞學檢查結果為異常漿細胞,而流式細胞免疫分型檢測結果為異常B淋巴細胞、異常T淋巴細胞、淋巴細胞增殖性疾病(LPD)、未見異常的病例共14例;骨髓涂片細胞學檢查結果為未見異常,而流式細胞免疫分型檢測結果為異常原始粒細胞、異常B淋巴細胞、異常T淋巴細胞、異常漿細胞、異常單核細胞、異常自然殺傷細胞(NK細胞)、LPD病例共216例;骨髓涂片細胞學檢查結果為其他異常,流式細胞免疫分型檢測結果為未查見異常表型細胞病例共88例。見表2。

表2 兩種方法檢測結果不相符的異常細胞病例情況
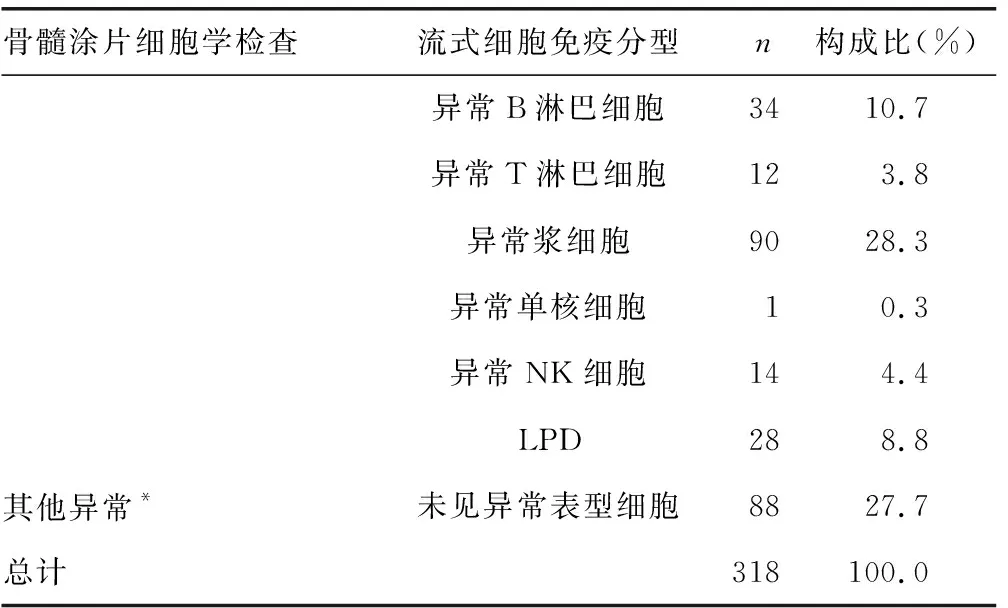
續表2 兩種方法檢測結果不相符的異常細胞病例情況
2.4檢測結果不相符的其他病例情況 研究對象中骨髓涂片細胞學檢查結果為增生性貧血而流式細胞免疫分型檢測結果為異常漿細胞和異常B淋巴細胞病例共2例。
3 討 論
骨髓涂片細胞學檢查是一種檢查血液疾病及多種疑難雜癥的重要手段,同時也是多種疾病預后、骨髓造血功能恢復效果的重要判斷指標之一[3]。它能夠通過簡易的工具制片,再由顯微鏡人工觀察骨髓細胞的形態、數量、分類、比例,從而得出相應診斷,該檢查方法以細胞形態為分型依據[4-5]。在實際的臨床工作中,骨髓涂片細胞學檢查結果易受到多種因素的影響,導致結果出現明顯差異,加之各實驗室的結果缺乏認同性,容易造成對疾病的漏診、誤診[6-7]。隨著流式細胞免疫分型檢測應用于臨床,其對于白血病的診斷起到了重要作用。它能夠快速地對細胞及亞細胞的構造進行檢測,能夠更好地認知健康狀態下的造血系統,并能對具有明確免疫表型特點的血液惡性疾病進行描述。流式細胞免疫分型檢測的優點主要為檢測速度快、測量指標多、靈敏度高等,提高了異常細胞計數準確性、精密度且能報告多項研究參數[8-9]。白血病細胞分為B淋巴細胞系、T淋巴細胞系、髓細胞系及紅細胞系和巨核細胞系,每種細胞系所表達抗原的不同是區分白血病細胞的關鍵[10-11]。這些免疫標志物能夠反映正常細胞在變為惡性腫瘤過程中細胞基因及抗原標志所發生的變化,而這種細微變化在顯微鏡下無法進行有效辨別。尤其是當骨髓涂片細胞學檢查對異常細胞難以區別時,各種血液腫瘤的診斷、鑒別診斷就主要依賴于流式細胞免疫分型檢測。
研究對象中骨髓涂片細胞學檢查與流式細胞免疫分型檢測結果不相符的AML病例共24例,其不相符原因主要體現在白血病細胞的形態識別,尤其是在有單核細胞成分的AML-M4/M5中。流式細胞免疫分型通過對特異性的熒光抗體進行檢測,直指白血病細胞本質,能夠更好地對是否有單核細胞進行判定,此種情況下建議骨髓涂片細胞學結合流式細胞免疫分型檢測結果進行分析。對于混合細胞型白血病來說,其發生率極低,由于是跨系別混合,細胞來源混亂,不能僅依靠骨髓涂片細胞學檢查進行分型,而是需要流式細胞免疫分型檢測對其進行診斷,同時還需要結合分子遺傳學檢測。建議骨髓涂片細胞學檢查不能明確區分系列的急性白血病病例,應參考流式細胞檢測結果進行分型。ALL的白血病細胞個體差異極大,僅憑肉眼難以區別T/B淋巴細胞,亦不能對細胞劃分發育階段。骨髓涂片細胞學檢查報告為ALL,臨床仍需要流式細胞免疫分型檢測結果進一步分型。
對于異常細胞的檢測,骨髓涂片細胞學檢查與流式細胞免疫分型檢測各有優缺點。骨髓涂片細胞學檢查觀察的視野有限,檢測限較低,但對于寄生蟲、病原菌及海藍細胞等形態上明顯有別于正常細胞的特殊細胞具有優勢。流式細胞免疫分型檢測限可以達到10-4,甚至更高,但流式細胞免疫分型檢測對異常細胞的判定一般只基于細胞表型,對標本質量要求較高,同時也會受到熒光抗體種類及數量的制約。唯有將兩種檢測方法結合起來考慮才能進一步提高異常細胞的檢出率。
總之,流式細胞免疫分型檢測異常細胞既快速且高效,若同時再聯合骨髓涂片細胞學檢查,可避免由于表面膜抗原標記缺乏或異常細胞在治療過程中某些標志丟失或改變,或骨髓標本采集時過度稀釋等造成流式細胞免疫分型檢測結果的假陰性,進一步提高異常細胞檢出率,在疾病的療效評估及預后監測中都具有重要意義[12]。流式細胞免疫分型檢測由于其廣泛的適用性和快速出檢測結果,是微小殘留病灶檢測的首選方法[13-15]。雖然流式細胞免疫分型檢測優點突出,但是骨髓涂片細胞學檢查仍然不可拋棄。如何提高骨髓涂片細胞學檢查準確性、診斷符合率便是當下需要著重探討的問題,后期將進一步深入研究。

