特發性肺間質纖維化患者預后不良的影響因素及預測價值
劉薇,張玲,鮑潔,高勇
(河北省胸科醫院呼吸與危重癥醫學一科,河北 石家莊 050000)
特發性肺間質纖維化是一種彌漫性結構破壞性肺部疾病,目前發病機制尚未完全闡明,多數研究者認為是由于肺泡上皮細胞受損后分泌過多的纖維生長因子和細胞因子,使上皮間質轉化,活化成纖維細胞,形成成纖維細胞灶,并出現細胞外基質大量沉積,最終形成纖維條索并牽拉周圍肺組織形成蜂窩肺[1-2]。該病起病較為隱匿,早期以肺泡炎為主,多表現為干咳少痰、胸悶、進行性呼吸困難等,影像學可見胸膜或雙下肺網格狀、磨玻璃狀陰影,活檢可見成群的纖維細胞灶[3]。以>40歲的男性多見,且預后較差,其中位生存期為2~3年,5年生存率<50%。隨著病情的進展,極易引發低氧血癥、肺源性心臟病、肺栓塞、彌漫功能性障礙等疾病,疾病后期多數患者因肺功能惡化引起的呼吸衰竭而死亡[4-5]。因此,盡早了解特發性肺間質纖維化患者預后情況,尋找可準確監測患者病情進展的指標,提早進行有效干預,對延長患者的生存時間,改善患者生活質量有重要意義。本研究旨在探討特發性肺間質纖維化患者預后不良的影響因素及預測價值。
1 資料與方法
1.1 一般資料
選取2019年5月至2021年5月河北省胸科醫院60例診斷為特發性肺間質纖維化的患者為研究對象。納入標準:(1)符合2015年美國胸科學會(ATS)聯合歐洲呼吸學會(ERS)、日本呼吸學會(JRS)以及拉丁美洲胸科協會(ALAT)頒布的特發性肺間質纖維化治療指南中的相關診斷標準[6],且經影像學檢測證實;(2)近兩個月內未服用過免疫抑制劑或皮質類固醇藥物;(3)自愿配合本次研究并簽署知情同意書,符合醫學倫理性原則。排除標準:(1)合并其他呼吸系統疾病,如肺癌、支氣管哮喘、支氣管擴張癥、胸廓畸形、慢性阻塞性肺疾病等;(2)血流動力學不穩定(如急性左心衰、頑固性低血壓、惡性心律失常、不穩定性心絞痛、近1個月內有急性心肌梗死病史等);(3)合并其他系統性疾病的患者,如嚴重肝、腎功不全、惡性腫瘤、神經肌肉疾病或嚴重腦血管意外后遺癥者;(4)影響肌力的神經系統疾病,患有不穩定的骨折;(5)患有精神類疾病;(6)合并深靜脈血栓的患者。
1.2 方法
1.2.1 治療方法 所有患者均接受口服吡非尼酮(北京凱因科技股份有限公司)治療,初始劑量200 mg/次,治療第2周400 mg/次,治療第3周開始增加至600 mg/次,3次/d,于餐后服用,持續服用4個月[7]。
1.2.2 療效評估及分組 顯效為患者咯痰、咳嗽及肺部啰音等癥狀明顯減輕,X線胸片或高分辨率CT(HRCT)異常影像明顯減少;有效為患者臨床癥狀及體征有所緩解,X線胸片或HRCT異常影像略有減少;無效為患者各項癥狀均無變化或出現病情加重的情況,X線胸片或HRCT異常影像增多,特別是出現了蜂窩肺或肺動脈高壓跡象。治療4個月后,將顯效和有效共44例歸為預后良好組,無效16例歸為預后不良組。
1.3 觀察指標
(1)一般資料:包括患者性別、年齡、病程、酗酒、吸煙、干咳、胸悶情況、肺功能[肺總量(TLC)、肺活量(VC)及第1秒用力呼氣量/用力肺活量(FEV1/FVC)]、氧分壓(PaO2)、腫瘤壞死因子α(TNF-α)、白細胞介素4(IL-4)、干擾素γ(IFN-γ)表達水平;(2)影響特發性肺間質纖維化患者預后的因素;(3)危險因素對特發性肺間質纖維化患者預后不良的預測價值。
1.4 統計學分析

2 結果
2.1 兩組患者一般資料比較
兩組患者年齡、干咳、PaO2及TNF-α、IL-4、IFN-γ表達水平比較,差異有統計學意義(P<0.05)。見表1。
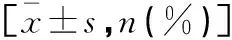
表1 兩組患者一般資料比較
2.2 影響特發性肺間質纖維化患者預后的因素
將一般資料中可能影響特發性肺間質纖維化患者預后的因素納入多因素Logistic回歸分析方程,以是否預后不良為因變量,各項因素為協變量。排除混雜因素后結果顯示,PaO2、TNF-α、IL-4、IFN-γ是特發性肺間質纖維化患者預后不良的危險因素(P<0.05)。見表2。
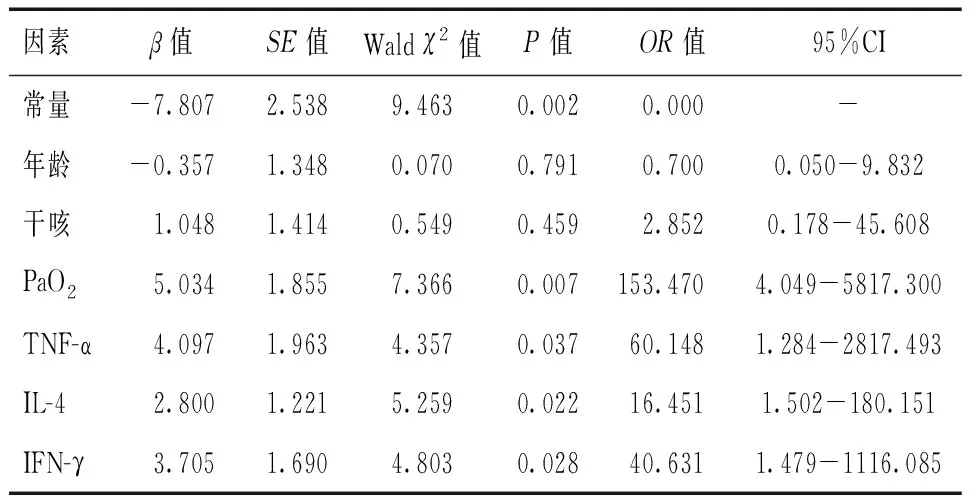
表2 影響特發性肺間質纖維化患者預后的因素
2.3 危險因素對特發性肺間質纖維化患者預后不良的預測價值
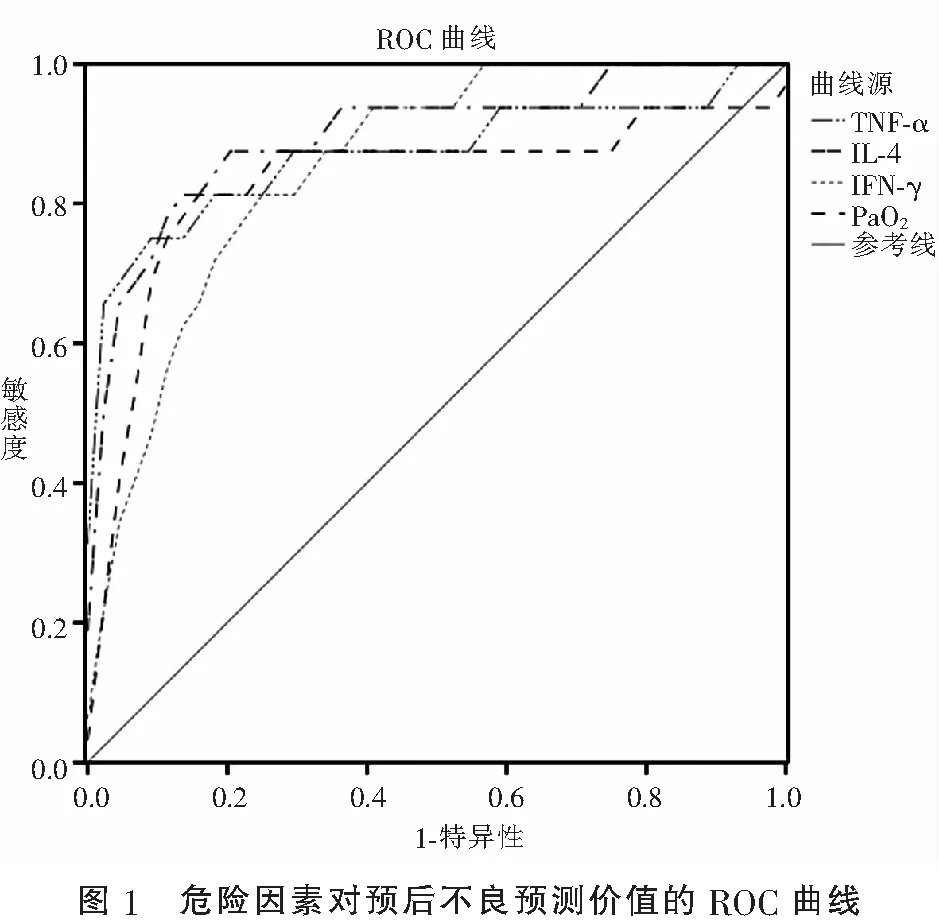
ROC曲線分析顯示,PaO2、TNF-α、IL-4、IFN-γ的AUC分別為0.831、0.875、0.901和0.855;cut-off值分別為50.61 mmHg、12.91 pg/mL、66.52 pg/mL和23.22 pg/mL。其中IL-4Y預測價值較高(P<0.05),PaO2、TNF-α和IFN-γ預測價值中等(P<0.05)。見表3及圖1。

表3 危險因素對預后不良的預測價值
3 討論
目前治療特發性肺間質纖維化除肺移植外并無有效的治愈方法,臨床上主要采用免疫抑制與激素進行治療,盡量減緩病情發展,降低肺功能下降速度,改善患者已發生纖維化的程度,避免出現急性加重情況,以期減輕患者痛苦,延長患者壽命,改善患者生活質量等。本研究60例患者均采用吡非尼酮治療4個月,患者臨床表現及細胞因子指標均有所改善。吡非尼酮是一種光譜抗纖維化藥物,具有抗氧化和抗炎的作用,能減少TNF-α的生成,同時降低PDGF、TGF-β1和IGF-I的水平,抑制膠原合成,從而抑制成纖維細胞增殖,減少細胞外基質沉積,起到抗纖維化的作用,使患者肺功能得到改善,延緩疾病進展[9-11]。
本研究對比兩組特發性肺間質纖維化患者預后情況,單因素分析發現,年齡、干咳、PaO2、TNF-α、IL-4、IFN-γ表達水平存在差異(P<0.05)。多因素排除混雜因素后PaO2、TNF-α、IL-4、IFN-γ指標為預后不良的危險因素(P<0.05)。研究[12-13]顯示,年齡是特發性肺間質纖維化的危險因素之一,而本研究未得出此結論,原因可能由于病例數較少,患者年齡散無法較好的形成統計學模型。ROC曲線分析顯示,PaO2、TNF-α、IL-4和IFN-γ四項指標的診斷價值均在中等以上(P<0.05),有較高的預測診斷意義。動脈血從肺內攝取O2,形成PaO2,PaO2的高低反映了肺毛細血管攝氧狀況,也是反映外呼吸狀況的指標。特發性肺間質纖維化患者因肺間質炎性反應及肺間質纖維增生,使吸入的氧氣無法彌散入血管,造成患者缺氧、憋喘、呼吸困難等癥狀,過度通氣也進一步降低了患者PaO2水平。本研究結果驗證了這個結論,預后不良組患者PaO2水平較預后良好組偏低,且用于預測預后不良有一定的價值(P<0.05)。TNF-α為炎癥級聯反應的調節因子,是中性粒細胞和嗜酸性粒細胞的趨化因子,能刺激產生超氧化物,釋放溶酶體,可刺激成纖維細胞聚集并快速增殖,促進膠原蛋白的合成,增加成纖維細胞的基因表達促進纖維化。TNF-α與肺泡上皮細胞表面受體結合,引起肺泡上皮細胞出現凋亡、壞死、脫屑、再生,損傷的細胞組織會產生更多TNF-α,持續誘發炎癥形成纖維化。TNF-α還可與巨噬細胞產生的纖維連接蛋白共同作用于受損的肺組織加重炎癥反應,形成急性肺泡炎[14-15]。IL-4是Th2中最具代表性的因子,主要由嗜酸性細胞和殺傷T細胞產生,在天然免疫和適應性免疫反應中均起到了關鍵性作用。肺泡上皮細胞損傷刺激嗜堿性粒細胞分泌IL-4,IL-4則刺激樹突狀細胞向其他免疫細胞呈遞抗原并影響巨噬細胞的交替激活,由IL-4激活的巨噬細胞產生膠原分解因子基質金屬蛋白酶-12,誘導損傷后的纖維化反應[16]。IL-4能刺激成纖維細胞大量增殖,引起肺組織結構重塑,肺泡壁基底膜增厚同時出現彌散性上皮纖維化,從而導致肺順應性降低,肺功能逐漸下降[17]。IFN-γ是Th1的標志性細胞因子,具有抗病毒,抗腫瘤和免疫調控的作用,而且可拮抗調節IL-4的致纖維作用。有觀點認為Th1和Th2平衡失調導致由此介導的免疫反應參與的肺損傷是引起肺間質纖維化的發病機制。目前已證實當Th2高表達時會發生肺間質纖維化,因IL-4在Th2中最具代表性,通過研究IL-4水平的變化可較直觀地闡明Th2在肺間質纖維化患者的水平變化。當IFN-γ水平較低時,對IL-4纖維作用的拮抗能力減弱,使更多的纖維母細胞被激活,導致肺間質膠原沉積形成瘢痕[18-19]。本研究預后不良組IL-4水平高于預后良好組(P<0.05),IFN-γ水平則低于預后良好組(P<0.05),且IL-4指標的AUC值>0.90,因此分析IL-4和IFN-γ表達水平,可較好地預測特發性肺間質纖維化患者的預后情況。
綜上所述,PaO2、TNF-α、IL-4、IFN-γ水平是特發性肺間質纖維化患者預后的危險因素,且具有較高的預后預測診斷價值。

