轉(zhuǎn)運基因?qū)Υ竽c桿菌利用木糖產(chǎn)L-乳酸的影響
劉汝婷, 劉 棗, 王金華, 高 娃
(1 湖北工業(yè)大學(xué)生物工程與食品學(xué)院, 湖北 武漢 430068;2 發(fā)酵工程教育部重點試驗室,湖北 武漢 430068; 3 工業(yè)發(fā)酵湖北省協(xié)同創(chuàng)新中心,湖北 武漢 430068)
乳酸中L-乳酸是廣泛存在和使用的物質(zhì),大多運用于食品、化妝品、制藥、紡織和化學(xué)領(lǐng)域[1-2]。目前,L-乳酸的應(yīng)用已經(jīng)擴(kuò)展到可降解塑料工業(yè)。其中的聚乳酸(PLA)可作為生物降解和生物相容的高分子材料[3-4]。近年,人們環(huán)保意識不斷提高,對綠色包裝產(chǎn)品的需求量增大,驅(qū)動了聚乳酸(PLA)的大量生產(chǎn)[3]。木質(zhì)纖維素在自然界廣泛存在,其水解液含有大量五碳糖和六碳糖,主要有葡萄糖和木糖[5-7]。纖維素生物質(zhì)是目前最豐富的非食物資源,是L-乳酸發(fā)酵的潛在底物原料,既可避免與民爭糧的局面[8-9],還可解除發(fā)酵過程中葡萄糖對其他碳源利用抑制問題[10]。為進(jìn)一步削弱葡萄糖效應(yīng)對五碳糖的阻遏,通過基因工程技術(shù)對大腸桿菌進(jìn)行遺傳改造。除了與磷酸烯醇式丙酮酸-糖類磷酸轉(zhuǎn)移酶系統(tǒng)(PTS)[11]密切相關(guān),葡萄糖效應(yīng)還與甲基半乳糖苷轉(zhuǎn)運系統(tǒng)mglB、半乳糖轉(zhuǎn)運系統(tǒng)galP等非PTS系統(tǒng)相關(guān)。江吉雄等[12]通過敲除mglB和galP基因,降低了混合糖發(fā)酵D-乳酸中的葡萄糖效應(yīng),使發(fā)酵周期縮短了約40%左右,轉(zhuǎn)化率提高了2.30%;許瓊丹等[13]通過敲除ptsG和mglB基因,也降低了混合糖發(fā)酵乙醇中的葡萄糖效應(yīng),使發(fā)酵周期縮短了約36%左右,轉(zhuǎn)化率提高了5.80%。
基于此,本研究以WL210為出發(fā)菌株。該菌株可高效利用葡萄糖產(chǎn)L-乳酸,通過RED同源重組技術(shù)構(gòu)建mglB基因缺陷菌株WL220,mglB/galP雙基因缺陷菌株WL230,以減弱葡萄糖阻遏效應(yīng),提高混合糖中木糖的利用率,為采用基于木質(zhì)纖維素等可再生原料高效生產(chǎn)L-乳酸提供理論基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1菌株與質(zhì)粒本文所用的菌株和質(zhì)粒見表1。
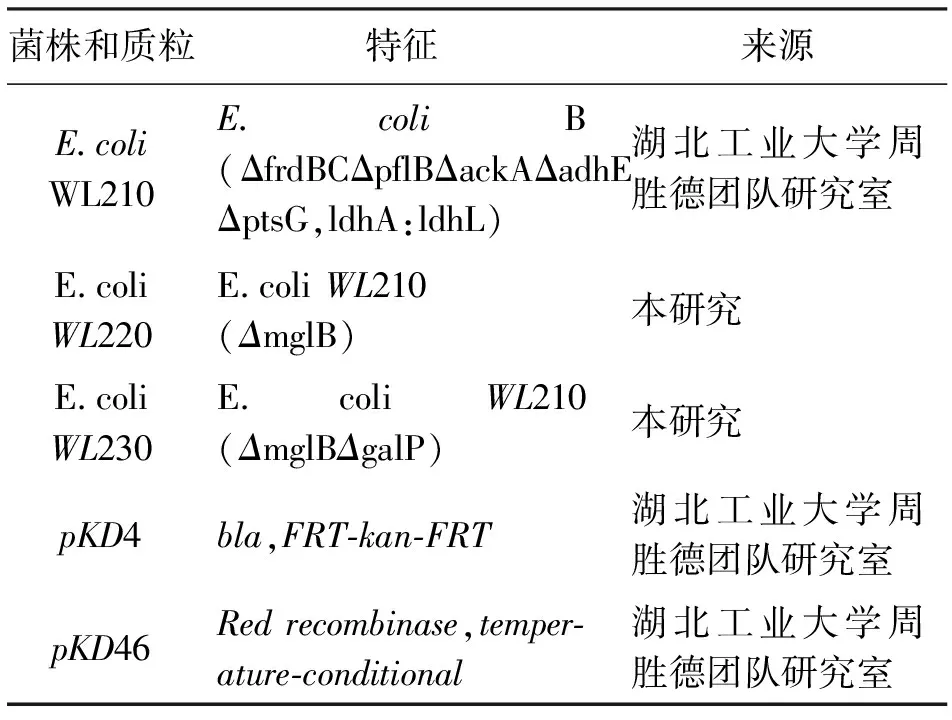
表1 本研究所用的菌株和質(zhì)粒
1.1.2化學(xué)試劑與儀器CaCl2·2H2O、L-阿拉伯糖,國藥集團(tuán)化學(xué)試劑有限公司;DL5000DNAMarker,PCRMasterMix,美國Fermentas公司;10×TE溶液、氨芐青霉素、卡那霉素,浙江Mersco公司;PCR引物合成,上海生工生物工程技術(shù)服務(wù)有限公司。
MicroPluser電轉(zhuǎn)儀(美國Bio-Red公司),MycyclerPCR儀(美國GC公司),Waterse2695型高效液相色譜儀(美國Waters公司),SartoriusBB-8846880發(fā)酵罐(德國SartoriusStedimBiotech公司)。
1.1.3培養(yǎng)基LB液體培養(yǎng)基:1%胰蛋白胨,0.5%酵母粉,0.5%NaCl。LB固體培養(yǎng)基:1%胰蛋白胨,0.5%酵母粉,0.5%NaCl,2%瓊脂粉。選擇培養(yǎng)基:LB固體培養(yǎng)基加抗生素(50μg/mL氨芐青霉素或卡那霉素)。種子培養(yǎng)基:LB液體培養(yǎng)基中加20g/L葡萄糖。
1.2 方法
1.2.1 mglB和galP基因的敲除PCR引物設(shè)計mglB和galP基因的敲除PCR引物設(shè)計如表2所示。

表2 敲除基因的引物與驗證引物
根據(jù)mglB和galP序列設(shè)計敲除引物分別為ΔmglB-P1、ΔmglB-P2、ΔgalP -P1、ΔgalP -P2,如表2所示,該對引物5′端45bp片段與mglB和galP序列同源,以18-20bp(表2中下劃線序列)與質(zhì)粒pKD4上FRT-kan-FRT閱讀框序列同源,以pKD4質(zhì)粒為模板,用擴(kuò)增引物ΔmglB-P1、ΔmglB-P2、ΔgalP -P1、ΔgalP -P2進(jìn)行PCR擴(kuò)增,獲得帶有kan抗性基因的敲除片段,經(jīng)乙醇沉淀過夜后,切膠回收。使用CaCl2法[14]將pKD46轉(zhuǎn)化至WL210的細(xì)胞中,通過氨芐平板篩選得到陽性菌落WL210/pKD46。挑選WL210/pKD46單菌落細(xì)胞接種于LB液體培養(yǎng)基中,30℃條件下培養(yǎng)至OD600為0.4~0.7;冰水浴35min后,用去離子水洗滌5次以上,棄去上清,得到感受態(tài)細(xì)胞WL210/pKD46懸浮液;取90μL的菌液和9μL打靶片段混勻后進(jìn)行電轉(zhuǎn)。將電擊后的菌液轉(zhuǎn)移到預(yù)熱37℃LB液體培養(yǎng)基中,150r/min條件下復(fù)蘇2h,涂布于選擇性培養(yǎng)基,37℃過夜培養(yǎng)。挑取單菌落為模板,采用鑒定引物ΔmglB-P1、ΔmglB-P2進(jìn)行PCR驗證。將成功敲除mglB基因的WL210菌株命名為WL220。
敲除galP基因方法與敲除mglB基因方法相同。將成功敲除galP基因的WL220菌株命名為WL230。
1.2.3發(fā)酵實驗挑選單菌落WL210、WL220、WL230接種于含有50mLLB液體培養(yǎng)基的錐形瓶中,150r/min,37℃過夜培養(yǎng)12h至OD為1.20左右。以10%的接種量接種至含有4L無菌培養(yǎng)基中,其碳源分別為6%葡萄糖、6%木糖、6%混合糖(3%葡萄糖和 3%木糖),發(fā)酵條件為37℃、200r/min,發(fā)酵時采用3mol·L-1的氫氧化鈣作為中和劑,控制發(fā)酵液pH為6.80。定時定點取樣,測定菌體濃度OD600,糖濃度及L-乳酸濃度。每次發(fā)酵實驗進(jìn)行3次平行實驗。
1.2.4發(fā)酵產(chǎn)物檢測分析菌體濃度測定采用可見光分光光度計測定波長600nm下OD600值。L-乳酸采用生物傳感儀檢測法[15];葡萄糖、木糖檢測采用高效液相色譜分析,色譜柱為Bio-RadHPX87H,流動相為4mmol·L-1H2SO4,流速0.5mL/min,柱溫40℃, 檢測器為PDA、ELS檢測器[16]。
2 結(jié)果與分析
2.1 重組菌E.coli WL230的構(gòu)建
以出發(fā)菌WL210為對照,基因內(nèi)部驗證引物對菌株WL230進(jìn)行PCR驗證,其結(jié)果如圖1所示。

1-E.coli WL210ΔmglB菌落PCR結(jié)果;2-E.coli WL210ΔgalP菌落PCR結(jié)果;3、4-菌株E.coli WL230菌落PCR結(jié)果圖 1 E.coli WL210菌株敲除mglB 和galP基因的電泳圖
WL210可擴(kuò)增出半乳糖轉(zhuǎn)運系統(tǒng)基因galP和甲基半乳糖苷轉(zhuǎn)運系統(tǒng)基因mglB片段。基因片段長度分別為910bp和1475bp。圖1中結(jié)果符合預(yù)期,表明重組菌E.coliWL230的mglB、galP片段敲除成功。
2.2 三菌株利用葡萄糖能力對比
為了探究三菌株利用單糖葡萄糖的能力,以6%葡萄糖為碳源,對比WL210,WL220(WL210ΔmglB)、WL230(WL210ΔmglBΔgalP)的菌體生長情況,結(jié)果如圖2所示。菌株WL210、菌株WL220菌株WL230最大OD600分別為8.13、7.26、6.80。說明敲除基因后的菌株葡萄糖的消耗速率降低,菌體生長速率變慢。

圖 2 三菌株單糖發(fā)酵(6%葡萄糖)的菌體生長情況
由圖3可知,在利用葡萄糖方面,菌株WL210、菌株WL220、菌株WL230發(fā)酵結(jié)束時間分別為21h、24h、30h,平均耗糖速率分別為2.86g/(L·h)、2.50g/(L·h)、2.42g/(L·h)。
三菌株后期耗糖速率都變慢。與出發(fā)菌WL210相比,菌株WL220和菌株WL230利用葡萄糖的平均速率分別降低了12.50%、15.42%,發(fā)酵周期分別延長了14.28%、42.86%。在生產(chǎn)乳酸方面,菌株WL210、菌株WL220、菌株WL230最終乳酸產(chǎn)量分別為48.90g/L、47.10g/L、46.40g/L,生產(chǎn)強度分別為1.63g/(L·h)、1.57g/(L·h)、1.55g/(L·h)。對比出發(fā)菌WL210,菌株WL220、菌株WL230的生產(chǎn)強度分別降低了3.68%、5.11%。表明敲除ΔmglB、ΔgalP基因后,葡萄糖的消耗速率降低。

圖 3 三菌株利用6%葡萄糖發(fā)酵產(chǎn)L-乳酸能力比較
結(jié)果表明,mglB、galP兩個基因可以明顯降低大腸桿菌利用葡萄糖的能力,并且三菌株中mglB/galP雙基因缺陷菌株WL230生物量最大。
2.3 三菌株利用木糖能力對比
為了探究三菌株利用單糖木糖的能力,以6%木糖為碳源,對比WL210,WL220、WL230的菌體生長情況,結(jié)果如圖4所示。菌株WL210發(fā)酵30h時,OD達(dá)到最大5.82后進(jìn)入穩(wěn)定期;WL220在42h時OD值達(dá)到最大6.01,WL230在48h時OD值達(dá)到最大6.59。雖然WL210最先進(jìn)入穩(wěn)定期,但其最大OD值是三菌株中最小,而WL220和WL230的最大OD值分別為WL210最大OD值的1.03倍、1.13倍。在30h之前,菌株WL210的生物量高于菌株WL220和菌株WL230;30h之后,菌株WL230的生物量都高于菌株WL210和菌株WL220。表明敲除基因后的菌株木糖消耗速率加快,菌體生長速率變快。
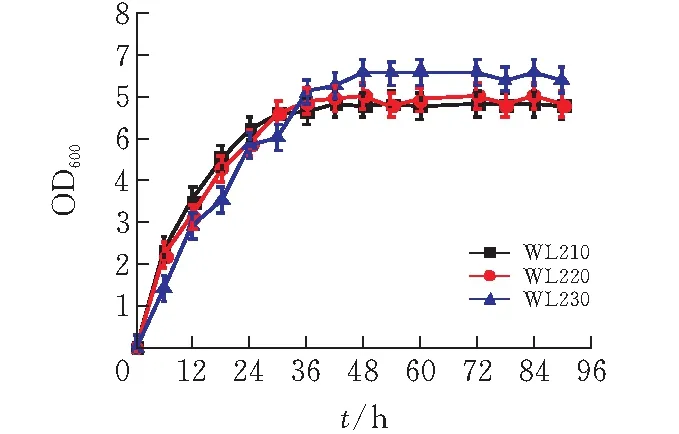
圖 4 三菌株單糖發(fā)酵(6%木糖)的菌體生長情況
由圖5可知,在利用木糖方面,菌株WL210、菌株WL220、菌株WL230發(fā)酵結(jié)束時間分別為90h、84h、78h,平均耗糖速率分別為0.67g/(L·h)、0.71g/(L·h)、0.76g/(L·h)。
對比出發(fā)菌WL210,菌株WL220和菌株WL230利用木糖的平均速率分別降低了7.14%、15.38%,發(fā)酵周期分別縮短了6.67%、15.38%。在生產(chǎn)乳酸方面,菌株WL210、菌株WL220、菌株WL230最終乳酸產(chǎn)量分別為43.12g/L、 45.98g/L、50.12g/L,生產(chǎn)強度分別為0.51g/(L·h)、0.59g/(L·h)、0.69g/(L·h)。對比出發(fā)菌WL210,菌株WL220、菌株WL230的生產(chǎn)強度分別提高了14.84%、35.60%。表明敲除ΔmglB、ΔgalP基因后,消耗木糖速率加快。

圖 5 三菌株利用6%木糖發(fā)酵產(chǎn)L-乳酸能力比較
2.4 三菌株利用混合糖能力對比
為了探究三菌株混合糖中葡萄糖和木糖的利用速率,以6%混合糖(3%葡萄糖+3%木糖)為碳源,對比WL210,WL220、WL230的菌體生長情況,結(jié)果如圖6所示。菌株WL210發(fā)酵36h時,OD達(dá)到最大7.1進(jìn)入穩(wěn)定期;WL220在48h時OD值達(dá)到最大7.58,WL230在54h時OD值達(dá)到最大8.38。雖然WL210最先進(jìn)入穩(wěn)定期,但其最大OD值是三菌株中最小,而WL220和WL230的最大OD值分別為WL210最大OD值的1.07倍、1.18倍。在12h之前菌株WL210的生物量高于菌株WL220和菌株WL230,而12h之后菌株WL230的生物量都高于菌株WL210和菌株WL220。結(jié)果表明,mglB/galP雙基因缺陷菌株WL230所攝取的糖更多用于菌體生長,也具有更高的生物量[17]。
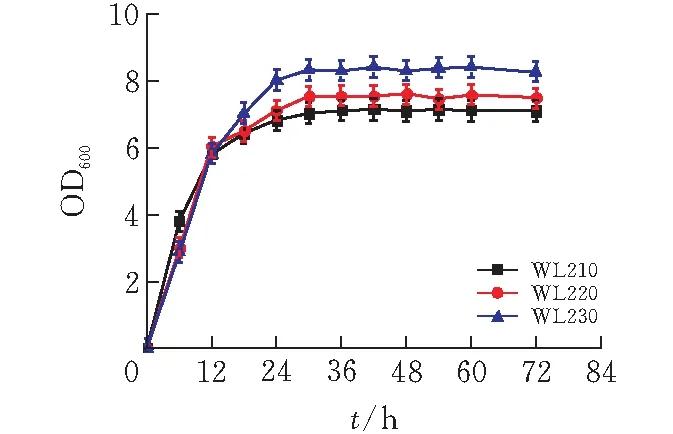
圖 6 三菌株混合糖發(fā)酵(3%木糖和3%葡萄糖) 的菌體生長情況
由圖7可知,菌株WL210優(yōu)先利用葡萄糖,待發(fā)酵至18h時,開始利用木糖,至48h還剩余23.02g/L木糖未利用,而葡萄糖完全耗完;WL220同時利用葡萄糖和木糖,42h時葡萄糖利用完畢,發(fā)酵至48h時木糖剩余量為11.45g/L;菌株WL230可同時利用葡萄糖和木糖,發(fā)酵48h時木糖無殘余,發(fā)酵至72h時葡萄糖消耗完畢。
圖 7 三菌株混合糖發(fā)酵(3%葡萄糖+3%木糖) 的木糖和葡萄糖消耗曲線
菌株WL210、WL220、WL230消耗葡萄糖的速率分別為1.21g/(L·h)、0.78g/(L·h)、0.66g/(L·h),消耗木糖速率分別為0.15g/(L·h)、0.45g/(L·h)、0.62g/(L·h)。對比出發(fā)菌WL210,菌株WL220、菌株WL230,木糖的消耗速率分別提高了188.03%、298.92%。結(jié)果表明,mglB、galP兩基因的缺失,可有效降低分解代謝阻遏效應(yīng),使葡萄糖消耗速率降低,而木糖消耗速率升高可能是兩個基因?qū)δ咎窍木哂携B加效應(yīng)[18]。
三菌株的L-乳酸產(chǎn)量如圖8所示。在發(fā)酵30h之前,菌株WL210的乳酸產(chǎn)量高于菌株WL220、WL230,菌株WL210利用葡萄糖產(chǎn)L-乳酸的速率大于菌株WL220、WL230 產(chǎn)L-乳酸速率,分別為0.98g/(L·h)、0.88g/(L·h)、0.79g/(L·h);發(fā)酵30h后WL220、WL230的L-乳酸產(chǎn)量超過菌株WL210。發(fā)酵至36h,菌株WL210、菌株WL220、菌株WL230的乳酸產(chǎn)量分別為37.95g/L、43.02g/L、54.13g/L,生產(chǎn)強度分別為0.79g/(L·h) 、0.90g/(L·h)、 1.13g/(L·h),轉(zhuǎn)化率分別為63.13%、71.88%、90.21%。對比出發(fā)菌WL210,菌株WL220、WL230生產(chǎn)強度分別提高了13.30%、42.63%,轉(zhuǎn)化率分別提高了13.86%、42.90%。菌株WL230已消耗完所有碳源,而菌株WL210、WL220分別剩余22.01g/L、11.39g/L的木糖。結(jié)果表明,敲除mglB、galP后,WL220、WL230利用木糖產(chǎn)L-乳酸的能力遠(yuǎn)大于菌株WL210,由于mglB、galP這兩個基因的缺失,葡萄糖消耗速率減弱[19]。

圖 8 三菌株混合糖發(fā)酵(3%葡萄糖+3%木糖) 的乳酸產(chǎn)量
3 結(jié)論
本研究敲除甲基半乳糖苷轉(zhuǎn)運系統(tǒng)基因mglB、半乳糖轉(zhuǎn)運系統(tǒng)基因galP,構(gòu)建mglB/galP雙缺陷乳酸工程菌WL230。在混合糖(3%葡萄糖和3%木糖)發(fā)酵時,具有木糖利用效率高、發(fā)酵周期短、乳酸轉(zhuǎn)化率高的特點。對比出發(fā)菌WL210,其木糖利用速率和乳酸生產(chǎn)強度分別提高了298.92%、42.63%,轉(zhuǎn)化率高達(dá)90.21%,為采用基于木質(zhì)纖維素等可再生原料高效利用木糖生產(chǎn)L-乳酸提供理論基礎(chǔ)。

