香茅草離體快繁體系的建立
魏秋蘭 肖玉菲 張曉寧 鐘連香 覃子海 陳博雯 張燁 覃玉鳳



摘 要:以香茅草地下莖段為外植體,研究了不同基本培養基和植物生長調節劑組合對芽誘導、增殖和生根的影響。結果表明:適于香茅草芽誘導的培養基為WPM + 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1,芽誘導率可達81.1%;適于芽增殖的培養基為WPM + 6-BA 2.5 mg·L-1 + NAA 0.4 mg·L-1,增殖倍數達5.0;適于生根的培養基為1/2 WPM + IBA 0.5 mg·L-1 + IAA 1.0 mg·L-1,生根率達95.8 %,平均根條數5.5;經煉苗后移栽至椰糠基質中,成活率為98%。
關鍵詞:香茅草;組織培養;離體快繁;培養基
中圖分類號:Q943.1? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A
Establishment of in Vitro Rapid Propagation System of Cymbopogon citratus
WEI Qiulan,XIAO Yufei,ZHANG Xiaoning,ZHONG Lianxiang,QIN Zihai,CHEN Bowen,ZHANG Ye,QIN Yufeng*
(Guangxi Forestry Research Institute,Nanning,Guangxi 530002,China)
Abstract:The effects of different combinations of basic media and plant growth regulators on buds induction,multiplication and rhizogenesis were studied with rhizomes of Cymbopogon citratus as explants. The results showed that the most optimum medium for induction of adventitious buds was WPM + 6-BA 1.0 mg·L-1 + NAA 0.1 mg·L-1,on which the germination rate reached 81.1% .The most optimum subculture medium was WPM + 6-BA 2.5 mg·L-1 + NAA 0.4 mg·L-1,on which the multiplication ratio was 5.0. The most optimum rooting medium was 1/2WPM + IBA 0.5 mg·L-1 + IAA 1.0 mg·L-1,on which the rooting rate reached 95.8%,and average number of roots was 5.5. The seedlings were transplanted into coconut bran substrate after being hardened-off,and the survival rate was 98%.
Key words:Cymbopogon citratus;tissue culture;in vitro rapid propagation;culture medium
香茅草(Cymbopogon citratus)為禾本科(Graminaeae)香茅屬(Cymbopogon)植物,莖葉具有濃郁的檸檬香氣,故又稱檸檬草,是一種多年生草本香料植物[1],也是園林造景不可缺少的植物之一,具有觀賞、綠化、美化等功能。香茅草全草可入藥,莖葉因含有檸檬醛[2],具有調節情緒、疏風解表、緩解疼痛、清除自由基[3]、降壓等功效,能治療肌肉拉傷、頭痛、肺熱咳嗽等癥[4]。隨著健康理念的發展,集生態與藥用價值一體的香茅草,市場需求量增大。香茅草的繁殖方式一般是利用根長出的幼株,從根部分株移栽,這種無性繁殖的方式速度極慢,產量很低,無法滿足市場的需求,而且長期分株,操作不當,就會嚴重損傷根部,導致細菌感染,種源抗性降低,品質變差。采用組織培養技術,既可保持優良的品種特性,又可加快繁殖速度[5],對提高香茅草的產量和品質有很大的促進作用。目前,有關香茅草的研究主要集中在精油含量[6-9]、提取工藝[10]等方面,有關組織培養技術方面的研究報道甚少,蔡宣梅[11]以莖尖和鞠玉棟[12]以頂芽作為外植體,研究了植物生長調節劑對組培苗生長各階段的影響。香茅草組織培養技術研究中,國內外未見報道利用地下帶芽莖段作為外植體、以及除了植物生長調節劑對組培苗生長的影響外并未涉及其它影響因子的研究。本試驗以香茅草地下帶芽莖段為外植體,探究了不同基本培養基、植物生長調節劑組合對芽誘導、增殖和生根的影響,以及組培苗移栽基質篩選等,建立了香茅草高效組培繁殖體系,為良種苗木規模化生產提供技術支持。
1 材料與方法
1.1 試驗材料及處理
香茅草采自廣西林科院試驗基地的優良植株,1年生,長勢好,無病蟲害,以地下莖段為外植體。切去葉片、根部,剝盡地下莖的葉鞘,用小軟刷刷洗干凈,自來水沖洗1 h,嫩莖剪成2~3 cm的莖段(帶1個芽以上),按木質化程度分類置于消毒瓶內,在超凈工作臺上用75 %酒精消毒30 s,無菌水沖洗2~3次,再浸入0.1%氯化汞溶液消毒10 min,無菌水清洗5~6次,無菌濾紙吸干莖段表面水分接種到培養基內培養。
1.2 試驗方法
1.2.1 芽誘導培養
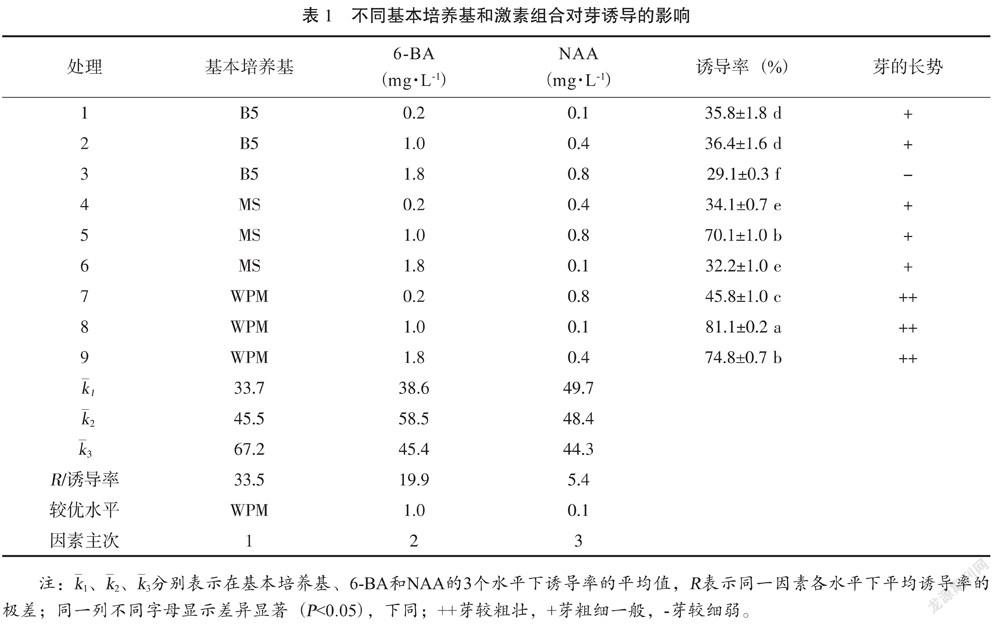
以不同基本培養基(MS、WPM、B5)、6-BA(0.2 mg·L-1、1.0 mg·L-1、1.8 mg·L-1)、NAA(0.1 mg·L-1、0.4 mg·L-1、0.8 mg·L-1)為試驗因素設計L9(34)正交培養基組合,共9個處理,每個處理接30瓶,每瓶接種1個外植體,重復3次,培養30 d,觀察記錄芽形態特征,統計外植體萌芽率,用直觀分析法篩選出最優的培養基組合。
1.2.2 芽增殖培養
1.2.2.1 不同激素組合對芽增殖的影響
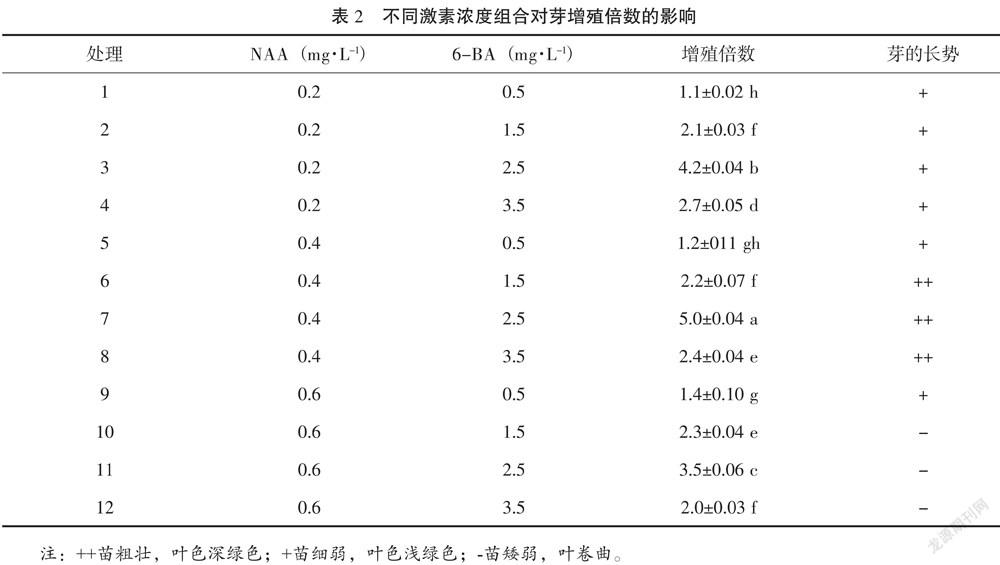
將誘導叢芽(高1~2 cm)接種于增殖培養基:基本培養基WPM,分別添加6-BA 0.5 mg·L-1、1.5 mg·L-1、2.5 mg·L-1、3.5 mg·L-1、NAA 0.2 mg·L-1、0.4 mg·L-1、0.6 mg·L-1,采用完全隨機區組設計,12個處理,每個處理30瓶,每瓶接種5個叢芽,重復3次,培養30 d統計新增芽數,計算增殖倍數。
1.2.2.2 不同蔗糖濃度對芽增殖的影響
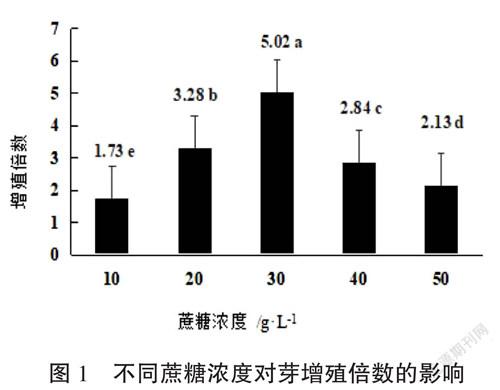
培養基采用WPM,并添加1.2.2.1篩選出的最佳激素組合、設計5個水平的蔗糖濃度分別為10 g·L-1、20 g·L-1、30 g·L-1、40 g·L-1、50 g·L-1,采用完全隨機區組設計,5個處理,每個處理30瓶,每瓶接種5個叢芽,重復3次,培養30 d統計新增芽數,計算增殖倍數。
1.2.3 根誘導培養
將芽接入根誘導培養基:基本培養基為(1/2WPM、2/3WPM、WPM),分別添加不同濃度的IBA、IAA和不同蔗糖濃度(見表3),采用完全隨機區組設計,9個處理,每個處理6瓶,每瓶接種5個芽,重復3次,培養30 d統計生根率、生根條數,觀察根系質量狀況。
1.2.4 煉苗與移栽
當生根瓶苗培養30 d后,把它移入散射光下的陽光棚內,先閉蓋5 d,后開蓋6 d進行煉苗,移栽基質是紅泥、椰糠和全沙,采用完全隨機區組設計,3個處理,每個處理移栽30株,重復3次,移栽30 d后統計成活率和苗高,確定最佳的移栽基質。
1.3 培養條件
除生根培養基含蔗糖15 g·L-1,其余培養基中均含蔗糖30 g·L-1,瓊脂4 g·L-1,pH值5.5~6.0,光照強度800~4 000 lx,光照時間10~12 h·d-1,溫度25 ℃。
1.4 數據處理
采用Excel 2007和SPSS 20.0對數據進行處理分析,對各試驗因素進行顯著性分析和極差分析。
萌芽率(%)=萌芽的外植體數/接種的外植體總數×100。
增殖倍數=芽發出叢生芽的總數/接種時單芽總數。
成活率(%)=成活株數/移栽總株數×100。
生根率(%)=生根的芽數/接種的芽總數×100。
2 結果與分析
2.1 培養基對芽誘導的影響
將消毒獲得的無污染帶芽莖段接種于芽誘導培養基上,5~7 d莖段的芽點開始萌動,10~15 d芽體慢慢膨大長出綠色小芽,20 d芽長至1~2 cm高。從表1的多重比較可看出,各處理之間誘導率差異顯著,8號處理的誘導率最高為81.1%,且苗長勢好,莖粗壯,葉綠色。極差R分析表明(表1),三因素對外植體芽誘導影響大小順序為R基本培養基>R6-BA>RNAA,表明在組織培養中,通過調整6-BA濃度和基本培養基類型是提高芽誘導率的兩個關鍵因素。基本培養基之間對外植體芽誘導率存在顯著性差異,對芽誘導影響大小順序為WPM>MS>B5。WPM培養基對芽誘導率分別比MS、B5的高21.7%、33.5%。6-BA的3個水平之間存在顯著差異,以1.0 mg·L-1 對芽平均誘導率最高,為58.5%,NAA的 3個水平之間存在顯著性差異,以0.1 mg·L-1對芽平均誘導率最高,為49.7%。綜合分析,芽誘導最佳培養基組合是WPM+ NAA 0.1 mg·L-1 + 6-BA 1.0 mg·L-1,芽誘導率最高為81.1%。
2.2 芽增殖培養
2.2.1 不同激素組合對芽增殖的影響
由表2可知,當NAA質量濃度由0.2 mg·L-1提高到0.4 mg·L-1時,芽增殖倍數隨之提高,NAA質量濃度提高到0.6 mg·L-1,芽的增殖倍數隨之降低,芽的愈傷組織出現較明顯;同一濃度NAA中,6-BA質量濃度由0.5 mg·L-1增加到2.5 mg·L-1時,芽的增殖倍數隨之提高,當6-BA質量濃度達到3.5 mg·L-1時,芽的增殖倍數隨之降低。不同濃度6-BA和NAA組合對香茅草芽增殖倍數的影響各處理之間差異顯著。7號處理的芽增殖倍數最大為5.0,從芽的長勢看,苗健壯,葉色深綠色。因此,最適于香茅草芽增殖的激素組合是7號處理,即NAA 0.4 mg·L-1+6-BA 2.5 mg·L-1。
2.2.2 不同蔗糖濃度對芽增殖的影響
由圖1可知,不同蔗糖濃度對香茅草芽增殖倍數的影響差異顯著,增殖倍數隨著蔗糖濃度的增加出現先上升后下降的趨勢。當蔗糖濃度由10 g·L-1增加到30 g·L-1時,芽增殖倍數隨之上升,最高增殖倍數是5.02(30 g·L-1),蔗糖濃度超過30 g·L-1時,芽的增殖倍數隨之下降。從芽生長狀況來看,當蔗糖濃度小于30 g·L-1時,芽的長勢狀態不佳,芽弱小,葉淺黃色,當蔗糖濃度大于30 g·L-1時,芽生長一般,但葉明顯出現玻璃化現象,當蔗糖濃度為30 g·L-1,芽生長旺盛、健壯,葉深綠色。綜合來看,香茅草芽的增殖培養基中蔗糖濃度最佳為30 g·L-1。
2.3 根誘導培養
將株高2~3 cm、健壯的繼代單芽分別接入表3的生根培養基中,誘導生根。由表3可知,不同基本培養基、IAA和IBA組合對香茅草生根率和根條數的影響差異均顯著。極差R分析表明,3個因素對生根率影響,各因素極差分別為R基本培養基=14.5,RIAA=4.2,RIBA=4.6,即3因素影響生根率的主次關系為:R基本培養基>RIBA>RIAA,則影響生根率的最優培養基為:1/2WPM+IBA 1.0 mg·L-1+IAA 1.5 mg·L-1,培養30 d,生根率達90.7 %。
針對根條數這個指標,各因素的極差分別為:R基本培養基=1.3,RIAA=0.3,RIBA=0.4,即3個因素影響由主到次依次為:R基本培養基>RIBA>RIAA,則最優培養基為:1/2WPM+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1,生根條數為5.5。
從根系質量狀況來看,7號和8號處理的根系質量較好,主根健壯,須根分明、生根條數較多,根部產生的愈傷組織非常少。綜上所述,根誘導最佳培養基為8號處理,即1/2WPM+IBA 0.5 mg·L-1 +IAA 1.0 mg·L-1,生根率為95.8%,生根條數為5.5。
2.4 煉苗與移栽
從表4可看出,栽培基質對香茅草移栽成活率的影響差異顯著,處理3的移栽成活率最高達98%,平均苗高5.7 cm,明顯高于其它處理。對苗高的影響,紅心土和椰糠基質之間差異不顯著。綜合分析得出,移栽效果最好的基質是椰糠。
本研究已經建立了一套香茅草離體快繁體系(圖2),并在生產實踐中應用。
3 討論與結論
植物細胞具有全能性,任何完整的單個植物細胞都有可能形成新的完整植株。研究表明,地下帶芽莖段有較強的細胞分裂能力,是最佳的外植體[13]。外植體生長階段所需的營養主要來源于基本培養基[14],而基本培養基類型種類繁多,它們所含的營養成分各不相同。本試驗采用香茅草地下帶芽莖段為材料,通過MS、B5、WPM 3種基本培養基比較表明,供試驗的3種基本培養基中無機鹽含量為MS>B5>WPM。含高濃度無機鹽的MS培養基最不適合香茅草培養,原因可能是MS培養基中的硝酸鹽、鉀和銨的含量較高,尤其銨和硝酸鹽對不少培養物的生長有抑制作用,而含低濃度無機鹽的WPM基本培養基是香茅草最佳的誘導和繼代增殖培養基,1/2WPM是最佳的誘導生根培養基,說明低濃度無機鹽更有利于香茅草培養。張樹河[15]研究了香茅草離體快速繁殖,以莖尖為外植體、MS為基本培養基,并附加6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1作為增殖培養基,得到香茅草叢生芽的增殖倍數是4.05,與本試驗的結論(增殖倍數5.0)不一致,可能是與采用香茅草外植體不同有關或同一種植物不同器官的細胞中所含的激素水平不盡相同也有關。
植物生長調節劑的合理組合對不定芽的萌發、增殖及生根有較大的影響作用[16]。在植物組織培養中,廣泛應用的生長調節劑是細胞分裂素和生長激素[17],通過調節培養基中激素組合的含量,使芽分化速度和增殖倍數大大提高,縮短種苗繁殖時間,并且可保持品種的優良品質和提高產量[18]。本試驗6-BA和NAA聯合使用,芽誘導的培養基為WPM+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1,誘導率高達81.1%以上,繼代增殖培養基為WPM+6-BA 2.5 mg·L-1+NAA 0.4 mg·L-1,增殖倍數達5.0,且芽生長旺盛、粗壯,根誘導的培養基為1/2 WPM+IBA 0.5 mg·L-1+IAA 1.0 mg·L-1,生根率達95.8%以上,平均生根條數為5.5,根系質量效果較好,可見提高了香茅草的萌芽率及增殖倍數,與上述結論相一致。
移栽是植物組織培養至關重要的環節,苗的根系質量以及移栽前煉苗和基質選擇對移栽成活率有很大的影響[19],如果不注意以上關鍵環節,很可能導致成活率急劇下降,造成不必要的經濟損失。組培瓶苗在室內恒溫、無菌的優越環境條件下培養,體表的保護組織很薄、蒸騰速率和凈光合速率很低,幼苗抗逆能力弱,適應外界能力很差[20]。本試驗發現,提高組培苗移栽成活率的關鍵是移栽前進行組培苗煉苗,煉苗方式是選擇在室外散射光的大棚里、閉蓋煉苗5 d、開蓋煉苗6 d,這種方式很大程度上提高了組培苗對外界環境的適應能力。此外,選擇合適的移栽基質并對基質消毒也是提高組培苗成活率的重要因素。研究結果表明,移栽在沙、紅心土基質中的組培苗成活率比在椰糠基質中的成活率低,椰糠基質中的成活率達98%以上,平均苗高5.7 cm,根系發達、苗健壯、葉深綠色,這可能與椰糠疏松透氣性強,并含有苗生長所需的豐富養分有直接關系,而移栽在全沙基質中的組培苗,成活率和苗高表現均較差,可能是因為全沙的儲水能力弱且含氧少的原因導致。
參考文獻
[1]? ? ? 陳宗良,莊華德.中國植物志(第十卷,第二分冊)[M].北京:科學出版社,1997:197.
[2]? ? ? Nakahara K,Alzoreky N S,Yoshihashi T,et al.? Chemical Composition and Antifungal Activity of Essential Oil from Cymbopogon nardus (Citronella Grass)[J].? Japan Agricultural Research Quarterly,2003,37(4):249-252.
[3]? ? ? 梁芳,葉繪晟,龔志強,等.廣西與云南兩地香茅草含量測定及清除自由基能力的研究[J].湖南師范大學自然科學學報,2020,43(1):63-67.
[4]? ? ?Billerbeck V G,Roques C G, Bessière J M,et al. Effects of Cymbopogon nardus (L.) W. Watson essential oil on the growth and morphogenesis of Aspergillus niger.[J]. Canadian Journal of Microbiology,2011,47(1):9-17.
[5]? ? ?陳曉明,莫尚偉,藍肖,等.杉木組織培養莖段滅菌技術[J]. 廣西林業科學,2014,43(4):?426-430.
[6]? ? ?劉曉宇,陳旭冰,陳光勇. β-石竹烯及其衍生物的生物活性與合成研究進展[J].林產化學與工業,2012,32(1): 104-110.
[7]? ? Rocha K A D S,Rodrigues N V S,Kozhevnikov I V,et al. Heteropoly acid catalysts in the valorization of the essential oils:Acetoxylation? ? of? ?β-caryophyllene[J].? Applied Catalysis A General,2010,374(1-2):87-94.
[8]? ? Jevgeni? P, Joona? N,Iuka? k? et al. Preparation of beta-caryophyllene oxidation products and their determination in ambient aerosol samples[J].? Analytical and Bioanalytical Chemistry,2008,390(3):913-919.
[9]? ? ?趙建芬,韋壽蓮,陳子沖.香茅草揮發油的提取及其化學成分分析[J].食品研究與開發,2015,36(19): 55-58.
[10] ?楊帆,楊凱瑜,李科鋒,等.抗氧化香茅草水提液浸提工藝的優化[J].寧夏大學學報(自然科學版),2020,41(3):279-284,290.
[11]? ?蔡宣梅,郭文杰.香茅草離體快速繁殖[J].中國花卉園藝,2016(22):32.
[12]? ?鞠玉棟,吳維堅,楊敏,等.檸檬香茅組培快繁技術研究[J]. 中國園藝文摘,2016,32(8):15-17.
[13]? ?劉金英,徐有明,李雙來,等.佛手山藥組織培養的研究[J]. 植物研究,2006,26(3):323-?328.
[14]? ?辜夕容,石大興. 圓柏組織培養繁殖研究[J].亞熱帶植物通訊,2000,29(2):40-42.
[15]? ?張樹河,林加耕,吳維堅,等.香茅草組織培養快速繁殖技術[J].廣西熱帶農業,2005(5):10-11.
[16]? ?牟海飛,劉潔云,黃永才,等.火龍果離體培養莖段滅菌及芽誘導增殖研究[J]. 西南農業學報,2017,30(6):1439-1444.
[17]? ?王忠.植物生理學[M].北京:中國農業出版社,2002.
[18]? ?曹孜義,劉國民.實用植物組織培養技術教程[M].蘭州:甘肅科學技術出版社,1996:45- 50.
[19]? ?張靜,牛喆,范衛芳,等.狹葉黃芩組織培養再生體系的建立[J]. 植物研究,2020,40(1):50-57.
[20]? ?劉慶昌.植物細胞組織培養[M].北京:中國農業大學出版社,2010.
基金項目:廣西科技計劃項目(桂科AD18281083,桂科AB18221058);廣西林業科技推廣示范項目(gl2018kt09)。
作者簡介:魏秋蘭(1973-),女,工程師,主要從事生物技術研究,E-mail:274490087@qq.com。
*通信作者:覃玉鳳(1981-),女,碩士,工程師,主要從事生物技術研究,E-mail:51519198@qq.com。
收稿日期:2021-12-03

