生物質炭配施木灰對石灰性土壤固碳和微生物群落的影響①
王 麗,趙惠麗,趙 英
生物質炭配施木灰對石灰性土壤固碳和微生物群落的影響①
王 麗,趙惠麗*,趙 英
(魯東大學資源與環境工程學院,山東煙臺 264025)
為探討生物質炭配施木灰對土壤碳固存和微生物群落的影響,通過118 d的室內培養試驗,研究了單施生物質炭(B)、生物質炭配施木灰(B+W)處理下土壤碳固存、化學性質、酶活性、微生物群落組成的變化。結果表明:B、B+W處理均降低了CO2-C釋放速率和累積釋放量,且B+W處理推遲CO2釋放速率峰值的出現;B、B+W處理均能提高土壤有機碳、無機碳含量。培養118 d時,B、B+W處理的微生物生物量碳高于對照,且B處理高于B+W處理;B+W處理提高了土壤pH與溶解性有機碳含量;B處理提高了土壤β-1,4-葡萄糖苷酶活性,B+W處理的β-1,4-木糖苷酶、β-1,4-葡萄糖苷酶活性分別較對照降低38.4%、15.3%,而蔗糖酶活性較對照提高61.4%。B處理對細菌豐富度和多樣性無顯著影響,卻降低真菌Chao1、Ace指數;B+W處理雖降低了細菌豐富度和多樣性,卻能恢復真菌Chao1、Ace指數,并顯著提高Shannon指數。培養 118 d時,B處理提高了放線菌門相對豐度,降低了子囊菌門相對豐度;B+W處理的綠彎菌門及擔子菌門相對豐度提高,擬桿菌門相對豐度降低。冗余分析發現,B、B+W處理通過改變土壤化學性質影響土壤微生物群落結構,土壤有機碳與pH分別是影響細菌、真菌群落結構最顯著的土壤因子,且B+W處理在降低石灰性土壤碳礦化、維持真菌群落穩定性方面效果更佳。
碳固存;微生物群落;生物質炭;木灰;石灰性土壤
土壤中有機碳儲量是決定土壤質量、支持土地可持續利用的關鍵因素。提高土壤有機碳固存有助于穩定大氣CO2含量,提高土壤質量[1]。土壤微生物作為組成土壤生態系統的重要成員,不僅是土壤質量變化的指標,同時是推動土壤有機碳和養分轉化的主要驅動力[2]。
生物質炭作為生物質熱解炭化產生的穩定富碳固體產物,含大量惰性碳基質[3]。施用于土壤中的生物質炭有助于形成難降解土壤有機碳,從而增加土壤總有機碳儲量,減緩大氣CO2濃度的上升,是一種穩定碳匯的有效措施。目前,添加生物質炭對土壤有機碳礦化影響的研究結論尚不一致。研究顯示,添加生物質炭顯著降低了中性土壤的CO2通量,但增加了酸性土壤的CO2通量[4]。盡管生物質炭的物理保護和化學穩定性對土壤有機碳的穩定和累積起著關鍵作用,但微生物的豐度和活性是主導有機碳礦化的主要因素[5]。微生物通過直接或間接參與生物質炭在土壤中的降解、遷移和轉化過程進而影響土壤有機碳儲量[6]。大量研究表明,生物質炭強烈地改變了土壤的物理化學條件,從而迅速改變了微生物群落結構與豐度[7]。因此,了解生物質炭對土壤微生物群落結構和動態的影響,有助于更好地預測土壤碳循環動態。
有機礦物復合體的形成是保護和穩定有機碳的關鍵機制。研究表明,具有高比表面積和高金屬氧化物含量的礦物改良劑,如木灰,可與有機殘留物結合,增強土壤固碳能力[8]。在鈣質土壤中,木灰中鈣鎂的碳化作用固定了土壤呼吸產生的CO2,從而降低了CO2的排放,同時增加了土壤無機碳的含量[9]。其他研究也報道,高CaO含量的樹皮、鋸末和樹枝的木灰是低成本CO2封存的選擇[10]。此外,施用木灰可以通過誘導土壤pH的增加和土壤環境元素組成的變化,直接或間接地影響土壤微生物過程[11]。然而,有關木灰對土壤微生物群落影響的研究多集中在酸性或森林土壤中,同時,近年有關生物質炭的研究也主要集中在酸性或中性土壤中,因此,研究石灰性土壤條件下生物質炭配施木灰對土壤CO2排放、碳固存及其微生物群落的影響,對于預測生物質炭與木灰的固碳潛力和農業大規模應用具有重要意義。
基于以上原因,本研究擬通過室內培養試驗,以黃土塬區黑壚土為研究對象,以生物質炭和木灰為供試材料,探討生物質炭配施木灰對石灰性土壤碳固存、微生物群落結構及酶活性的影響,以為評估生物質炭和木灰添加對土壤質量的改善提供理論依據,這對廢棄物資源的高效循環利用具有重要意義。
1 材料與方法
1.1 供試材料
供試土壤于2017年10月采自長武農業生態試驗站(35.14°N, 107.40°E)表層(0 ~ 20 cm),土壤類型為黃蓋黑壚土。土壤經自然風干,研磨過2 mm篩備用。供試土壤基本化學性質為:pH 8.1,全氮1.2 g/kg、有效磷18.3 mg/kg、有效鉀152 mg/kg、有機碳8.9 g/kg、CaCO367 g/kg。
供試生物質炭由小麥秸稈在350℃ 限氧條件下熱裂解所得,研磨過1 mm篩備用。生物質炭的有機碳含量為598 g/kg,全氮含量為12.23 g/kg,碳氮比為48.90,比表面積為24 m2/g,pH為8.1。供試木灰采自楊凌,為獼猴桃枝條燃燒后的灰燼,風干后的木灰經研磨,過0.25 mm 篩裝在密封塑料瓶中備用。木灰的有機碳含量為3.2 g/kg,全氮含量為0.8 g/kg,CaO含量為43.4%,pH為12.4。
1.2 試驗設計
試驗共設3個處理,即對照(CK)、單施生物質炭(B)、生物質炭配施木灰(B+W),每個處理重復6次,生物質炭、木灰的用量都為12 g/kg。采用室內模擬恒溫(25℃)培養方法進行試驗,具體操作如下:稱取250 g風干土壤,生物質炭、木灰與培養土混勻后裝入1 L帶密閉封蓋的的培養瓶(高15 cm、直徑9 cm)中,將尿素和磷酸二銨配成濃度為N 4.4 g/L、P2O52.1 g/L的溶液,然后每瓶加入5 ml(折純為每瓶 22.0 mg N 和 10.3 mg P2O5);將培養土含水量調至田間持水量的70%;將裝有20 ml 1 mol/L NaOH溶液的塑料瓶懸掛于密閉培養瓶中,分別在培養2、3、4、5、7、10、13、18、23、28、35、42、49、56、70、86和118 d時取下已吸收CO2的20 ml 1 mol/L NaOH溶液塑料瓶,將NaOH溶液用蒸餾水沖洗至三角瓶中,用20 ml 1 mol/L的BaCl2沉淀捕獲CO2,加2滴酚酞指示劑,然后用0.1 mol/L的HCl滴定至紅色消失,計算CO2的釋放量。每次測量氣體時打開蓋子一段時間以保證氣體交換,然后加入新的NaOH溶液繼續培養,期間用質量差值法校準調節土壤含水量。
1.3 指標測定及方法
分別在培養7、118 d時,對土壤樣品進行破壞性取樣(每個處理取3個重復)。一部分儲存在4℃下用于土壤微生物生物量碳、溶解性有機碳含量和酶活性分析;一部分儲存在–80℃下用于土壤DNA提取;剩余土壤風干用于土壤化學性質測定。
1.3.1 土壤化學性質測定 土壤有機碳(SOC)采用重鉻酸鉀–濃硫酸外加熱法[12];土壤無機碳(SIC)采用改良氣量法[12];土壤溶解性有機碳(DOC)和微生物生物量碳(MBC)分別采用蒸餾水浸提法和氯仿熏蒸法[13];土壤微生物熵()計算為MBC和SOC的比值(MBC/SOC,%);土壤pH采用水土質量比2.5∶1 pH計法[14];β-1,4-木糖苷酶(BXYL)、β-1,4-葡萄糖苷酶(BG)、纖維二糖水解酶(CBH)以及蔗糖酶(Invertase)活性采用微孔板熒光法[15]。
1.3.2 土壤微生物測定 采用 FastDNA Spin Kit for Soil 試劑盒(MP Biomedicals,Illkirch,France)提取土壤樣品的 DNA。每個樣品取0.5 g土樣,按照說明書完成操作。使用超凈DNA純化試劑盒(MoBio, Carlsbad, CA, USA)純化提取DNA,然后進行1%瓊脂糖凝膠電泳檢測,最后將樣品于20℃保存以備后續試驗使用。選用引物338F(5′-ACTCCTA CGGGAGGCAGCAG-3′)和806R(5′-GGACTACNN GGG TATCTAAT-3′)擴增16S rRNA基因的V3 ~ V4區域;選用引物ITS1(5′-CTTGGTCATTTAGA GGAAGTAA-3′)和ITS2(5′-TGCGTTCTTCATCG ATGC-3′)擴增真菌ITS rDNA的ITS1區,將純化后的擴增產物等摩爾數混合,并在Illumina MiSeq平臺(Illumina, San Diego, California, USA)上進行配對末端測序(2×250)。Illumina MiSeq測序是在北京奧維森基因科技有限公司,利用Illumina Miseq PE250高通量測序平臺完成。
Illumina MiSeq測序原始數據經過QIIME(v1.8.0)軟件過濾、拼接、去除質量分數<20和序列長度<150 bp的序列;將有效序列按照97% 相似性進行操作分類單元(OTU)聚類分析,對比silva數據庫,得到每個OTU對應的物種分類信息;再利用Mothur軟件(version 1.31.2)進行α多樣性分析(包括Shannon、Ace和Chao1 3個指數)。
1.4 統計分析
試驗數據的整理以及圖表的繪制采用 Microsoft Excel 2016,所有數據均采用DPS統計軟件(DPS7.05)進行分析,差異顯著性檢驗采用LSD法(<0.05),并利用CANOCO 5.0軟件進行細菌和真菌群落組成的冗余分析。
2 結果
2.1 生物質炭配施木灰對土壤CO2釋放及碳組分的影響
不同處理土壤有機碳礦化動態如圖1所示,可見,對照(CK)和單施生物質炭處理(B)的土壤有機碳礦化速率在培養2 d時出現CO2-C礦化速率高峰,分別為100.04和99.51 mg/(kg·d),后隨著時間的推移而降低(圖1A)。而生物質炭配施木灰處理(B+W)推遲CO2釋放速率峰值的出現。與CK相比,B處理降低了CO2-C釋放速率,B+W處理則進一步降低了CO2-C釋放速率。
各處理土壤CO2-C累積釋放量的變化趨勢一致,呈現前期增長迅速、后期增長緩慢的規律(圖1B)。在培養的0 ~ 10 d,除B+W處理外,CK和B+W處理的CO2-C累積釋放量基本相同;整個培養期內,各處理土壤CO2-C的累積釋放量大小順序為:CK>B>B+W。
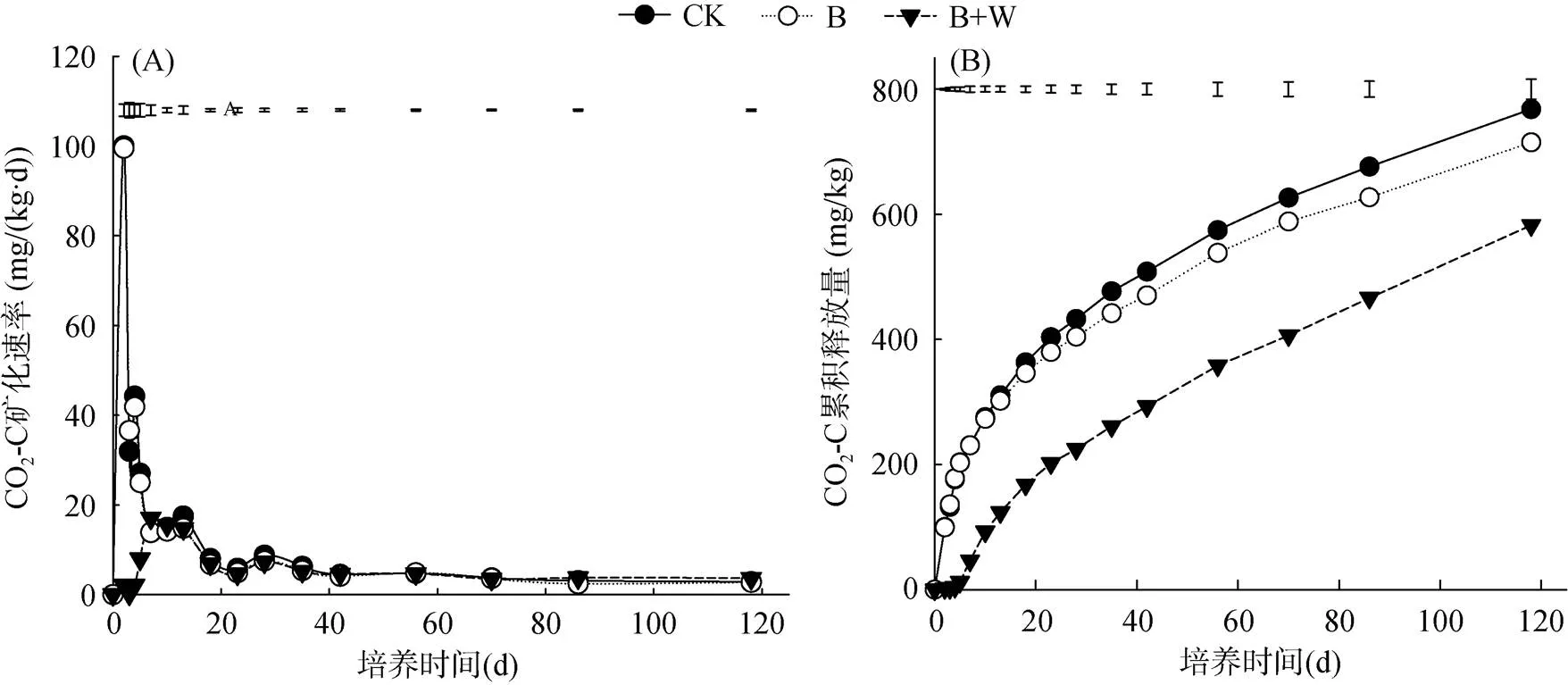
圖1 CO2-C礦化速率(A)、累積釋放量(B)的動態變化
B、B+W處理的有機碳含量分別較CK增加48.26% 和30.56%,無機碳含量分別較CK提高5.42% 和7.70%(圖2)。但B+W處理與B處理的有機碳、無機碳含量無顯著性差異。
2.2 生物質炭配施木灰對土壤化學性質及酶活性的影響
表1反映了添加生物質炭和木灰后土壤微生物熵()、微生物生物量碳(MBC)、溶解性有機碳(DOC)、pH的變化(表1)。隨著培養時間的延長,、MBC、DOC整體呈下降趨勢。在培養7 d時,B+W處理MBC含量較CK降低43.56%,至培養118 d時,B、B+W處理的MBC含量顯著高于CK,且B處理的MBC含量高于B+W處理。此外,培養118 d時,B+W處理的DOC含量、pH分別較CK提高47.14% 和2.08%。
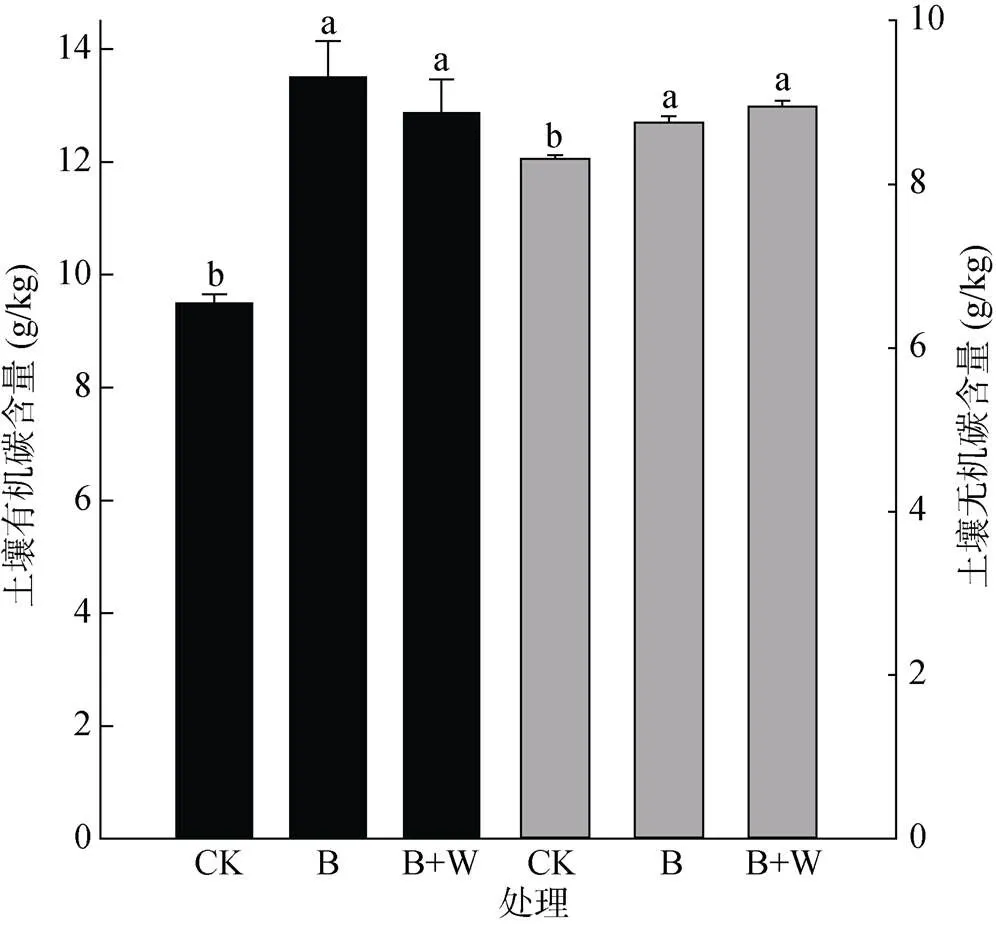
(誤差線表示標準差;不同小寫字母表示同一指標處理間差異顯著(P<0.05))

表1 生物質炭配施木灰對土壤化學性質的影響
注:表中同列不同小寫字母表示同一時間處理間差異顯著(<0.05),下同。
如表2所示,不同處理間土壤酶活性變化不同,在培養7 d時,B+W處理降低了β-1,4-葡萄糖苷酶、纖維二糖水解酶、蔗糖酶活性;至118 d時,B處理的β-1,4-葡萄糖苷酶活性較CK提高10.9%,B+W處理的β-1,4-木糖苷酶、β-1,4-葡萄糖苷酶活性分別較CK降低38.4% 和15.3%,且B+W處理的蔗糖酶活性顯著高于CK和B處理。
2.3 生物質炭配施木灰對土壤微生物α多樣性的影響
土壤細菌α多樣性指數如表3所示,Chao1、Ace指數以及Shannon指數分別表征土壤微生物類群的豐富度和多樣性。在培養118 d時,相較CK處理,B處理對細菌Chao1、Ace指數無顯著性影響;而B+W處理的Chao1、Ace、Shannon指數顯著低于CK與B處理。

表2 生物質炭配施木灰對土壤酶活性的影響

表3 生物質炭與木灰配施下細菌、真菌α多樣性指數
真菌α多樣性指數對B和B+W處理具有不同的響應(表3)。培養118 d時,B處理的真菌Chao1、Ace指數分別較CK降低29.95% 和37.78%,B+W處理不但將Chao1、Ace指數維持在與CK相似的水平上,同時提高了Shannon指數。
2.4 生物質炭配施木灰對土壤微生物相對豐度的影響
土壤細菌種類門水平豐度在1% 以上的有7種(圖3),其中,變形菌門(Proteobacteria)、酸桿菌門(Acidobacteria)為優勢菌門,其相對豐度分別為26.72% ~ 35.47%、18.58% ~ 29.98%。在培養7 d時,B+W處理提高了變形菌門相對豐度,B、B+W處理的芽單胞菌門(Gemmatimonadetes)相對豐度分別較CK降低20.61% 和35.09%。在培養118 d時,B處理提高了放線菌門(Actinobacteria)相對豐度,B+W處理降低了擬桿菌門(Bacteroidetes)相對豐度;B、B+W處理的綠彎菌門(Chloroflexi)相對豐度分別較CK提高14.18% 和24.50%。

(圖中誤差線表示標準差;不同小寫字母表示同一時間處理間差異顯著(P<0.05),下同)
B、B+W處理對土壤真菌門水平相對豐度的影響如圖4所示。各處理下子囊菌門(Ascomycota)保持了較高的相對豐度。培養7 d時,B處理顯著提高了被孢霉菌門(Mortierellomycota)和擔子菌門(Basidiomycota)的相對豐度。培養118 d時,B+W處理的子嚢菌門相對豐度較B處理增加17.43%,且B+W處理的擔子菌門相對豐度顯著高于CK。
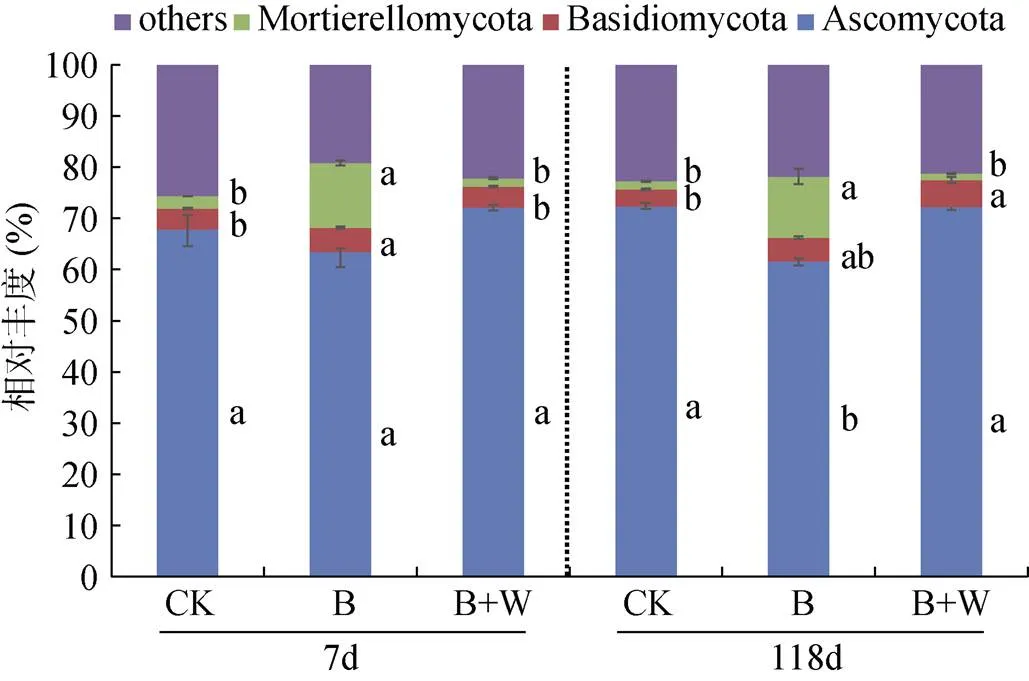
圖4 生物質炭配施木灰對土壤真菌主要門水平相對豐度的影響
2.5 土壤性質與細菌和真菌群落組成之間的關系
由圖5A可知,土壤環境因子共同解釋了75.15% 的細菌群落組成變異,其中RDA1和RDA2分別解釋了細菌群落68.02% 和7.13% 的變異。Invertase(蔗糖酶)、BXLY(β-1,4-木糖苷酶)、CBH(纖維二糖水解酶、BG(β-1,4-葡萄糖苷酶)活性與土壤pH呈負相關關系,變形菌門相對豐度與土壤pH、DOC含量呈正相關關系,綠彎菌門、放線菌門相對豐度與土壤SOC含量、CO2釋放量呈正相關關系,在土壤細菌門水平上,SOC 含量對細菌的群落分布影響最為顯著(= 21.6,= 0.002)。通過對各土壤環境因子與土壤真菌群落結構關系的冗余分析(圖 5B)發現,土壤環境因子解釋了真菌群落總變化的58.35%。BXLY、CBH、BG活性與CO2釋放量呈正相關關系,子囊菌門相對豐度與pH、SOC含量呈正相關關系,擔子菌門相對豐度與DOC、SOC含量呈正相關關系,與土壤pH呈負相關關系。在土壤真菌門水平上,pH對真菌的群落分布影響最為顯著(= 6.7,= 0.026)。

(Proteobacteria為變形菌門;Bacteroidetes為擬桿菌門;Planctomycetes為浮霉菌門;Acidobacteria為酸桿菌門;Gemmatimonadetes為芽單胞菌門;Chloroflexi為綠彎菌門;Actinobacteriota 為放線菌門;Ascomycota為子囊菌門;Mortierellomycota為被孢霉菌門;Basidiomycota為擔子菌門)
3 討論
3.1 生物質炭配施木灰對碳礦化、土壤化學性質及酶活的影響
本研究發現,各處理CO2礦化速率均表現為前期(前7 d)急速增加,然后降低,最后趨于平穩的現象,這是因為添加外源物料后,前期土壤微生物可迅速利用易分解組分,土壤有機碳的礦化速率迅速增長,但隨著培養時間的延長,易分解組分逐漸被消耗,礦化速率隨之減緩。單施生物質炭(B處理),CO2釋放量降低,表明土壤有機碳礦化降低,這與生物質炭的自身結構特性有關。生物質炭強大的孔隙結構和表面積,通過包封和吸附作用與土壤有機質結合,強烈抑制被吸附有機質的降解[16]。生物質炭配施木灰處理(B+W)較B處理進一步降低了CO2的釋放量(圖1B),說明木灰具有長期穩定CO2的獨特優勢。原因可能是與木灰中的CaO促進了土壤無機碳(如CaCO3)的形成有關。此外,在鈣質土壤中,木灰中的礦物質與土壤中的有機質結合形成有機–礦物組合,增強了有機質抗分解能力[17]。
添加生物質炭(B、B+W處理)提高了土壤有機碳含量,這與其他學者研究結果一致[18]。除生物質炭自身結構特性外,生物質炭含有大量惰性碳基質,一定程度上可以抵抗微生物對它的分解作用,增加土壤有機碳的同時降低土壤碳礦化。土壤有機碳礦化是微生物參與下,對土壤中易分解組分進行分解利用并釋放CO2的過程,B+W處理提高土壤有機碳含量的原因可能是木灰通過間接增加土壤pH或直接影響土壤微生物和酶的活性,進而調控土壤碳礦化。
微生物生物量碳(MBC)是重要的活性有機碳組分,其含量高低可表征土壤微生物活性的強弱。土壤微生物熵作為MBC含量與SOC含量的比值,其大小變化反映了SOC向MBC的轉化效率。在培養至7 d時,B+W處理提高了土壤pH,降低了土壤微生物活性、MBC含量和值;B處理對土壤DOC、MBC含量沒有顯著影響,與Zhao等[19]研究結果一致。這是因為大多數生物質炭的碳是難降解的,短時間內限制了其對DOC和MBC水平的貢獻能力。在培養至118 d時,B+W處理顯著提高了DOC含量,這可能與施用木灰提高土壤pH有關。Andersson等[20]也研究發現,土壤pH高于土壤微生物活性對DOC含量的影響,并且pH的增加可以提高土壤有機質的溶解度。此外,生物質炭在土壤中并不是一成不變的,它也可以被緩慢分解,只是其降解速度比土壤中的一般有機質要慢得多[21]。B、B+W處理土壤中微生物可分解利用的有機質含量相對高于CK,因此,培養至118 d時,兩處理的MBC含量顯著高于CK,而木灰的強堿性減弱了微生物活性,導致B+W處理的MBC含量低于B處理。
土壤酶活性主要來源于微生物的代謝活動,在一定程度上可反映土壤微生物活性[22]。在培養至7 d時,B+W處理的β-1,4-葡萄糖苷酶、纖維二糖水解酶、蔗糖酶活性顯著降低,原因可能是施用木灰提高了土壤pH,減弱了土壤微生物活性,進而減少土壤酶的分泌,降低了土壤酶活性。此外,β-1,4-葡萄糖苷酶、纖維二糖水解酶、蔗糖酶作為參與碳循環的主要水解酶類,其活性降低表明土壤有機碳礦化程度低,這與本試驗觀察到的B+W處理對CO2累積釋放量的影響是一致的。在培養至118 d時,B處理β-1,4-葡萄糖苷酶活性增加,證實了先前的研究[23],原因可能與生物質炭制備條件有關,在低溫(350 ~ 500℃)下產生的生物質炭中的揮發性化合物可以刺激β-1,4-葡萄糖苷酶活性[24];B+W處理較B處理進一步提高了蔗糖酶活性,這是因為施用木灰后土壤DOC含量較高,DOC有利于直接為土壤微生物提供碳源,促進微生物繁殖,刺激了微生物對酶的分泌,進而提高土壤酶活性[25]。此外,冗余分析也表明,蔗糖酶的活性與DOC含量呈正相關關系。
3.2 生物質炭配施木灰對土壤微生物多樣性的影響
與CK相比,B處理對細菌豐富度無顯著影響,卻顯著降低了真菌Chao1、Ace指數,這主要是與培養時間和土壤pH有關。首先,生物質炭自身結構相對穩定,且含有大量不易被分解利用的多環芳香族化合物,對土壤細菌的影響是一個漫長的過程[26];此外,土壤理化環境,尤其土壤pH,是細菌豐富度和多樣性變化的主要驅動因素[27],本研究供試土壤呈堿性,添加生物質炭后土壤 pH 沒有顯著變化,故B處理對細菌豐富度和多樣性沒有顯著影響。此外,細菌比真菌更容易被生物質炭吸附[28],在一定程度上使細菌比真菌更能適應生物質炭引起的土壤環境變化[29],進而導致B處理下真菌Chao1、Ace指數降低。B+W處理下土壤pH顯著增加,導致細菌多樣性降低,這與Bang-Andreasen等[30]的研究結果一致。然而,B+W處理不僅將真菌Chao1、Ace指數恢復到與CK相似的水平,同時顯著提高了Shannon指數,表明木灰的石灰效應和養分投入可提高真菌群落穩定性[31]。
3.3 生物質炭配施木灰對微生物群落結構的影響
土壤微生物群落結構對B和B+W處理的不同響應可能與其生態特性和生態功能有關,因為微生物在營養需求、脅迫耐受性方面存在較大差異。本研究中,優勢門變形菌門保持了較高的相對豐度,這種高豐度可能是由于變形菌門對環境變化的普遍抗性導致的。在培養7 d時,B+W處理提高了變形菌門相對豐度,這是由于木灰保留了除氮以外的大多數主要礦質營養物質,而變形菌門能夠迅速利用這些營養[32],從而優化了細菌群落;另一方面,由于木灰的強堿性及其豐富的堿金屬,B+W處理降低了芽單胞菌門和擬桿菌門相對豐度。在培養118 d時,與CK相比,B和B+W處理提高了綠彎菌門的相對豐度,同樣,Chen等[33]也報道了生物質炭對這一群體的積極影響。綠彎菌門被認為是相對難降解碳的潛在降解者,可氧化芳香族化合物,將難降解碳源作為代謝底物[32]。放線菌在有機物轉化中發揮著重要作用,放線菌分泌的胞外酶可參與復雜芳香物質的降解過程,因此B處理提高了其相對豐度[34]。本研究發現,B和B+W處理擬桿菌門相對豐度顯著降低,類似的細菌群落組成變化在石灰性土壤中也有記錄[35]。這可能與土壤類型、土壤理化環境以及細菌群落內的相互競爭有關。
子囊菌門的高豐度可能是由于它們易于進行繁殖和快速生長,而不像擔子菌門生長緩慢[36]。被孢霉菌具有將生物質炭中難分解有機物降解為不穩定纖維素類化合物的能力[37],因此,B處理提高了培養過程中被孢霉菌門的相對豐度。在培養7 d時,B處理中活性碳組分可在施用初期降解,為微生物提供碳源進而促進擔子菌門相對豐度的增加。此外,擔子菌門相對豐度的增加有利于土壤中難降解化合物的降解和促進土壤碳循環[38]。在培養118 d時,B+W處理增加了土壤微生物能夠吸收利用的可溶性碳源,導致子囊菌門相對豐度顯著高于B處理。
4 結論
1)單施生物質炭、生物質炭配施木灰處理均能降低石灰性土壤有機碳的礦化,減少CO2的釋放,且生物質炭配施木灰的效果優于單施生物質炭處理。
2)單施生物質炭對細菌豐富度沒有影響,但在一定程度上改變了細菌群落結構,體現在單施生物質炭顯著提高了放線菌門和綠彎菌門相對豐度;生物質炭配施木灰降低了細菌α多樣性,同時,可維持真菌豐富度,并提高真菌多樣性。
3)冗余分析表明,單施生物質炭、生物質炭配施木灰可以通過改變土壤的理化性質間接引起微生物群落結構的變化,其中SOC、pH分別對細菌、真菌群落結構影響最顯著,且生物質炭配施木灰在降低石灰性土壤碳礦化、維持真菌群落穩定性方面效果更佳。
[1] 王昆艷, 官會林, 盧俊, 等. 生物質炭施用量對旱地酸性紅壤理化性質的影響[J]. 土壤, 2020, 52(3): 503–509.
[2] 袁晶晶, 同延安, 盧紹輝, 等. 生物炭與氮肥配施改善棗區土壤微生物學特性[J]. 植物營養與肥料學報, 2018, 24(4): 1039–1046.
[3] Xiao X, Chen B L, Chen Z M, et al. Insight into multiple and multilevel structures of biochars and their potential environmental applications: A critical review[J]. Environmental Science & Technology, 2018, 52(9): 5027–5047.
[4] Sheng Y Q, Zhan Y, Zhu L Z. Reduced carbon sequestration potential of biochar in acidic soil[J]. Science of the Total Environment, 2016, 572: 129–137.
[5] Zheng H, Wang X, Luo X X, et al. Biochar-induced negative carbon mineralization priming effects in a coastal wetland soil: Roles of soil aggregation and microbial modulation[J]. Science of the Total Environment, 2018, 610/611: 951–960.
[6] 胡瑞文, 劉勇軍, 周清明, 等. 生物炭對烤煙根際土壤微生物群落碳代謝的影響[J]. 中國農業科技導報, 2018, 20(9): 49–56.
[7] Pan F X, Li Y Y, Chapman S J, et al. Microbial utilization of rice straw and its derived biochar in a paddy soil[J]. Science of the Total Environment, 2016, 559: 15–23.
[8] Reed E Y, Chadwick D R, Hill P W, et al. Critical comparison of the impact of biochar and wood ash on soil organic matter cycling and grassland productivity[J]. Soil Biology and Biochemistry, 2017, 110: 134–142.
[9] Zhao H L, Tian X H, Chen Y L, et al. Effect of exogenous substances on soil organic and inorganic carbon sequestration under maize stover addition[J]. Soil Science and Plant Nutrition, 2017, 63(6): 591–598.
[10] Guo Y F, Zhao C W, Chen X P, et al. CO2capture and sorbent regeneration performances of some wood ash materials[J]. Applied Energy, 2015, 137: 26–36.
[11] Peltoniemi K, Pyrh?nen M, Laiho R, et al. Microbial communities after wood ash fertilization in a boreal drained peatland forest[J]. European Journal of Soil Biology, 2016, 76: 95–102.
[12] 鮑士旦. 土壤農化分析[M]. 北京: 中國農業出版社, 2010.
[13] Huang Z S, Fu Y H, Yu L F. Characteristics of soil microbial biomass carbon and soil water soluble organic carbon in the process of natural restoration of Karst forest[J]. The Journal of Applied Ecology, 2012, 23(10): 2715–2720.
[14] 馬列, 劉金華, 楊靖民, 等. 新型復合改良劑對蘇打鹽堿土的改良效果研究[J]. 中國土壤與肥料, 2021(5): 144–149.
[15] DeForest J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and l-DOPA[J]. Soil Biology and Biochemistry, 2009, 41(6): 1180–1186.
[16] Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology and Biochemistry, 2011, 43(6): 1169–1179.
[17] Kleber M, Eusterhues K, Keiluweit M, et al. Mineral-organic associations: Formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1–140.
[18] 杜倩, 黃容, 李冰, 等. 生物炭還田對植煙土壤活性有機碳及酶活性的影響[J]. 核農學報, 2021, 35(6): 1440–1450.
[19] Zhao C S, Zhang Y P, Liu X B, et al. Comparing the effects of biochar and straw amendment on soil carbon pools and bacterial community structure in degraded soil[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(2): 751–760.
[20] Andersson S, Nilsson S I, Saetre P. Leaching of dissolved organic carbon (DOC) and dissolved organic nitrogen (DON) in mor humus as affected by temperature and pH[J]. Soil Biology and Biochemistry, 2000, 32(1): 1–10.
[21] 章明奎, Walelign D Bayou, 唐紅娟. 生物質炭對土壤有機質活性的影響[J]. 水土保持學報, 2012, 26(2): 127–131,137.
[22] 張帥, 成宇陽, 吳行, 等. 生物炭施用下潮土團聚體微生物量碳氮和酶活性的分布特征[J]. 植物營養與肥料學報, 2021, 27(3): 369–379.
[23] Song X N, Razavi B S, Ludwig B, et al. Combined biochar and nitrogen application stimulates enzyme activity and root plasticity[J]. Science of the Total Environment, 2020, 735: 139393.
[24] Ameloot N, De Neve S, Jegajeevagan K, et al. Short-term CO2and N2O emissions and microbial properties of biochar amended sandy loam soils[J]. Soil Biology and Biochemistry, 2013, 57: 401–410.
[25] 張桃香, 鄭鈺銦, 陳輝. 不同溫度生物炭對油茶林紅壤呼吸作用和酶活性的影響研究[J]. 土壤通報, 2019, 50(1): 96–102.
[26] Dong X L, Li G T, Lin Q M, et al. Quantity and quality changes of biochar aged for 5 years in soil under field conditions[J]. CATENA, 2017, 159: 136–143.
[27] Joa J H, Weon H Y, Hyun H N, et al. Effect of long-term different fertilization on bacterial community structures and diversity inorchard soil of volcanic ash[J]. Journal of Microbiology, 2014, 52(12): 995–1001.
[28] Pietik?inen J, Kiikkil? O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231–242.
[29] Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota - A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812–1836.
[30] Bang-Andreasen T, Nielsen J T, Voriskova J, et al. Wood ash induced pH changes strongly affect soil bacterial numbers and community composition[J]. Frontiers in Microbiology, 2017, 8: 1400.
[31] Augusto L, Bakker M R, Meredieu C. Wood ash applications to temperate forest ecosystems—potential benefits and drawbacks[J]. Plant and Soil, 2008, 306(1/2): 181–198.
[32] Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354–1364.
[33] Chen J H, Liu X Y, Li L Q, et al. Consistent increase in abundance and diversity but variable change in community composition of bacteria in topsoil of rice paddy under short term biochar treatment across three sites from South China[J]. Applied Soil Ecology, 2015, 91: 68–79.
[34] 顧美英, 唐光木, 劉洪亮, 等. 施用棉稈炭對新疆連作棉花根際土壤微生物群落結構和功能的影響[J]. 應用生態學報, 2016, 27(1): 173–181.
[35] Cheng J Z, Lee X, Tang Y, et al. Long-term effects of biochar amendment on rhizosphere and bulk soil microbial communities in a Karst region, southwest China[J]. Applied Soil Ecology, 2019, 140: 126–134.
[36] Liu D, Keiblinger K M, Schindlbacher A, et al. Microbial functionality as affected by experimental warming of a temperate mountain forest soil—A metaproteomics survey[J]. Applied Soil Ecology, 2017, 117/118: 196–202.
[37] Koechli C, Campbell A N, Pepe-Ranney C, et al. Assessing fungal contributions to cellulose degradation in soil by using high-throughput stable isotope probing[J]. Soil Biology and Biochemistry, 2019, 130: 150–158.
[38] Ren C J, Zhao F Z, Kang D, et al. Linkages of C: N stoichiometry and bacterial community in soil following afforestation of former farmland[J]. Forest Ecology and Management, 2016, 376: 59–66.
Effect of Biochar and Wood Ash Addition on Calcareous Soil Carbon Sequestration and Microbial Community
WANG Li, ZHAO Huili*, ZHAO Ying
(College of Resources and Environmental Engineering, Ludong University, Yantai, Shandong 264025, China)
In order to explore the effects of biochar combined with wood ash on soil carbon sequestration and microbial community, the changes of soil carbon sequestration, soil chemical properties, enzyme activities and microbial community compositions under biochar (B) and biochar combined with wood ash (B+W) treatments were studied through 118-day laboratory incubation. The results showed that both B and B+W treatments decreased the respiration rate and cumulative CO2-C respiration, and B + W treatment delayed the peak of CO2-C respiration. B and B+W treatments could increase the content of soil organic carbon and inorganic carbon.On day 118, the microbial biomass carbon of B and B+W treatments was higher than that of control, and that of B treatment was higher than that of B+W treatment, B+W treatment significantly increased the content of soil dissolved organic carbon and pH. B treatment increased the activities of β-1,4-glucosidase, the activities of β-1,4-xylosidase, β-1,4-glucosidase in B+W treatment were decreased by 38.4%, 15.3%, and the activity of invertase was increased by 61.4% respectively, as compared to control. B treatment had no significant effect on bacterial richness and diversity, but decreased Chao1 and Ace index of fungi; B+W treatment decreased the bacterial richness and diversity, but restored the fungal Chao1 and Ace index, and significantly increased Shannon index. On day 118, B treatment increased the relative abundance of Actinomycetes and decreased the relative abundance of Ascomycetes, B+W treatment increased the relative abundance of Chloroflexi and Basidiomycota, but decreased the relative abundance of Bacteroidetes. Redundancy analysis showed that biochar and biochar combined with wood ash affected soil microbial community by changing the soil chemical properties, soil organic carbon and pH were the most significant soil factors affecting bacterial and fungal community structure, respectively, B+W treatment showed better performance in reducing carbon mineralization in calcareous soils and maintaining the stability of the fungal community.
Carbon sequestration; Microbial community; Biochar; Wood ash; Calcareous soil.
S154.36
A
10.13758/j.cnki.tr.2022.02.015
王麗, 趙惠麗, 趙英. 生物質炭配施木灰對石灰性土壤固碳和微生物群落的影響. 土壤, 2022, 54(2): 320–328.
山東省自然科學基金項目(ZR2020QD115)和山東省杰出青年基金項目(ZR2019JQ12)資助。
(zhl880227@126.com)
王麗(1996—),女,山東臨沂人,碩士研究生,主要從事濱海鹽堿地改良研究。E-mail: wl15254589861@163.com

