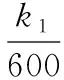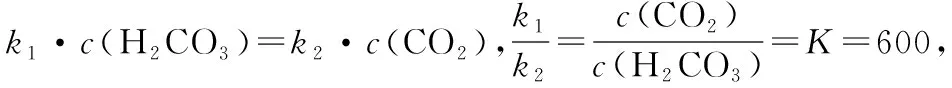從速率方程探析外界條件對化學反應速率的影響
安徽 董 順
外界條件對化學反應速率的影響,從定性角度分析,一般認為,其他條件不變時,增大反應物濃度或壓強(僅對氣體反應物而言),反應速率加快;升高溫度,反應速率加快;加入催化劑,反應速率加快。但是,這個規(guī)律并不是一成不變的,如對于某些化學反應,升高溫度速率反而下降,增大不同反應物濃度往往對反應速率的影響程度不同,甚至改變某些反應物的濃度對反應速率沒有影響。從定量角度分析,可以用速率方程表示濃度對反應速率的影響,反應速率與濃度的關系只能通過實驗來測定。實驗證明,反應物濃度與反應速率呈如下函數關系:aA+bB=eE+fF,rate=kcx(A)·cy(B),該式稱為反應速率方程或質量作用定律。式中k代表速率常數,x、y可以是正整數、零、負整數或分數。
下面筆者結合幾道具體的高考試題來分析外界條件對反應速率的影響。
1.某些反應物的濃度對反應速率沒有影響

( )
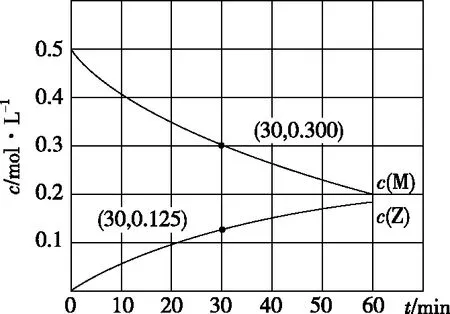
圖1
A.0~30 min時間段內,Y的平均反應速率為6.67×10-3mol·L-1·min-1
B.反應開始后,體系中Y和Z的濃度之比保持不變
C.如果反應能進行到底,反應結束時62.5%的M轉化為Z
D.反應①的活化能比反應②的活化能大
【參考答案】A

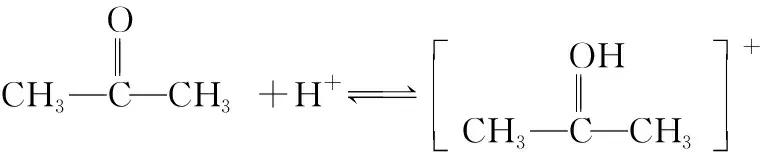
(慢)
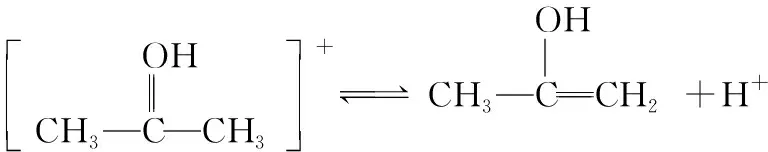
(快)
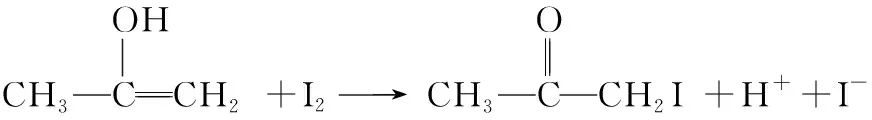
根據反應歷程能夠看出步驟①是該反應的決速步驟,活化能較大,因此改變步驟①反應物的濃度對反應速率影響較大,而改變步驟②和③的反應物濃度對反應速率影響較小或沒有影響。由此可知,不同反應物濃度的改變對反應速率的影響程度是由反應歷程決定的。
2.反應速率與某些物質的濃度成負相關
【例2】(2021·湖北省選擇性考試·19節(jié)選)丙烯是一種重要的化工原料,可以在催化劑作用下,由丙烷直接脫氫或氧化脫氫制備。
(4)恒溫剛性密閉容器中通入氣體分壓比為p(C3H8)∶p(O2)∶p(N2)=2∶13∶85的混合氣體,已知某反應條件下只發(fā)生如下反應(k,k′為速率常數):


實驗測得丙烯的凈生成速率方程為v(C3H6)=kp(C3H8)-k′p(C3H6),可推測丙烯的濃度隨時間的變化趨勢為________,其理由是________。
【參考答案】先增大后減小 反應開始時,體系中主要發(fā)生反應Ⅱ,c(C3H6)逐漸增大,隨著反應進行,p(C3H8)減小,p(C3H6)增大,v(C3H6)減小,體系中主要發(fā)生反應Ⅲ,c(C3H6)逐漸減小
【解析】反應開始時,反應Ⅱ向右進行,c(C3H6)逐漸增大,且體系中以反應Ⅱ為主,隨著反應進行,p(C3H8)減小,p(C3H6)增大,使得v(C3H6)減小,體系中以反應Ⅲ為主,因此丙烯的濃度隨時間的變化趨勢為先增大后減小。隨著丙烯濃度的增大,副反應丙烯的氧化速率也會增大,因此工業(yè)生產中應該及時將丙烯分離出來以提高其產率。
【例3】(2018·全國卷Ⅱ·27節(jié)選)CH4-CO2催化重整不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
(2)反應中催化劑活性會因積碳反應而降低,同時存在的消碳反應則使積碳量減少。相關數據如表:
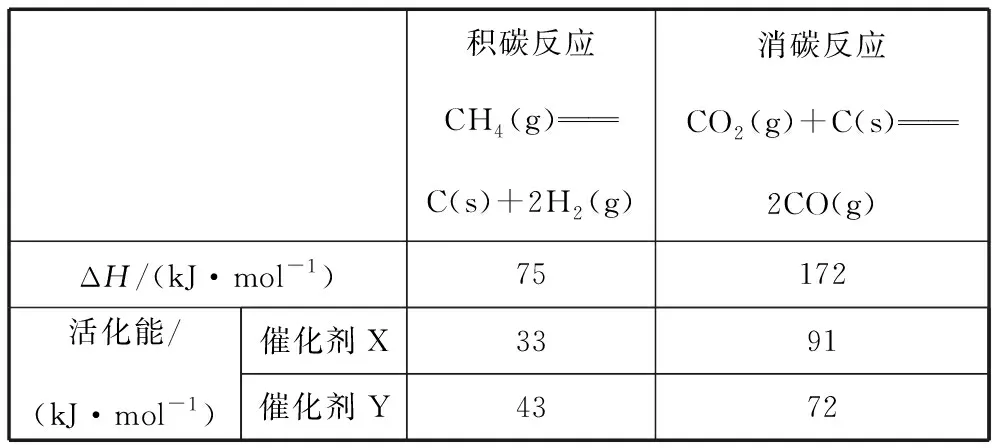
積碳反應CH4(g)C(s)+2H2(g)消碳反應CO2(g)+C(s)2CO(g)ΔH/(kJ·mol-1)75172活化能/(kJ·mol-1)催化劑X3391催化劑Y4372
①由上表判斷,催化劑X________(填“優(yōu)于”或“劣于”)Y,理由是________。
在反應進料氣組成、壓強及反應時間相同的情況下,某催化劑表面的積碳量隨溫度的變化關系如圖2所示。升高溫度時,下列關于積碳反應、消碳反應的平衡常數(K)和速率(v)的敘述正確的是________(填標號)。
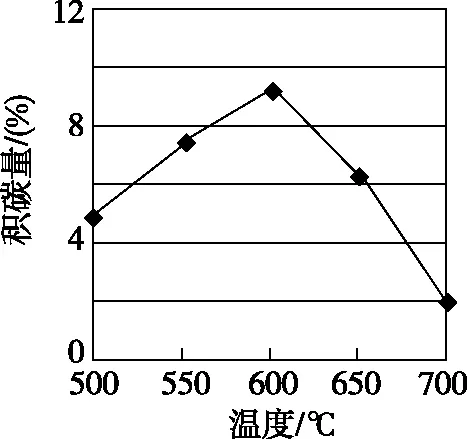
圖2
A.K積、K消均增加
B.v積減小、v消增加
C.K積減小、K消增加
D.v消增加的倍數比v積增加的倍數大
②在一定溫度下,測得某催化劑上沉積碳的生成速率方程為v=k·p(CH4)·[p(CO2)]-0.5(k為速率常數)。在p(CH4)一定時,不同p(CO2)下積碳量隨時間的變化趨勢如圖3所示,則pa(CO2)、pb(CO2)、pc(CO2)從大到小的順序為________。
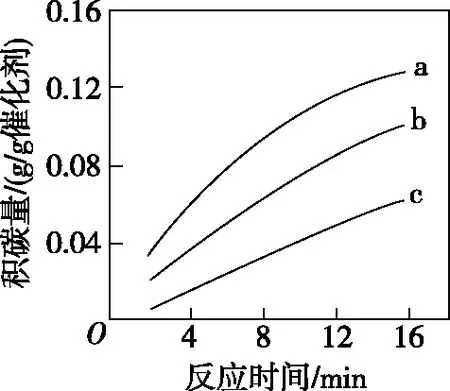
圖3
【參考答案】①劣于 相對于催化劑X,催化劑Y積碳反應的活化能大,積碳反應的速率小;而消碳反應活化能相對小,消碳反應速率大 AD
②pc(CO2)、pb(CO2)、pa(CO2)
【解析】(2)①從表格中數據可看出在催化劑Y的催化下,積碳反應活化能更高,消碳反應活化能更低,反應速率更大,積碳量更小,催化劑Y活性比催化劑X更不易降低,故催化劑X劣于催化劑Y。結合圖示可知500~600℃隨溫度升高積碳量增加,而 600~700℃隨溫度升高積碳量減少,故消碳反應速率增大的速度比積碳反應速率增大的要快,由表格中數據可知,積碳反應和消碳反應均為吸熱反應,故隨溫度升高,K積和K消均增加,即AD均正確。②由速率表達式可知CO2的壓強越大,反應速率越慢,即單位時間內積碳量越少,結合圖示可知CO2壓強從大到小的順序為pc(CO2)、pb(CO2)、pa(CO2)。
由②可知,沉積碳的生成速率之所以會與p(CO2)成反比,是由于p(CO2)增加導致消碳反應速率增加,所以積碳量減少。2019年魯科版化學反應原理教材中給出的工業(yè)合成氨的速率方程為v=k·c(N2)·c1.5(H2)·c-1(NH3),該速率方程是由實驗測定獲得的,該反應速率是正逆反應速率的總結果,也就是說氨氣濃度越大,逆反應速率越大,氨氣分解速率越大,故合成氨的速率與氨氣濃度成反比。由①可知,升高溫度對化學反應速度的影響,與學生的固有認知并不完全相同。
3.升高溫度對反應速率的影響出現先增大后減小
由【例3】中圖2可知溫度升高積碳量先增加后減小,原因是開始積碳反應速率大于消碳反應速率,隨著溫度的升高積碳反應、消碳反應速率均增加,但是改變相同的溫度,消碳反應速率增加的倍數比積碳反應速率增加的倍數大,究其原因是消碳反應的活化能大,溫度對反應速率的影響更大。
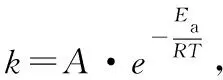
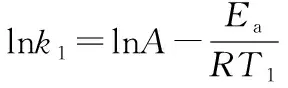
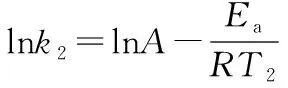
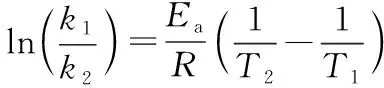
由上式可以看出,當改變相同溫度時,Ea越大,速率常數k變化越大,溫度對反應速率的影響也就越大。
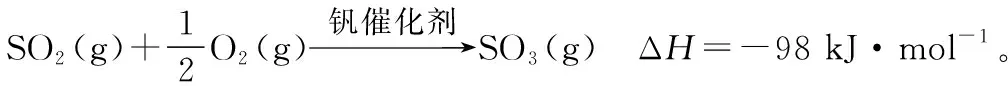
(4)研究表明,SO2催化氧化的反應速率方程為
式中:k為反應速率常數,隨溫度t升高而增大;α為SO2平衡轉化率,α′為某時刻SO2轉化率,n為常數。在α′=0.90時,將一系列溫度下的k、α值代入上述速率方程,得到v~t曲線,如圖4所示。
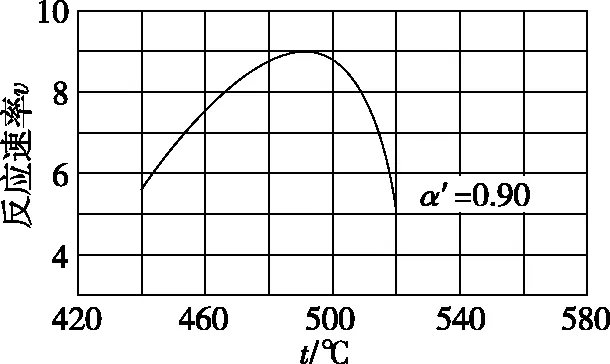
圖4
曲線上v最大值所對應溫度稱為該α′下反應的最適宜溫度tm。t
【參考答案】升高溫度,k增大使v逐漸提高,但α降低使v逐漸下降。當t
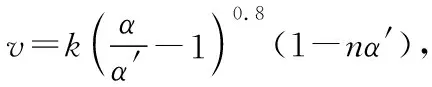
溫度對反應速率的影響是非常復雜的,一般是由實驗測得的。例如,對于可逆反應,溫度升高正反應速率加快、逆反應速率也加快,但凈反應速率是否加快取決于正、逆反應速率加快的相對大小。再比如,催化劑都有最適溫度,當溫度高于最適溫度時,催化劑活性降低,也會使反應速率降低。還有些反應溫度的改變可能使化學反應發(fā)生改變,如金屬鈉與氧氣的反應、鐵和濃硫酸的反應。溫度與速率的幾種常見關系如圖5所示。

a
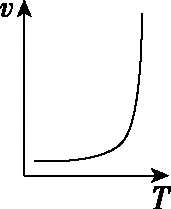
b
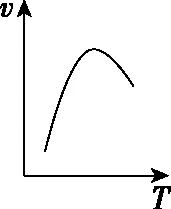
c
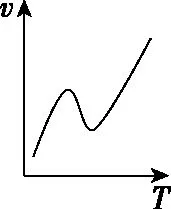
d
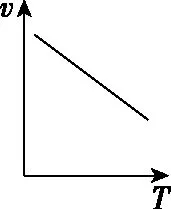
e
4.高考中出現的其他類型的速率方程
【例5】(2020·全國卷Ⅱ·28節(jié)選)天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。
①設反應開始時的反應速率為r1,甲烷的轉化率為α時的反應速率為r2,則r2=________r1。
②對于處于初期階段的該反應,下列說法正確的是________。
A.增加甲烷濃度,r增大
B.增加H2濃度,r增大
C.乙烷的生成速率逐漸增大
D.降低反應溫度,k減小
【參考答案】①1-α②AD
【解析】①根據r=k×c(CH4),若r1=kc,甲烷轉化率為α時,甲烷的濃度為c(1-α),則r2=kc(1-α),所以r2=(1-α)r1。②增大反應物濃度,反應速率增大,A正確;由速率方程可知,初期階段的反應速率與氫氣濃度無關,B錯誤;反應物甲烷的濃度逐漸減小,結合速率方程可知,乙烷的生成速率逐漸減小,C錯誤;化學反應速率與溫度有關,溫度降低,反應速率減小,即k減小,D正確。
【例6】(2021·海南省選擇性考試·16節(jié)選)碳及其化合物間的轉化廣泛存在于自然界及人類的生產和生活中。