深度理解《課程標準》,精準把握備考方向
——以2021年高考中催化劑的考查為例
河北 晏富強 文玉玲
2020年以后的高考化學試題是依據《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課程標準》)學業要求進行命題,與曾經的高考考試大綱對比發現,對催化劑的考查要求有很大的改變,《普通高中化學課程標準(實驗)版》高考考試大綱(2019年)要求的是了解反應活化能的概念,了解催化劑的重要作用;《課程標準》學業要求的是通過實驗探究,了解溫度、濃度、壓強和催化劑對化學反應速率的影響。知道化學反應是有歷程的,認識基元反應活化能對化學反應速率的影響。催化劑在現代化學工業中有極其重要的作用,近年的高考題都比較注重化學問題的情境設置,強調了化學與社會發展的重要聯系,催化劑在高考中由邊緣知識逐步變為重要考點,特別是2021年高考多道高考題對此進行了考查,其考查的知識面廣,對考生的要求能力高。教師通過分析這些高考題啟發學生深度思考,不僅可以夯實學生必備知識形成關鍵能力,還能提高學生化學學科核心素養。
一、從教材概念了解催化劑
在初中教材上催化劑是“在化學反應里能改變其他物質的化學反應速率,而本身的質量和化學性質在反應前后都沒有發生變化的物質”。
在蘇教版高中化學教材對催化劑有如下描述:“催化劑對化學反應速率有顯著影響,是通過降低反應所需的活化能來增大反應速率的。”由此可知催化劑只改變了反應的途徑沒有改變反應的熱效應。在可逆反應中催化劑可以改變化學反應速率但不會使平衡移動。催化劑是通過降低反應所需的活化能來增大反應速率的。沒有催化劑的反應,活化能較大,則反應速率較小;而有催化劑參與的反應,活化能較小,則反應速率較大。
【例1】(2021·廣東省選擇性考試·19節選)一定條件下,CH4分解形成碳的反應歷程如圖1所示。該歷程分________步進行,其中,第________步的正反應活化能最大。
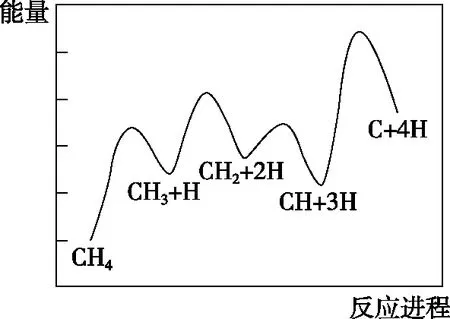
圖1
【參考答案】4;4
【解析】由圖1可知,反應過程中能量變化出現了4個峰,即有4個過渡態出現了4次活化能,經歷了4步反應;且從左往右看4次活化能吸收中,第4次對應的峰最高,即正反應方向第4步吸收的能量最多,對應的正反應活化能最大,活化能較大反應速率慢。
教師要讓學生深度理解概念就需要讓學生知道概念形成的理論依據,從反應歷程和活化能的角度深度思考催化劑催化的機理,加深學生對催化劑的理解。
二、從反應歷程認識催化劑和中間產物
《課程標準》學業要求學生要知道化學反應是有歷程的,認識到催化劑(正催化劑)本身和反應物一起參加了化學反應,降低了反應所需要的活化能;也有些催化反應是由于形成了很容易發生反應的中間產物,反應時催化劑恢復了原來的化學組成。催化反應是一個復雜反應,要經過若干基元反應才能完成,這些基元反應描述了復雜反應所經過的途徑,在化學動力學上稱為反應歷程。催化劑只能改變反應途徑而不能改變反應發生的方向。
【例2】(2021·湖南省選擇性考試·14)鐵的配合物離子(用[L—Fe—H]+表示)催化某反應的一種反應機理和相對能量的變化情況如圖2所示:
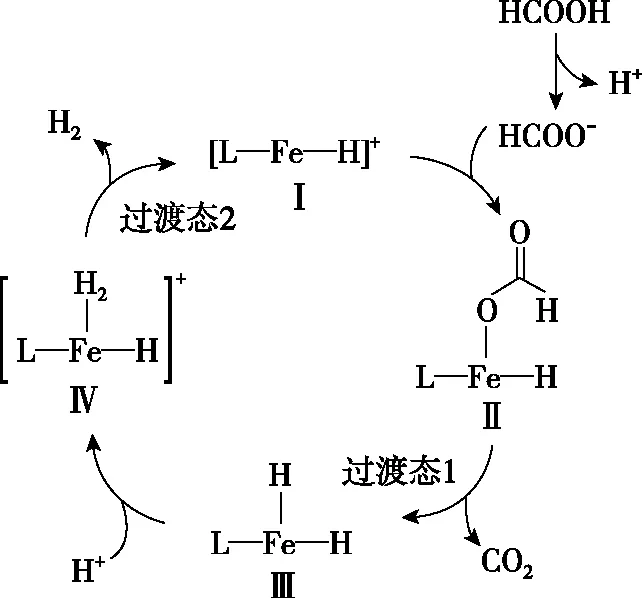
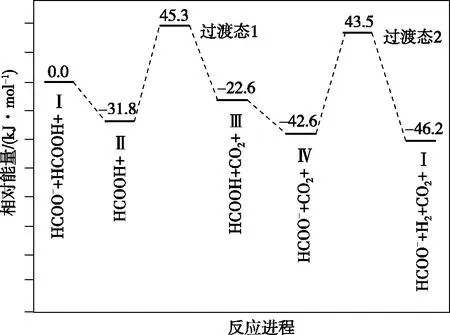
圖2
下列說法錯誤的是
( )
B.H+濃度過大或者過小,均導致反應速率降低
C.該催化循環中Fe元素的化合價發生了變化
D.該過程的總反應速率由Ⅱ→Ⅲ步驟決定
【參考答案】CD
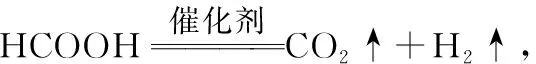
【深度思考】基元反應中[L—Fe—H]+參與反應,在反應前后的質量和化學性質不變,起催化劑的作用,H+和除了[L—Fe—H]+以外的鐵的化合物起中間產物的作用。怎樣判斷催化劑和中間產物是學生答題時存在的問題,一般來說催化劑是前面一個基元反應的反應物,是最后一個基元反應的生成物,而且反應前后的質量和化學性質不變化,可以總結為“失而復得”。中間產物是前面一個基元反應的生成物,是后面某一個基元反應的反應物,不會在總反應的生成物中出現,中間產物往往不穩定,可以把中間產物總結為“自生自滅”。在能量圖中除了反應物、生成物之外所有的“峰頂”就是過渡態,所有“谷底”就是中間體;過渡態能量比較高一定不太穩定,中間體能量相對較低相對比較穩定,有一定的存在時間。
三、從基元反應活化能理解催化劑對化學反應速率的影響
《課程標準》學業要求學生認識基元反應活化能對化學反應速率的影響。在蘇教版高中教材對活化能是這樣描述的,反應物轉化為生成物的過程要經過能量較高的過渡態,過渡態的平均能量與反應物分子的平均能量的差為反應的活化能。如圖3所示,Ea2是該反應無催化劑的活化能,Ea1和Ea3是該反應有催化劑后兩個基元反應的活化能,Ea1逆是第一個基元反應的逆反應活化能。
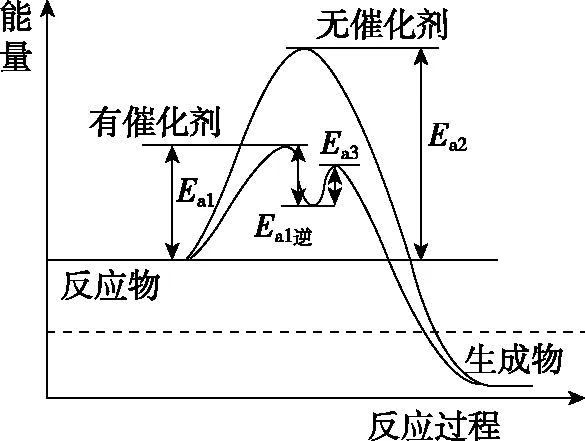
圖3
【例3】(2021·河北省選擇性考試·16節選)在電解質水溶液中,三種不同催化劑(a、b、c)上CO2電還原為CO的反應進程中(H+電還原為H2的反應可同時發生),相對能量變化如圖4。由此判斷,CO2電還原為CO從易到難的順序為________(用a、b、c字母排序)。
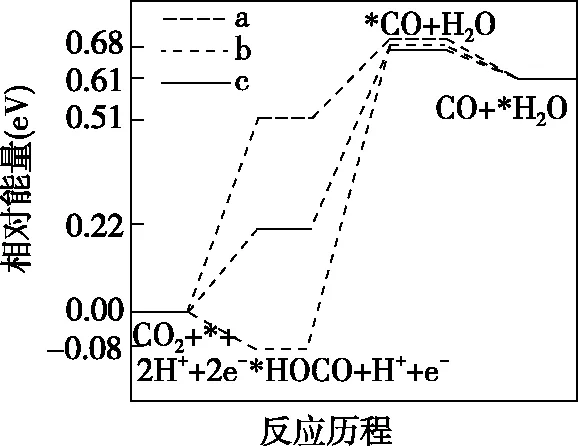
(a)CO2電還原為CO
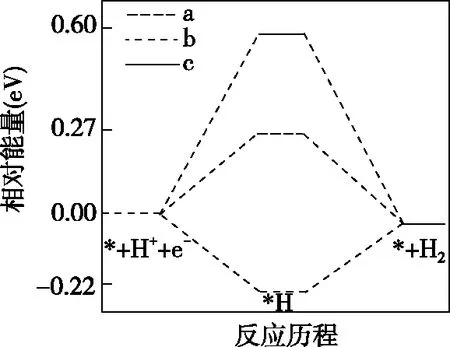
(b)H+電還原為H2
【參考答案】c、b、a
【解析】由圖4可知,a催化劑條件下,H+電還原的活化能為0.27 eV,CO2電還原的活化能為0.51 eV,相比較H+電還原的活化能比CO2電還原的活化能小0.24 eV,發生H+電還原的可能性大于發生CO2電還原的可能性。b催化劑條件下,H+電還原的活化能為-0.22 eV,CO2電還原的活化能為-0.08 eV,相比較H+電還原的活化能比CO2電還原的活化能小0.14 eV,發生H+電還原的可能性大于發生CO2電還原的可能性,但和a催化劑條件下相比較,b催化劑條件下發生CO2電還原的可能性比a催化劑條件下大。c催化劑條件下,CO2電還原的活化能為0.22 eV,H+電還原的活化能為0.60 eV,更容易發生CO2的電還原。因此反應從易到難的順序為c、b、a。

四、建構解題模型,形成關鍵能力
催化劑在化學工業廣泛使用,將來催化劑在科學理論研究、氫能源的開發與利用,碳中和及環境的治理與保護方面都有極大的發展前景。今年高考中催化劑檢測學生核心素養的功能更加突顯,要求學生具備處理圖像、表格等信息的能力,吸收信息能力,理解與辨析能力,基于證據進行分析、推理能力。在二輪復習中學生需依據教材和《課程標準》要求建構催化劑的知識模型,可以概括為“四能四不能”。
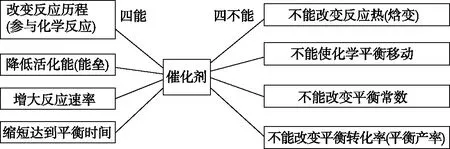
圖5
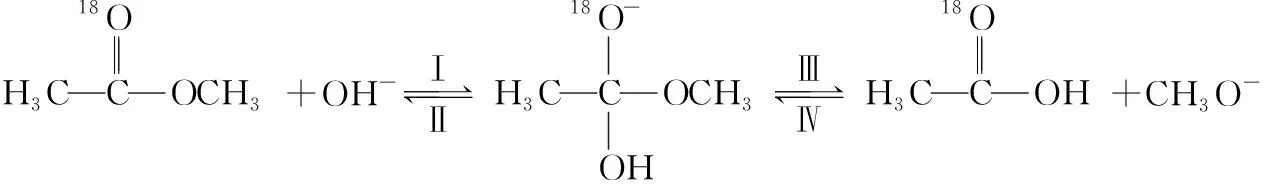
( )
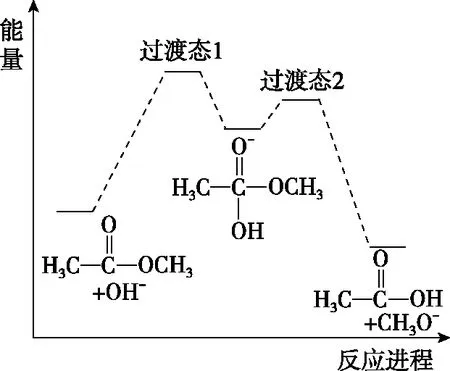
圖6
A.反應Ⅱ、Ⅲ為決速步
B.反應結束后,溶液中存在18OH-
C.反應結束后,溶液中存在CH318OH
D.反應I與反應Ⅳ活化能的差值等于圖示總反應的焓變
【參考答案】B
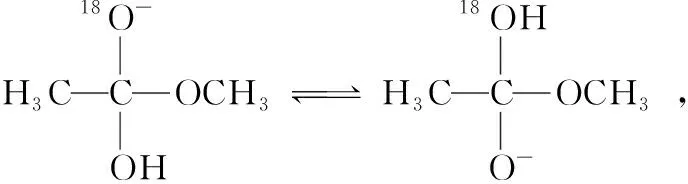
在以上必備知識的基礎上,教師總結近幾年高考題解題規律,發現有關催化劑的考查逐漸將定性問題變為定量化,結論性問題過程化,宏觀性問題微觀化等,試題通過圖文、表格、流程、實驗數據等多種信息呈現,注重對學生化學核心素養的考查。涉及催化劑原理的問題,可讓學生形成如圖7審題和思考此類題目的解題模型:
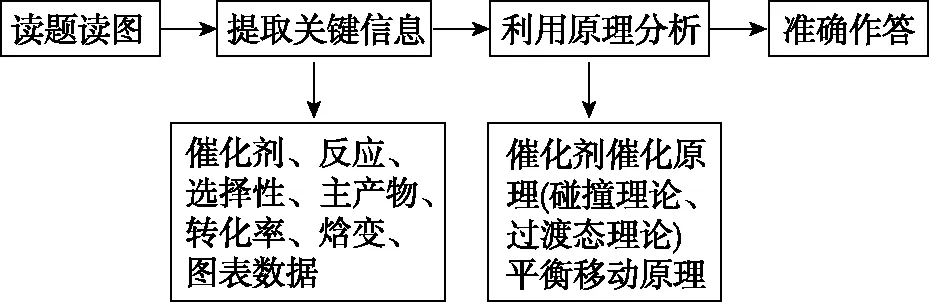
圖7
【例5】[2019·全國卷Ⅰ·28(3)]我國學者結合實驗與計算機模擬結果,研究了在金催化劑表面上水煤氣變換的反應歷程,如圖8所示,其中吸附在金催化劑表面上的物種用*標注。
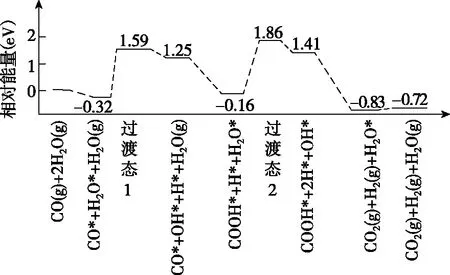
圖8
可知水煤氣變換的ΔH________(填“大于”“等于”或“小于”)0。該歷程中最大能壘(活化能)E正=________eV,寫出該步驟的化學方程式:____________________。

【解析】提取關鍵信息:由題中圖示可知水煤氣變換時反應物的總相對能量0 eV,反應后生成物的總相對能量-0.72 eV,反應為放熱反應,故ΔH小于零。



