豁痰解毒通絡飲通過內質網應激-線粒體凋亡途徑干預大鼠頸總動脈球囊損傷后再狹窄的作用機制
田騰輝,鄧 悅,Tumurkhuyag Atartsetseg,常立萍,石 銳,于克英,張 淼
近年來,隨著生活方式及飲食結構改變,人們罹患心血管疾病的危險因素不斷增加,導致冠心病發病率和死亡率逐年升高,已成為嚴重威脅人類生命健康的主要疾病之一[1]。經皮冠狀動脈介入(PCI)為冠心病病人帶來福音,是目前防治心血管疾病的重要手段[2]。新一代藥物洗脫支架(DES)的應用極大地降低了急性心血管事件死亡率,但晚期支架衰竭是關注的焦點問題。有研究顯示,支架內新生動脈粥樣硬化是導致晚期血管再狹窄的重要因素[3],且與血管內膜中內質網應激-凋亡機制密切相關[4-5]。中醫藥在再狹窄的治療中發揮著重要作用[6-7],在心血管疾病領域中具有廣闊的研究前景和挖掘潛力。豁痰解毒通絡飲是鄧悅教授基于“痰瘀伏絡”學說研制的中藥方劑,多項研究表明豁痰解毒通絡飲有確切的臨床療效[8-9]。本研究探討豁痰解毒通絡飲在再狹窄形成過程中的作用機制,為多靶點防治PCI術后再狹窄提供依據。
1 材料與方法
1.1 實驗動物 5周齡無特定病原體(SPF)級雄性SD大鼠,350~400 g,購自遼寧長生生物技術股份有限公司,動物生產許可證號:SCXK(遼)2015-0001,飼養于長春中醫藥大學動物實驗中心。本研究動物實驗經過長春中醫藥大學倫理委員會審核。
1.2 實驗藥物及試劑 豁痰解毒通絡飲,組方:全瓜蔞20 g,丹參15 g,金銀花30 g,當歸15 g,甘松15 g等。中藥由長春中醫藥大學附屬醫院新綠色顆粒藥房提供;阿托伐他汀(輝瑞制藥有限公司生產,生產批號:S90893,國藥準字:H20051408);兔源一抗購自Cell Signaling公司;引物序列合成于庫美生物科技有限公司。
1.3 實驗儀器 7500型實時熒光定量聚合酶鏈式反應(RT-qPCR)儀(美國Bio-Rad公司);M200PRO型酶標儀(瑞士Tecan公司);RM2135 石蠟切片機(德國Leica公司);FL1000型電化學發光(ECL)智能成像儀(美國Thermo Fisher公司)。
1.4 實驗方法
1.4.1 動物分組 將24只雄性SD大鼠隨機分為假手術組(Sham組)、球囊損傷模型組(模型組)、中藥組和西藥組,每組6只。適應性喂養3 d后行頸動脈球囊損傷術[10]。西藥組給予阿托伐他汀[1.19 mg/(kg·d)]灌胃,中藥組給予豁痰解毒通絡方[16.33 g/(kg·d)]灌胃,其余兩組予以等體積生理鹽水灌胃。連續灌胃4周。
1.4.2 動物模型構建 術前12 h禁食不禁水,腹腔注射1%戊巴比妥鈉(40 mg/kg)麻醉,頸部備皮后行頸部正中切口,鈍性分離至左頸總動脈,頸外動脈用眼科剪45°作一V型切口,插入球囊約3 cm,調整球囊壓力3.0~5.2 atm,將球囊旋轉抽出至頸總動脈遠心端,重復3次操作,結扎頸外動脈近心端,無出血后逐層縫合。Sham組僅結扎頸外動脈。每只大鼠術后腹腔注射青霉素20×104U預防感染。
1.4.3 蘇木精-伊紅(hematoxylin-eosin,HE)染色 取頸動脈損傷段浸入4%多聚甲醛固定、脫水、石蠟包埋后4 μm切片,經HE染色、封片后光鏡下觀察各組大鼠頸總動脈內膜增生情況。
1.4.4 免疫組化法實驗 將石蠟包埋切片經常規脫蠟水化,通過抗原修復、封閉后,加入C/EBP同源蛋白(C/EBP homoiogousprotein,CHOP)抗體4 ℃孵育過夜,二抗37℃避光放置35min,使用二氨基聯苯胺(3,3′-diaminobenzidine,DAB)顯色后蘇木素復染,并脫水封片。在400倍光鏡下觀察血管CHOP蛋白陽性表達情況。
1.4.5 蛋白免疫印跡實驗 組織液氮研磨后,加入預冷的RIPA裂解液,勻漿后以12 000 r/min離心10 min,取上清液,采用2,2-聯喹啉-4,4-二甲酸二鈉(BCA)試劑盒測定。配制10%的十二烷硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE),設置恒壓為70 V、30 min,后轉為140 V、35 min。聚偏氟乙烯(PVDF)膜于5%脫脂奶粉中封閉1.5 h,一抗(1∶2 000)4 ℃孵育過夜,二抗(1∶2 000)孵育2 h,每個步驟間均以磷酸鹽緩沖液(PBST)洗脫5次,每次5 min。ECL顯色,采用Image J軟件計算灰度值。
1.4.6 RT-qPCR 常規Trizol法提取總RNA,并反轉錄成cDNA進行PCR實驗,體系為25 μL。反轉錄條件:37 ℃ 15 min;85 ℃ 5 s;PCR擴增條件95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40個循環。CHOP引物序列:正向引物為CATGAACTGTTGGCATCACC,反向引物為CTACCCTCAGTCCCCTCCTC;Bax引物序列:正向引物為GAGGACGCATCCACCA,反向引物為GCCTTGAGCACCAGTT;GAPDH引物序列:正向引物為TACCCACGGCAAGTTCAA,反向引物為GCCAGTAGACTCCACGACAT。計算待測樣本基因CT值,相對基因表達量用2-△△CT表示。

2 結 果
2.1 各組大鼠頸動脈內膜增生情況 Sham組血管形態完整,內皮層形態完整,內皮細胞單層規律排列,中膜由均勻連續的梭形平滑肌細胞構成;與Sham組比較,模型組內膜增厚,管腔狹窄;與模型組比較,中藥組及西藥組內膜增生情況緩解。詳見圖1。
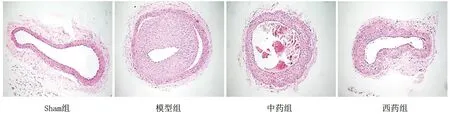
圖1 各組大鼠頸動脈內膜增生HE染色圖(×100)
2.2 各組新生血管內膜CHOP蛋白陽性表達情況 光鏡下,血管平滑肌細胞和內皮細胞胞核中陽性CHOP表達呈黃棕色顆粒。與Sham組比較,模型組頸動脈CHOP蛋白表達量增加;與模型組比較,中藥組和西藥組CHOP蛋白陽性表達減少。詳見圖2。
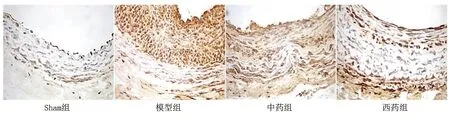
圖2 各組大鼠頸總動脈新生內膜CHOP蛋白免疫組化圖(×400)
2.3 豁痰解毒通絡飲對大鼠頸總動脈蛋白激酶R樣內質網激酶(protein kinase R-like ER kinase,PERK)、CHOP、Bax、Bcl-2蛋白表達的影響 與Sham組比較,模型組頸動脈PERK、CHOP、Bax蛋白表達水平增加(P<0.01),Bcl-2蛋白表達水平減少(P<0.01);與模型組比較,中藥組和西藥組PERK、CHOP、Bax蛋白表達均降低(P<0.05),Bcl-2蛋白表達升高(P<0.05)。詳見圖3。

與Sham組比較,*P<0.01;與模型組比較,#P<0.05。圖3 各組大鼠頸總動脈PERK、CHOP、Bax、Bcl-2蛋白表達比較(A為各蛋白條帶圖;B為PERK蛋白表達柱狀圖;C為CHOP蛋白表達柱狀圖;D為Bcl-2/Bax蛋白表達柱狀圖;E為Bcl-2蛋白表達柱狀圖;F為Bax蛋白表達柱狀圖。a為Sham組;b為模型組;c為中藥組;d為西藥組)
2.4 各組大鼠頸總動脈CHOP、Bax mRNA表達比較 與Sham組比較,模型組大鼠頸總動脈CHOP、Bax mRNA表達增加(P<0.01);與模型組比較,中藥組和西藥組CHOP、Bax mRNA表達均降低(P<0.05)。詳見表1。

表1 各組大鼠頸總動脈CHOP、Bax mRNA表達比較(±s)
3 討 論
近年來,PCI在冠心病治療中發揮著重要作用。在血管動脈粥樣硬化基礎上,PCI機械損傷和細胞后疊加作用發生病理變化,引起并持續加重術后管腔再狹窄。再狹窄是造成PCI治療局限的主要因素[11]。目前,再狹窄的研究多從炎癥反應、血栓形成、血管平滑肌細胞增殖與凋亡失衡[12]等方面展開,但潛在的機制需進一步深入探討。
內質網已成為慢性代謝性疾病的研究熱點問題。內質網穩態可能受到多種生理及病理因素影響[13],內質網穩態紊亂時,誘導自我保護機制即內質網應激反應(ERS)發生,其中,未折疊蛋白反應 (unfolded protein response,UPR)是ERS的主要應激途徑。當錯誤折疊或未折疊蛋白在內質網中不斷積累時,UPR信號通過3種已知的駐留蛋白感知:肌醇需要蛋白1(IRE1)、PERK和激活轉錄因子6(ATF6)。這些壓力傳感器中每一種蛋白激活均誘導一系列的糾正措施緩解內質網應激壓力,病理情況下,持續的ERS可誘導1個或多個促凋亡信號通路活化[14]。多項研究表明,ERS可促進新內膜形成,認為是促進動脈粥樣硬化形成的相關因素[15-16],且ERS誘導的細胞凋亡在動脈粥樣硬化斑塊形成中發揮著重要作用[17]。PERK是ERS的主要轉導子,通過磷酸化α亞基的真核起始因子2(eIF2α)暫時降低蛋白質翻譯速度,并糾正翻譯中干擾。磷酸化后eIF2α可誘導轉錄激活因子4(ATF4)及CHOP上調,發揮多種糾正功能[18]。盡管3個內質網壓力傳感器均可誘導CHOP,其中以PERK最強烈[19]。CHOP持續升高可能通過影響細胞內鈣代謝和Bcl家族成員觸發凋亡機制[20-21]。Bcl-2家族可調節內質網與線粒體之間的串擾,Bax在線粒體膜中被激活并寡聚,從而誘導細胞色素C和其他凋亡原的釋放引發凋亡,且抗凋亡成員中Bcl-2轉錄下調機制已在CHOP轉染的大鼠成纖維細胞系和培養的皮質神經元中得到了證實[22-23]。有研究表明,Bcl-2基因缺失增加了晚期動脈粥樣硬化病變中巨噬細胞凋亡,與CHOP介導的Bcl-2下調促凋亡機制一致[24]。
中醫學無PCI術后再狹窄的病名,將其歸屬于“胸痹”的范疇。基于整體觀和辨證論治指導下的中醫藥在改善病人臨床癥狀、延緩再狹窄進程及提高生存質量方面顯示出獨特優勢。豁痰解毒通絡飲是鄧悅教授根據多年臨床經驗研制出的中藥方劑,認為“痰瘀伏絡、蘊結成毒”是本病的主要機制。鄧悅教授認為,在心血管疾病病程進展中,伏邪(伏痰、伏瘀)病理狀態貫徹始終,“伏邪三期”的提出與PCI術后再狹窄的疾病內涵頗為中的,即冠狀動脈狹窄性疾病的臨床前期多隱匿遷延,是內皮損傷、脂質代謝、炎癥等多種生物學改變的慢性積累過程[25],多伴有痰瘀互結、毒損心絡及正氣耗傷的病機。絡脈阻塞,日久化熱釀毒,營氣不從,逆于肉理,血敗絡腐,與西醫動脈粥樣硬化斑塊破潰出血、炎癥浸潤等一系列病理改變相似;臨床期,斑塊破裂繼發血栓導致冠狀動脈完全或近乎閉塞,形成本虛而痰、瘀毒蘊結標實的病機[26-27],此時雖應用PCI治療機械性再通血管,然而其內在病機未得到改善,反而加重血管損傷,繼發管腔內再狹窄,使疾病進入遷延緩解期[28],如此反復。因此,抓住“痰瘀伏絡、蘊結成毒”的關鍵病機,以豁痰解毒通絡為主要治療,可拓寬PCI術后再狹窄的治療思路,提高臨床療效。
本研究結果顯示,球囊損傷后28 d,模型組大鼠血管內皮較Sham組增生并伴管腔明顯狹窄,提示建模成功。與模型組比較,中藥組血管重構情況得到明顯改善,提示豁痰解毒通絡飲具有抑制損傷血管內皮增生,減輕血管狹窄的作用。分子水平檢測結果可見,豁痰解毒通絡飲能下調球囊損傷動脈組織PERK、CHOP和Bax表達,上調Bcl-2表達。推測豁痰解毒通絡飲可能通過降低血管內皮細胞中持續存在的ERS,從而減輕細胞過度凋亡造成的損傷,以發揮抑制血管內皮增生的作用。Chen等[29]研究顯示,蒲黃總黃酮通過抑制PERK-eIF2α-ATF4-CHOP途徑降低氧化型低密度脂蛋白(ox-LDL)誘導的人主動脈血管平滑肌細胞凋亡,從而改善斑塊結構和穩定性。 Yang等[30]研究顯示,醛脫氫酶2可降低PERK-CHOP表達,并減少Caspase-3活性,可保護平滑肌細胞免受ox-LDL誘導的ERS及ERS誘導的細胞凋亡。Li等[31]研究顯示,利拉魯肽可明顯降低糖尿病大鼠主動脈組織CHOP、GRP78蛋白表達及SREBP-1c、FAS mRNA表達,從而減輕糖尿病性動脈粥樣硬化發生。
綜上所述,CHOP在ERS誘導的凋亡中發揮著重要作用,抑制ERS-凋亡途徑的激活對動脈粥樣硬化性疾病是有益的。既往研究多在細胞水平驗證,同時關于CHOP下游的凋亡信號研究較少。本研究以大鼠頸動脈球囊損傷為模型,對ERS關鍵信號進行驗證,同時分析Bax和Bcl-2這對拮抗因子的變化,所得結論與既往研究基本一致,補充和完善了豁痰解毒通絡飲的作用機制。豁痰解毒通絡飲具有多成分、多途徑、多靶點的特點,今后仍需進一步探討其作用機制。

