過表達miR-203a-3p對脂多糖致大鼠急性肺損傷后肺纖維化的影響及其機制
任亦頻,周厚榮,李亞騏,黃 佳
急性肺損傷(acute lung injury,ALI)是由多種因素所導致的急性、進行性、缺氧性呼吸功能不全或呼吸衰竭[1]。ALI的病因多樣,發病機制復雜,其中過度炎癥反應已被公認是引發ALI發病的重要原因之一[2]。ALI具有較高的發病率,目前仍缺乏有效的治療手段。ALI后肺部組織會發生成纖維細胞聚集、膠原沉積等纖維增生反應,最終形成肺間質纖維化。微小RNA(miRNAs)是由19~25個核苷酸組成的內源性小分子非編碼RNA,通過轉錄調控下游靶基因的表達,參與細胞的增殖、分化、凋亡等多種重要的生命活動[3]。眾所周知,miRNA在機體的炎癥反應過程中也發揮重要作用,并且與ALI的發病密切相關[4]。研究發現,miRNA-203a-3p參與調節肺水腫[5]、膿毒性休克肺損傷[6]、肺纖維化[7]等病癥,然而其具體機制尚不完全清楚。為此,本研究通過脂多糖誘導建立大鼠ALI模型,探究miR-203a-3p對大鼠ALI后肺纖維化的影響及機制,旨在為臨床治療肺損傷后肺纖維化提供潛在治療靶點。
1 材料與方法
1.1 實驗動物8周齡健康SPF級雄性SD大鼠60只,體質量(200±20)g ,購于湖南斯萊克景達實驗動物有限公司,許可證編號:SCXK(湘)2019-2004。飼養環境溫度23~25 ℃,相對濕度50~65%,保持自然晝夜(12 h光照/12 h黑暗)處理,自由攝食飲水。
1.2 主要試劑及儀器脂多糖(LPS)購自美國Sigma公司;miR-203a-3p 模擬物(mimic)及其陰性對照(mimic NC)和miR-203a-3p 激動劑(agomir)及激動劑對照(agomir-NC)均購自上海吉瑪制藥技術有限公司;白細胞介素-1β(interleukin-1β,IL-1β)、白細胞介素-6(interleukin-6,IL-6)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α) ELISA試劑盒購自武漢博士德生物工程有限公司;TRIzol 提取液、Lipofectamine 2000轉染試劑購自美國Invitrogen公司;反轉錄試劑盒、qRT-PCR試劑盒購自美國Thermo Fisher公司;PCR引物購自上海 Bio-TNT 生物公司;羥脯氨酸(HYP)含量檢測試劑盒購自北京索萊寶生物科技有限公司;兔抗卵泡抑素樣蛋白1(follistatin-like 1,Fstl1)抗體、β-actin抗體和辣根過氧化物酶(HRP)標記山羊抗兔IgG二抗購自美國CST公司;低溫冷凍干燥離心機購自德國Eppendorf公司;石蠟切片機購自德國LEICA公司;蛋白印跡電泳儀購自美國Bio-Rad公司;熒光定量擴增PCR儀器購自美國ABI公司。
1.3 方法
1.3.1大鼠ALI后早期肺纖維化模型建立 取60只SD大鼠隨機分為4組:對照組、模型組、agomir陰性對照組(agomir-NC組)和miR-203a-3p agomir組(agomir組),每組15只。參照文獻[8]改良的方法構建大鼠ALI后早期肺纖維化模型,先經口氣管注入含1.5 mg/kg LPS的生理鹽水溶液,24 h后腹腔內注入含3 mg/kg LPS的生理鹽水溶液,48 h后再經口氣管注入含3 mg/kg LPS的生理鹽水溶液,而對照組注入等量生理鹽水。agomir-NC組和agomir組大鼠在造模前1 d及造模后1周,分別經尾靜脈注射200 μl的agomir-NC和miR-203a-3p agomir,劑量為10 nmol/只。于造模后第14天處死大鼠,取材進行檢測。
1.3.2肺組織病理學觀察及纖維化程度的評估 取大鼠左肺上葉組織,用4%多聚甲醛固定24 h,石蠟包埋后制成4 μm厚切片,HE染色后于光學顯微鏡200倍視野下選取10個視野觀察肺組織形態學變化,參考文獻[9]對肺損傷程度進行半定量測評,總分為0~16分,分數越高表示肺組織損傷越嚴重。對制備的大鼠肺組織切片進行Masson染色,于光學顯微鏡200倍視野下選取10個視野進行觀察,參照Ashcroft制定的0~5分評分法[10]對大鼠肺組織纖維化程度進行半定量測評,分數越高肺組織纖維化程度越嚴重。
1.3.3肺組織濕/干比重(W/D)測定 取各組大鼠右肺中葉及下葉組織100 mg,濾紙沾干表面水分,天平稱濕重;然后置于烘箱中,60 ℃烘烤72 h,天平秤干重,進行濕/干質量比(W/D)計算。
1.3.4肺組織Hyp水平的測定 精確稱取0.2 g新鮮的右肺組織置于玻璃管中,使用玻璃棒碾碎,加入2 ml提取液,置于100 ℃烘箱中充分消化,16 000 r/min室溫離心25 min,取上清液,調整pH值至6~8,蒸餾水定容至4 ml,取上清液按照試劑盒說明書加入相應試劑,混勻后置于60 ℃水浴20 min,取200 μl溶液采用酶標儀于560 nm處測量吸光值,再根據說明書提供的公式計算肺組織中Hyp含量。
1.3.5ELISA檢測大鼠肺泡灌洗液(BALF)中IL-1β、IL-6和TNF-α水平 將麻醉后大鼠仰臥固定,打開大鼠胸腔,心臟穿刺放血處死,然后結扎右側肺門,分離出頸部氣管,插入導管,2.5 ml生理鹽水反復沖洗3次,收集灌洗液,于4 ℃條件下1 500 r/min離心10 min,取上清液按照ELISA試劑盒說明書檢測BALF 中IL-1β、IL-6和TNF-α水平。
1.3.6qRT-PCR檢測大鼠肺組織中miR-203a-3p和Fstl1 mRNA表達水平 采用TRIzol法提取大鼠肺組織總RNA,應用反轉錄試劑盒將RNA反轉錄為cDNA,以cDNA為模板,參照qRT-PCR試劑盒說明書反應體系進行qRT-PCR反應,各基因引物信息如表1所示。PCR反應條件:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,進行45個循環。miR-203a-3p以U6為內參,Fstl1以β-actin為內參,miR-203a-3p和Fstl1 mRNA相對表達水平采用2-ΔΔCt法進行計算。

表1 各基因引物信息
1.3.7Western blot檢測大鼠肺組織中Fstl1蛋白表達水平 取各組大鼠肺組織加入適量RIPA裂解液充分裂解30 min,置于4 ℃條件下14 000 r/min離心10 min,取上清液,采用BCA法測定蛋白濃度。取30 μg蛋白沸水浴變性后進行10% SDS-PAGE電泳,并采用濕轉法將蛋白轉移至PVDF膜上,5% 脫脂奶粉室溫封閉1 h,分別加入Fstl1抗體(1 ∶1 000)和β-actin抗體(1 ∶1 000),于4 ℃孵育過夜,再加入HRP標記的山羊抗兔IgG二抗(1 ∶10 000),室溫孵育2 h,滴加ECL顯影,并采用ImageJ軟件對各條帶進行灰度值分析。
1.3.8雙熒光素酶報告基因實驗 通過TargetScan在線軟件預測miR-203a-3p與Fstl1 3′UTR區域結合位點。構建Fstl1 3′UTR野生型(WT)和Fstl1 3′UTR突變型(MUT)熒光素酶報告基因質粒。取對數生長期的293T細胞,接種于12孔板,當細胞匯合度約70%時對細胞進行分組,使用Lipofectamine 2000分別將其與mimic NC和miR-203a-3p mimic共轉染至293T細胞中。轉染48 h,按照試劑盒說明書要求,分別檢測螢火蟲和海腎熒光素酶活性,用二者比值表示熒光酶相對活性。
2 結果
2.1 肺組織形態學觀察如圖1所示,Control組大鼠肺泡形態規則,結構清晰完整,無明顯藍色膠原纖維染色;Model組和agomir-NC組大鼠肺泡腔塌陷、水腫,伴有炎癥滲出物和出血,肺泡間隔變寬變厚,且藍色膠原纖維染色明顯,存在致密的膠原沉積;agomir組大鼠肺泡結構、肺泡壁增厚及水腫程度均較模型組有所改善,炎性細胞浸潤及出血情況明顯減少,藍色膠原纖維染色較淺,膠原沉積減少。如表2所示,與Control組比較,Model組大鼠肺組織損傷評分及纖維化評分增加(P<0.05);與Model組比較,agomir組大鼠肺損傷評分及纖維化評分降低(P<0.05),而agomir-NC組大鼠肺損傷評分及纖維化評分差異無統計學意義(P>0.05)。
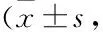
表2 各組大鼠肺組織損傷及纖維化評分分,n=15)
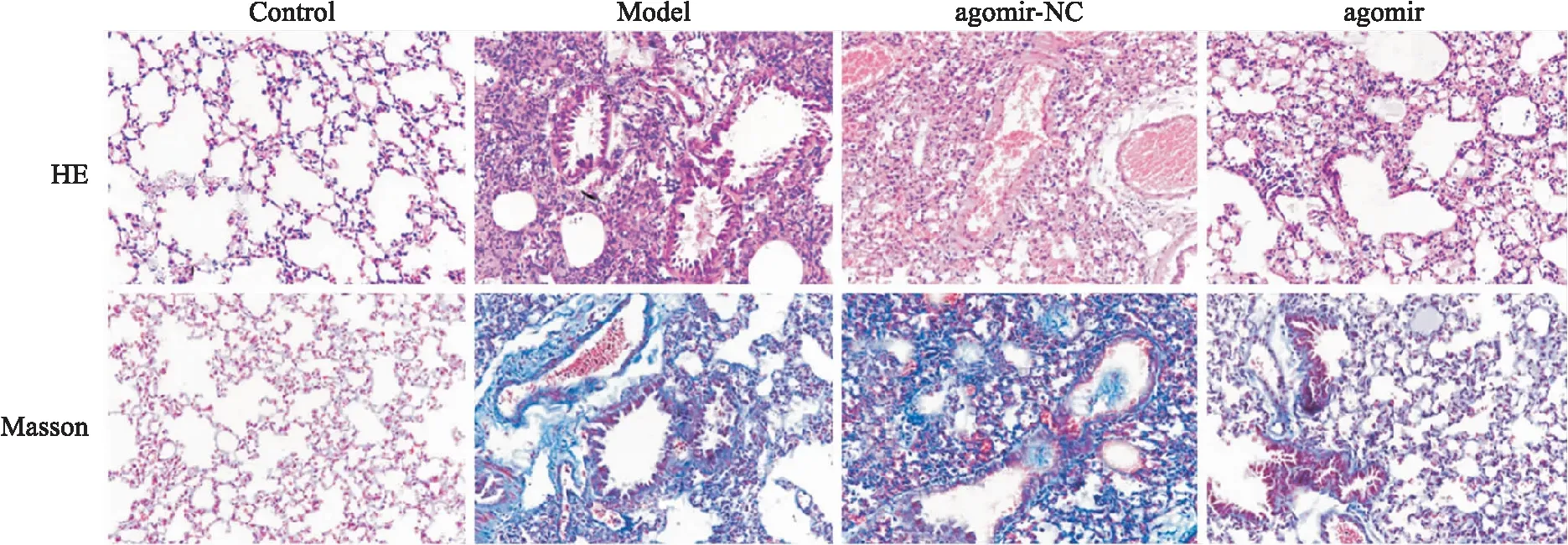
圖1 肺組織HE和Masson染色 ×200
2.2 各組大鼠肺組織W/D值及Hyp水平如表3所示,與Control組比較,Model組大鼠肺組織W/D值及Hyp水平增加(P<0.05);與Model組比較,agomir組大鼠肺組織W/D值及Hyp水平降低(P<0.05),而agomir-NC組大鼠肺組織W/D值及Hyp水平差異無統計學意義(P>0.05)。
表3 各組大鼠肺組織W/D值及Hyp水平比較
2.3 各組大鼠BALF中IL-1β、IL-6和TNF-α水平如表4所示,與Control組比較,Model組大鼠BALF中IL-1β、IL-6和TNF-α水平升高(P<0.05);與Model組比較,agomir組大鼠BALF中IL-1β、IL-6和TNF-α水平降低(P<0.05),而agomir-NC組大鼠BALF中IL-1β、IL-6和TNF-α水平差異無統計學意義(P>0.05)。
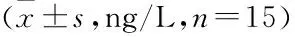
表4 各組大鼠BALF中IL-1β、IL-6和TNF-α水平
2.4 大鼠肺組織中miR-203a-3p和Fstl1表達水平如表5和圖2所示,與Control組比較,Model組大鼠肺組織中miR-203a-3p表達水平降低(P<0.05),而Fstl1 mRNA和蛋白表達水平升高(P<0.05)。與Model組比較,agomir組大鼠miR-203a-3p表達水平升高(P<0.05),Fstl1 mRNA和蛋白表達水平降低(P<0.05),而agomir-NC組差異無統計學意義(P>0.05)。
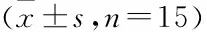
表5 各組大鼠miR-203a-3p及Fstl1 mRNA和蛋白表達水平
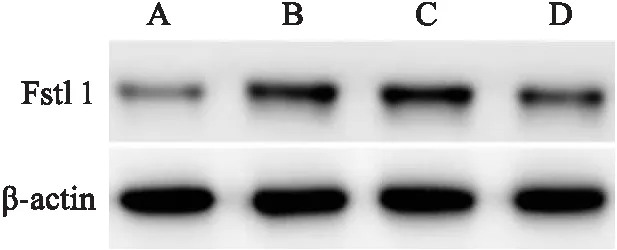
圖2 Western blot檢測各組大鼠肺組織中Fstl1蛋白表達水平A:Control組;B:Model組;C:agomir-NC組;D:agomir組
2.5 miR-203a-3p與Fstl1靶向關系的驗證如圖3所示,TargetScan軟件預測miR-203a-3p與Fstl1 3′UTR區域存在結合位點。雙熒光素酶報告基因實驗進一步驗證,與共轉染mimic-NC和Fstl1-WT質粒組細胞比較,共轉染miR-203a-3p mimic和Fstl1-WT質粒組細胞相對熒光素酶活性降低(P<0.05);與共轉染mimic-NC和Fstl1-MUT質粒組細胞比較,共轉染miR-203a-3p mimic和Fstl1-MUT質粒組細胞相對熒光素酶活性差異無統計學意義(P>0.05)。
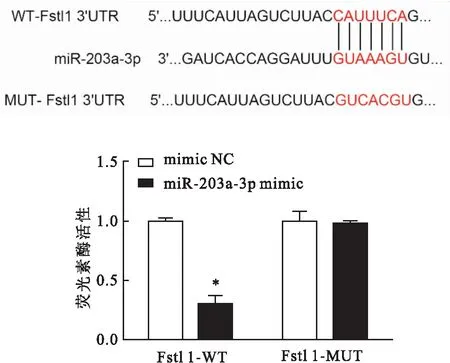
圖3 miR-203a-3p與Fstl 1靶向調控關系與mimic NC組比較:*P<0.05
3 討論
ALI是一種復雜的臨床并發癥,常常伴有炎癥反應,微血管損傷以及肺血管和上皮細胞通透性增加,甚至可能發展為更嚴重的致命性急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)。ALI具有較高的發病率和死亡率,目前尚無特效的治療方法,不僅增加社會經濟負擔,還嚴重降低患者生活質量。眾所周知,過度炎癥反應是誘發ALI的重要因素,有效控制過度炎癥反應是治療ALI的常用方案。LPS 是內毒素的主要成分,進入機體后可快速誘發炎癥反應,導致彌漫性肺損傷,腹腔注射LPS是目前制備ALI動物模型常用的理想方法[11]。研究[12]表明,肺纖維化是ALI的關鍵病理過程,其病理特征是肺上皮細胞損傷、成纖維細胞增殖和細胞外基質沉淀。本研究結果顯示,大鼠經LPS誘導后出現明顯的肺損傷及肺纖維化現象,且BALF中炎癥因子IL-1β、IL-6和TNF-α水平明顯升高,肺組織W/D值及Hyp含量明顯增加,提示本研究ALI后肺纖維化模型制備成功。
miRNA在ALI的發生發展中發揮重要的調控作用,吳松林 等[13]在研究中證實,miR-125b可能通過調控Notch1蛋白的表達影響膿毒癥急性肺損傷中炎癥因子的表達,參與其免疫炎癥調控過程;Wang et al[14]發現miR-19能夠減輕LPS誘導所致ALI的炎癥反應。同時,也有研究[5]顯示,在高原缺氧所致肺損傷模型中miR-203a-3p表達下調,并與肺微血管形成介導的肺水腫有關。Ling et al[6]研究顯示,在膿毒性休克小鼠模型中 miR-203低表達,其過表達可通過靶向下調VNN1,激活AKT信號通路,從而減輕膿毒性休克肺損傷。以上提示miR-203a-3p在肺損傷過程中發揮重要作用。本研究顯示,ALI組大鼠肺組織中miR-203a-3p表達水平明顯降低。為了探討miR-203a-3p在ALI過程中的作用及其對ALI后肺纖維化的影響,本研究通過尾靜脈注射miR-203a-3p agomir上調ALI大鼠肺組織中miR-203a-3p表達,進一步研究結果顯示,miR-203a-3p過表達后agomir組大鼠肺損傷及纖維化程度得到明顯改善,肺組織W/D值及Hyp含量顯著降低,同時BALF中炎癥因子IL-1β、IL-6和TNF-α水平明顯降低,表明miR-203a-3p過表達可顯著改善ALI大鼠肺損傷及肺纖維化。
Fstl1是一種由308個氨基酸組成的分泌型糖蛋白,定位于3q13染色體上,在心血管疾病、自身免疫性疾病、腫瘤、炎癥等疾病的發生、發展和轉歸過程中發揮重要作用。楊華 等[15]研究顯示,Fstl1可以通過調節TGF-β1/Smad2/3信號通路來調控成纖維細胞活化及細胞外基質合成,具有促纖維化作用。本研究結果顯示,ALI組大鼠肺組織中Fstl1 mRNA和蛋白表達水平顯著升高;進一步通過Targetscan在線數據庫預測,發現miR-203-3p 與Fstl1 3′UTR 存在互補序列;隨后通過雙熒光素酶實驗報告證實,Fstl1是miR-203a-3p靶基因。因此,miR-203a-3p過表達可能通過靶向下調Fstl1表達改善LPS誘導的急性肺損傷后肺纖維化,但還需要進一步研究證實。
綜上所述,本研究初步探明miR-203a-3p在ALI大鼠肺組織中低表達,其過表達可降低ALI大鼠肺組織炎癥反應,改善ALI大鼠肺損傷及肺纖維化,其機制可能與靶向下調 Fstl1表達有關。因此,miR-203a-3p可能成為ALI后肺纖維化治療的潛在靶點,但還需要更多的實驗進行論證。

