高濃度煮漿對豆腐品質提升的作用及其機制
吳元浩,李 玥,金雪花,徐婧婷,郭順堂,*
(1.中國農業大學食品科學與營養工程學院,北京 100083;2.植物蛋白與谷物加工北京市重點實驗室,北京 100083)
將大豆浸泡、破碎、濾渣后獲得的生豆乳進行加熱處理,是豆乳和豆腐的生產中非常關鍵的工藝環節[1]。熱處理不僅滅活生豆乳中致病菌、鈍化胰蛋白酶抑制劑等抗營養因子,而且還能提升豆制品的安全、營養與感官特性[2-3]。豆乳在熱處理時,豆乳蛋白的存在狀態和聚集性也發生了變化,即隨著加熱溫度的升高,豆乳中蛋白質發生變性,生豆乳中破碎的蛋白體顆粒以及油脂體為核心的粒子開始解離,蛋白質亞基之間在熱的作用下進行重組,形成游離油脂體、溶解性蛋白和粒子蛋白組分[4],在質子或鈣離子的作用下,各組分的表面電荷被中和,在疏水相互作用下形成豆腐凝膠[5]。
目前,國內外學者針對豆乳加工中的煮漿條件已開展大量研究。左峰等[6]探究了微壓煮漿對豆乳中蛋白聚集體和豆腐品質的影響,微壓煮漿所得豆乳中蛋白粒子含量增加,豆乳平均粒徑減小,使得豆乳的黏度提高,豆腐的硬度提高。Liu Zhisheng等[7]采用兩步加熱的煮漿方式,豆乳黏度增加,豆腐的彈性增強。不同豆乳濃度在煮漿過程中也產生不同的效果。Wallace等[8]對熟豆乳濃縮后進行二次煮漿,高濃度下的豆乳產生熱誘導凝膠,凝膠強度隨豆乳濃度增加而升高。Wan Yangling等[9]對不同濃度的大豆分離蛋白溶液進行加熱,然后調整成相同固形物含量后制備酸凝膠,結果顯示,高濃度熱處理組Zeta電位絕對值增大,酸凝膠過程中凝固時間提前,凝膠速率加快,凝膠硬度增加。生產實踐中豆乳的制備濃度因大豆原料品種的差異以及不同豆制品加工企業的加工方式存在差異,豆乳飲料行業為降低成本也采取高濃度煮漿后稀釋調配的生產工藝,但高濃度煮漿是否有利于提升豆腐凝膠品質,對這一問題鮮有研究報道。
本研究聚焦豆乳中蛋白聚集體的狀態,利用不同濃度豆乳進行煮漿處理,加熱后稀釋至同一固形物濃度,再制成豆腐,以生產中常用的固形物質量分數為8%的豆乳為對照,比較豆腐凝膠的品質,進一步從豆乳蛋白聚集體及流變學的角度分析了高濃度煮漿對豆乳蛋白聚集體和凝固過程的影響,其結果為優化豆乳品質、調控豆乳凝固速率為核心的豆制品加工技術開發提供了一定的理論支持。
1 材料與方法
1.1 材料與試劑
大豆 市售;消泡劑 常州三蜂食品添加劑有限公司;熟石膏 廣東百味源食品配料有限公司;十二水磷酸氫二鈉、磷酸二氫鉀、氫氧化鈉、鹽酸、濃硫酸、丙烯酰胺、甲叉雙丙烯酰胺、過硫酸銨、脲、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、三氯化鐵、甘氨酸等(分析純) 北京化學試劑公司;中性濾紙、考馬斯亮藍G-250 美國默克公司;牛血清白蛋白、β-巰基乙醇 美國Amresco公司;二甲基硅油 西隴化工公司。
1.2 儀器與設備
打漿機 九陽股份有限公司;UV-1800紫外-可見分光光度計 日本島津公司;LXJ-IIB低速離心機 上海安亭科學儀器廠;CP80MX超高速離心機 日本日立公司;CT3質構儀 美國Brookfield公司;Nano-ZS90電位粒徑儀美國馬爾文公司;LS230型粒度分布儀 美國貝克曼-庫爾特公司;電子天平 日本AND公司;JB-1磁力攪拌器上海雷磁新涇儀器有限公司;DHR-2動態流變儀 美國TA公司;DK-S24水浴鍋 上海森信實驗儀器有限公司;LS-55熒光分光光度計 美國珀金埃爾默公司;BE-210N垂直電泳槽 日本生物耗材公司;DYY-III8B穩壓穩流定時電泳儀 北京六一儀器廠。
1.3 方法
1.3.1 豆乳及豆腐的制備
每份取50 g大豆,自來水洗3次后去離子水洗2次,加入150 g去離子水,在冰箱冷藏層浸泡14 h,瀝干后再加入250 g常溫去離子水,于打漿機中磨漿2.5 min,加入適量的消泡劑,經脫脂棉抽濾除渣,得生豆乳。測定生豆乳中固形物質量分數,并通過加入去離子水調整固形物質量分數至12.2%、11.2%、10.2%、9.2%(高濃度)和8.0%,搖勻后,取相同質量的生豆乳在沸水浴中加熱到95 ℃后,繼續加熱5 min,并不斷搖動。加熱結束后立即降至室溫,在熟豆乳中加入等溫去離子水,調整固形物質量分數至8.0%,制得樣品,用于后續測定豆乳指標。制備豆腐時,將固形物質量分數調整至8.0%的豆乳冷卻到85 ℃,加入豆乳質量0.3%的熟石膏,通過磁力攪拌器攪拌10 s,然后85 ℃水浴保溫15 min形成凝乳。對凝乳適當破碎,倒入9 cm×7 cm×5 cm模具中,然后在500 g/63 cm2壓力下壓榨15 min,之后再在1 000 g/63 cm2的壓力下壓榨15 min。排出豆乳清(黃漿水)后,得到石膏豆腐,冷藏于冰箱。
1.3.2 豆腐得率與質構特性測定
將制備好的豆腐置于室溫條件,豆腐得率以豆腐質量計算(每次點漿前均使用300 mL固形物質量分數為8%的熟豆乳)。參考Imm等[10]所述方法并加以修改,測定豆腐的質構特性時,去掉豆腐的不均勻外皮,切成長、寬、高為15 mm×15 mm×10 mm的長方體,進行全質構分析(texture profile analysis,TPA)循環測試,其中探頭型號TA 25/1000,形變量為40%,測試速度為0.05 mm/s。根據TPA曲線得到豆腐的硬度、彈性和咀嚼性。
1.3.3 豆腐的水分質量分數與保水性測定
參考王睿粲[11]所述方法,將鋁盒放入105 ℃烘箱中烘至恒質量,記錄質量(m0/g),加入豆腐后搗碎,記錄樣品及鋁盒的質量(m1/g),烘至恒質量后,記錄烘后質量(m2/g),豆腐的水分質量分數計算如公式(1)所示。
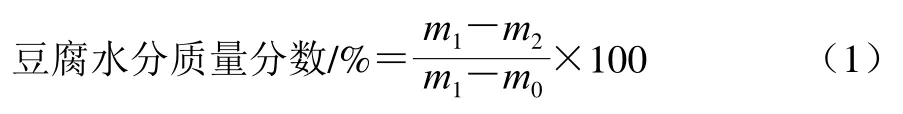
根據Chen Zhenjia[12]等的方法,稱取一定質量與形狀的豆腐樣品,置于帶有特殊網狀內管(質量為m0/g)的50 mL離心管中,記錄質量m1/g,離心(1 000 r/min、10 min)后取出網狀內管及樣品,記錄質量m2/g。保水性通過公式(2)計算。
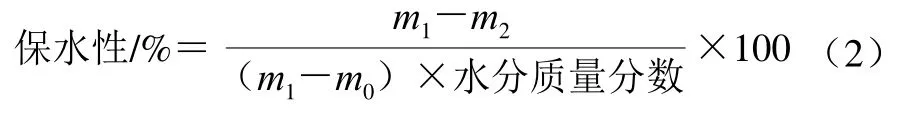
1.3.4 豆乳中蛋白質量分數及蛋白粒子比例的測定
按照Ono等[13]所述方法,通過超高速離心機將豆乳在156 000×g、20 ℃下離心30 min,沉淀為直徑大于40 nm的粒子部分。采用Bradford[14]的方法測定蛋白質量分數,分別測定離心前豆乳中蛋白質的質量分數(即豆乳中的蛋白質量分數)ω1/%和經超速離心后豆乳可溶蛋白質量分數ω2/%,豆乳中蛋白粒子比例計算如公式(3)所示。
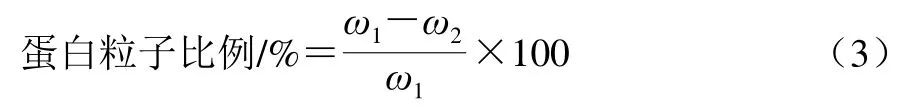
1.3.5 豆乳粒徑分布的測定
參考Ion-Titapiccolo等[15]的方法,用Na2HPO4·12H2O-KH2PO4緩沖液[16]稀釋豆乳為原濃度的1/100,吸取1 mL稀釋液,通過電位粒徑儀測定平均粒徑。參考Chen Yeming等[17]的方法,粒徑測量范圍40 nm~2 000 μm。加入一定量樣品,待濃度穩定后進行測定。以Na2HPO4·12H2O-KH2PO4緩沖液為溶劑,折射率1.33,蛋白粒子折射率1.57,粒徑分布以不同直徑粒子的體積百分比表示。
1.3.6 豆乳的Zeta電位測定
參考左峰[18]所述方法,并略有改變,用Na2HPO4·12H2O-KH2PO4緩沖液稀釋豆乳樣品為原濃度的1/100后,用電位粒徑儀測定Zeta電位。每個樣品測定3次,重復4次,取平均值。溶劑參數選擇:折光系數1.33,黏度1.008 7 mPa·s。
1.3.7 豆乳蛋白的疏水性測定
參考Haskard等[19]所述方法并略有改變,將一定量豆乳樣品中加入4 mL 1/15 mol/L pH 7.1磷酸鹽緩沖液,分別稀釋為樣品濃度的1/500、1/800、1/1 000、1/2 000、1/4 000系列溶液,隨后添加20 μL 8 mmol/L 8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)熒光探針,混合均勻,通過熒光分光光度計來測定樣品的熒光強度。激發波長390 nm,發射波長470 nm,以10 nm為激發和發射狹縫寬,掃描速率為200 nm/min。以蛋白質量分數為自變量,熒光強度為因變量,擬合線性方程得到斜率S0,即蛋白表面的疏水性指數。
1.3.8 豆乳及其組分的電泳分析
參考Wang Ruican等[20]所述方法取約含蛋白2 mg的豆乳樣品加入1.5 mL的離心管中,按順序加入0.5 mL處理液(質量分數20%甘油、質量分數0.2% SDS、pH 6.8的0.063 mol/L Tris-HCl緩沖液)、0.36 g脲、20 μL巰基乙醇以及20 μL的飽和溴酚藍溶液,加純水使總體積最終為1 mL,混勻后靜置過夜。采用垂直電泳平板,膠板厚1 mm。分離膠為質量分數12.5%的丙烯酰胺/甲叉雙丙烯酰胺溶液,交聯度為2.7%;濃縮膠為質量分數4%的丙烯酰胺/甲叉雙丙烯酰胺溶液,交聯度2.7%。電泳緩沖液含有5 mmol/L Tris、38.4 mmol/L甘氨酸和質量分數0.1%SDS。樣品上樣量為8 μL。電泳過程中,濃縮膠部分保持15 mA恒定電流,分離膠部分保持25 mA恒定電流。電泳結束后,對電泳膠片用含有體積分數33%甲醇和12%三氯乙酸固定液在搖床上處理3 h。固定后,在考馬斯亮藍染色液(質量分數12%三氯乙酸、1.05 mmol/L考馬斯亮藍G-250、1.0 mol/L硫酸、10 mol/L氫氧化鉀)中染色3 h。隨后進行脫色,直至條帶清晰,底色基本透明。為表示豆乳中各亞基的相對含量,使用Scion Image軟件進行光密度分析,計算時分析α’、α、β、A、B亞基所占比例。
1.3.9 豆乳凝固過程的動態流變學分析
參考Wang Ruican等[21]所述方法,取19 mL在冷藏層貯存的豆乳,加入1 mL含有0.06 g的熟石膏均勻懸浮液,迅速攪拌10 s,立刻把混合液加到流變儀的平行板(直徑40 mm)間,狹縫設為1 mm,在較小平板周圍滴加少量二甲基硅油。加入樣品后,迅速升溫至蹲腦溫度85 ℃,保持15 min,得到儲能模量G’和損耗模量G”與時間t的函數曲線。豆乳凝固過程符合一級動力方程,按經驗公式(4)[22]擬合。
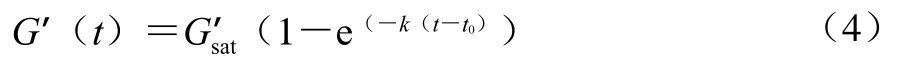
式中:G’sat代表飽和彈性模量(即彈性模量到達穩定區間的值);t0/s與k/(10-3s-1)分別代表凝固開始的時間(即G’準備離開基線的時間)和凝固速率;t-t0表示G’離開基線后的時間。
1.4 數據統計與分析
所有實驗重復3次,結果以平均值±標準差表示,采用SPSS軟件以方差分析(AVONA)檢驗平均值之間的差異顯著性,顯著性水平為P<0.05。數據及圖像處理使用Excel 2016、Origin 2017和SPSS軟件。
2 結果與分析
2.1 豆腐質構、得率與保水性分析
豆腐質構是反映其品質最直接的指標,不同類別豆腐的軟硬、彈性各不相同。一般來說,鹽鹵豆腐(北豆腐)的硬度高于石膏豆腐(南豆腐),而內酯豆腐最軟,這些指標與消費者的偏好相對應。通過制備含不同固形物質量分數的生豆乳,煮漿后添加去離子水統一熟豆乳的固形物質量分數,比較高濃度煮漿制得石膏豆腐的質構特性。如表1所示,隨著煮漿濃度的增加(固形物質量分數9.2%~12.2%),豆腐的硬度從613 g左右逐漸降低至450 g左右,煮漿時固形物質量分數在11.2%的豆乳制備的豆腐與未經高濃度煮漿的8.0%組的豆腐在硬度、咀嚼性上最為接近。與固形物質量分數8.0%組相比,高濃度煮漿組豆腐樣品彈性略有上升。而豆腐得率、水分質量分數在各處理組間沒有太大差異,保水性的變化與硬度變化類似。豆腐的保水性隨著煮漿濃度的上升而降低,但仍高于固形物質量分數8.0%組。
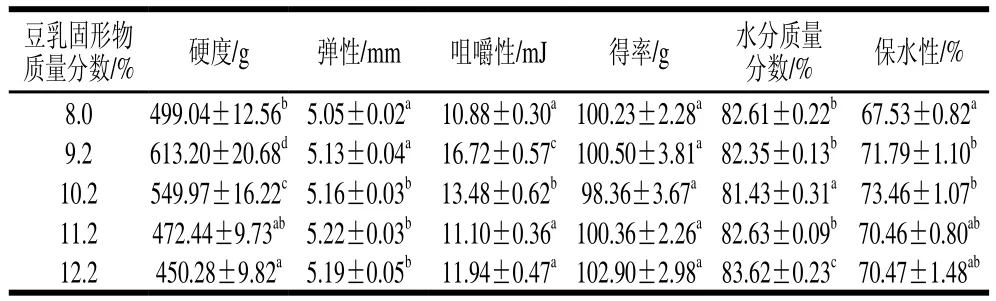
表1 不同濃度煮漿所得豆乳制備豆腐的質構特性與得率、保水性、水分質量分數Table 1 Texture, yield, water-holding capacity and moisture content of tofu prepared from different concentrations of raw soybean milk
2.2 豆乳中蛋白聚集體的變化
2.2.1 豆乳蛋白質量分數和蛋白粒子比例
生豆乳中蛋白質在加熱過程中會發生解離和聚集生成可溶性蛋白質和粒子狀態的蛋白質。如圖1所示,隨著加熱時豆乳固形物質量分數增加,其中的蛋白質量分數不發生顯著變化。隨著加熱時豆乳固形物質量分數從9.2%升高至12.2%,蛋白粒子的比例從26.2%升高至49.0%。高濃度煮漿中固形物質量分數10.2%組與8.0%組蛋白例子比例相近。結果表明,高蛋白濃度有利于蛋白解離后有更大的相互反應機率,形成更多的蛋白聚集體,進而提高了蛋白粒子比例。
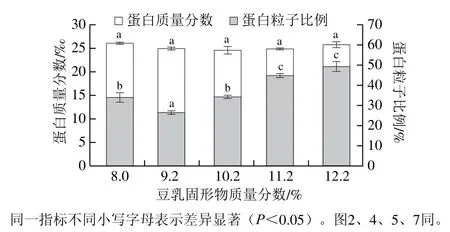
圖1 不同濃度煮漿所得豆乳中蛋白質量分數與粒子比例Fig. 1 Proportions of protein particles and protein contents in cooked soybean milk of different concentrations
2.2.2 豆乳的粒徑分布分析
生豆乳蛋白受熱變性后,豆乳中蛋白質結構展開,亞基從原有結構中解離,聚集成新的粒子,并產生蛋白質和磷脂包裹在脂肪周圍的油脂體中[23],豆乳粒子的分布特性與豆乳加工特性緊密相關。如圖2所示,在同樣的熱處理條件下,隨著煮漿時豆乳濃度的提高,粒子粒徑顯著增大(P<0.05),這一結果與Mehalebi等[24]在球蛋白體系中得到的結果一致。從豆乳的粒徑分布來看(圖3),加熱后豆乳的粒徑分布呈雙峰狀,峰值所對應的粒徑分別為600 nm和2 000 nm左右。有報道指出,豆乳中蛋白粒子在40~200 nm左右[17],而油脂體單體在122~657 nm左右,融合的油脂體粒徑在1 μm以上[25]。由此可見,圖3中的第一個峰可能是蛋白粒子和油脂體單體的混合物,而第二個峰是油脂體的聚合體。另外,從圖3還可以看出,隨著煮漿濃度的增加,第一個峰所占面積比例逐漸減少,而第二個峰所占面積比例呈現增加狀態,且峰型整體向右側移動。這一結果說明,高濃度下煮漿會使單體油脂體聚合,單體油脂體的比例減少,同時形成更多體積較大的油脂體。
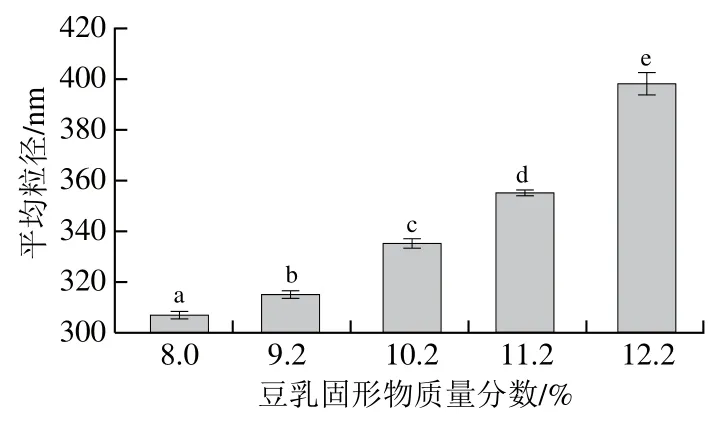
圖2 不同濃度煮漿所得豆乳蛋白粒子平均粒徑Fig. 2 Average sizes of protein particles in cooked soybean milk of different concentrations
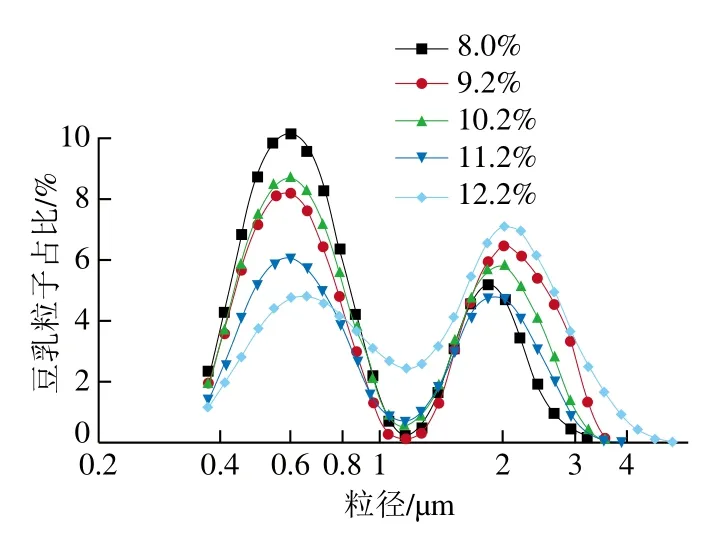
圖3 不同濃度煮漿所得豆乳粒子粒徑分布Fig. 3 Particle size distribution of proteins in cooked soybean milk of different concentrations
2.2.3 豆乳的Zeta電位分析
Zeta電位表示的是帶電微粒表面剪切層的電位,常用來表征微粒的電荷性質。當微粒體系帶電絕對量過低時,體系傾向于聚集[26]。不同濃度加熱后調制的豆乳Zeta電位如圖4所示,5種濃度下加熱所得豆乳的Zeta電位值均低于-10 mV,表明這5 類豆乳體系是相對穩定的。但隨著加熱豆乳蛋白濃度(固形物質量分數8%~11.2%)的增加,粒子負電性增強,在固形物質量分數為11.2%時,電位絕對值達到最大。這一結果與Wan Yangling等[9]關于蛋白熱聚集粒子增大和負電性增強的結果一致。
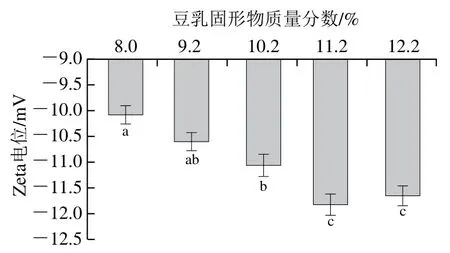
圖4 不同濃度煮漿所得豆乳Zeta電位變化Fig. 4 Zeta potential of cooked soybean milk of different concentrations
2.2.4 豆乳蛋白的疏水性分析
豆乳中的蛋白質在受熱解離后,會在疏水相互作用、二硫鍵、氫鍵等作用力下重新聚集,形成豆乳蛋白粒子。本研究通過對豆乳疏水性的測定,進一步分析了不同煮漿濃度所得豆乳的蛋白變性情況,結果如圖5所示。總體上,隨著煮漿濃度的提高,蛋白的疏水性逐漸降低,煮漿時固形物質量分數為11.2%與12.2%時疏水性低于8.0%組。疏水性能夠直接反映蛋白的變性程度,蛋白質受熱后,三級結構展開,疏水基團暴露,會導致更強的疏水性。但隨著加熱時蛋白濃度的增加,暴露出更多的疏水基團[27],在疏水相互作用下疏水基團相互聚集,進而導致熒光猝滅,會顯著降低熒光量子產率[28],導致疏水性降低。同時,在聚集的過程中,疏水側鏈內折,使得更多帶負電的極性氨基酸暴露,導致豆乳的Zeta電位絕對值隨煮漿濃度增加而增大,這與圖4的變化趨勢一致。因此,高濃度下加熱導致豆乳蛋白結構展開,并進一步聚集,形成聚集程度更高的結構。
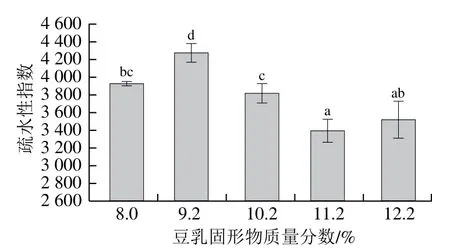
圖5 不同濃度煮漿所得豆乳疏水性變化Fig. 5 Hydrophobicity of cooked soybean milk of different concentrations
2.2.5 SDS-PAGE電泳分析
圖6為不同濃度下加熱所得豆乳經超高速離心(156 000×g、30 min)的蛋白粒子電泳圖。經光密度分析,隨著煮漿濃度的增加,蛋白粒子中B亞基的比例增大,而α與α’亞基比例減小。已有研究表明11S的B亞基和7S的β-亞基傾向于形成粒子蛋白的核心,7S的α、α’亞基以及11S的A亞基則傾向于分布在粒子蛋白的外圍[29]。可見,提高煮漿濃度導致的蛋白粒子比例增加可能與粒子中B亞基比例上升有關。
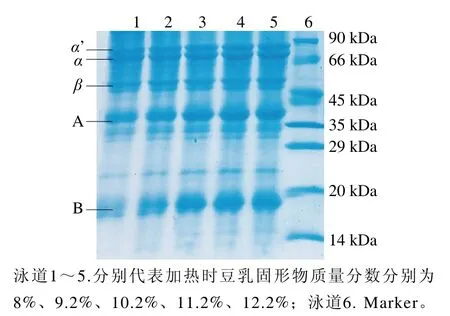
圖6 不同濃度煮漿所得蛋白粒子還原電泳圖Fig. 6 Reduced electrophoresis pattern of proteins in cooked soymilk of different concentrations
2.3 豆乳凝固過程中流變學特性分析
動態流變學測試能夠監測流體體系流變學性質隨時間的變化,進而能夠反映豆乳的凝膠過程。由圖7可知,當煮漿的豆乳固形物質量分數達到11.2%時,凝固速率顯著加快,開始凝固時間t0顯著早于9.2%和10.2%組的豆乳以及8.0%組。在受熱的過程中,蛋白質變性展開,疏水基團暴露,導致蛋白開始聚集,當蛋白達到較高濃度時,聚集體間進一步聚集形成凝膠。在豆乳凝固的過程中,大豆蛋白發生兩步聚集[30],高濃度豆乳可能在受熱過程中聚集程度較高,蛋白變性后形成小聚集體,并進一步形成較大的聚集體,進而導致蛋白在凝固過程中凝固時間提前,同時凝固速率加快。
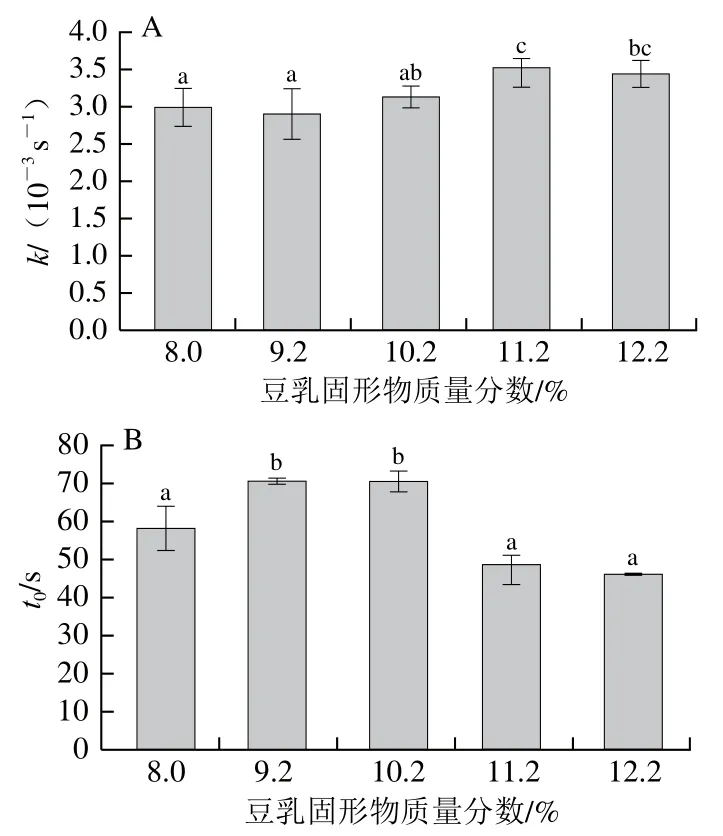
圖7 不同濃度煮漿對豆乳凝固速率k(A)與開始凝固時間(B)的影響Fig. 7 Rate k (A) and start time (B) of coagulation of cooked soymilk of different concentrations
3 結 論
不同的煮漿濃度會影響豆乳中蛋白聚集反應,導致豆乳中蛋白的狀態和性質發生變化,并進一步影響豆乳凝固過程和豆腐凝膠的品質。高濃度煮漿對于豆腐的品質有著顯著影響,隨著煮漿濃度的增加,豆腐的硬度、咀嚼性逐漸降低,其中煮漿濃度在固形物質量分數為9.2%時硬度、咀嚼性達到最大,煮漿濃度在固形物質量分數為11.2%與8.0%時所得豆腐的硬度、咀嚼性相近,而彈性、得率、水分質量分數和保水性差異較小。產生這一現象的原因是煮漿濃度的不同改變了豆乳的加工性質,高濃度煮漿使豆乳中蛋白聚集程度增強,粒子蛋白部分B亞基比例提升,α’和α亞基比例減少,同時豆乳中蛋白粒子比例呈上升趨勢,粒徑不斷增大。高濃度下煮漿,隨煮漿濃度增加,蛋白基團在疏水相互作用下聚集,導致體系中疏水性降低,而Zeta絕對值電位升高。隨著加熱時蛋白的濃度升高,初級聚集形成的線股聚集體或球形聚集體會進一步結合成分形團簇,成為較大的聚集體。較高的聚集程度使豆乳凝膠凝固時間提前,凝固速率加快。高濃度煮漿的豆乳導致體系中存在較大的蛋白聚集體和融合的油脂體,過快的凝膠速率可導致進一步形成不均勻且空隙疏松的網絡結構。這一結果表明,通過調控豆乳的煮漿濃度能夠優化豆乳品質,調控凝固速率,為生產不同產品特性的豆腐制品提供理論支持。

