鈣-磷系自固化材料改性研究進展
李 航,廖建國,馬婷婷,馮錦倫
(河南理工大學材料科學與工程學院,焦作 454000)
0 引 言
臨床上絕大多數骨缺損是不規則的,定型的骨修復材料不易與周圍骨組織緊密接觸,從而影響修復效果,所以集成型和修復一體的骨水泥被廣泛應用于骨科微創手術。骨水泥主要分為生物惰性的聚甲基丙烯酸甲酯(polymethylmethacrylate, PMMA)骨水泥、生物活性的磷酸鈣水泥(calcium phosphate cement,CPC)和其他復合骨水泥[1]。PMMA骨水泥力學強度高,在臨床應用中使用最廣泛,但其不可降解,聚合過程放熱量大,易殺死周圍正常細胞,且未聚合單體具有細胞毒性[2-4]。CPC由兩種或兩種以上磷酸鈣粉末與液相溶液混合制備而成。CPC經溶解-沉淀反應生成的水化產物透鈣磷灰石或磷灰石(羥基磷灰石或缺鈣型羥基磷灰石),與骨的主要無機成分相似,將CPC植入體內后不會引起抗原反應,骨水泥能與骨直接結合,形成強骨-材料界面,成為新骨生長的模板,為新骨生長提供細胞附著增殖場所[5-7]。與PMMA骨水泥相比,CPC水化過程放熱量低,可降解,無細胞毒性,生物相容性好,可促進新骨再生[8-9]。然而,CPC力學強度低,不能用于承重部位,降解速度緩慢,誘導成骨細胞增殖分化和血管生長能力有待提高,與臨床應用需求仍存在一定的差距,所以國內外研究者對其進行了大量的改性研究[10-12]。本文從CPC的理化性能和生物學性能兩方面綜述了其改性研究進展。
1 CPC的理化性能
1.1 力學強度
CPC固化反應是溶解-沉淀的過程,當水泥固相顆粒與液相溶液混合后,固相顆粒逐漸溶解,顆粒周圍溶液過飽和,生成細晶和微晶,細晶和微晶相互纏繞,隨著時間推移,晶體不斷生長,晶體纏繞網絡逐漸致密,致使CPC具有一定力學強度。CPC可用于人體非承重部位,如牙周疾病治療、顱骨-頜面外科重建等,不能用作承重部位骨修復材料。目前,增強CPC力學性能方法主要分為三類:(1)顆粒增強;(2)纖維增強;(3)優化制備條件。
1.1.1 顆粒增強
當顆粒作為增強體均勻分布在CPC基體中后,填充了基體內部孔隙,材料結構致密,同時在外加載荷作用下,顆粒會阻礙基體位錯運動,位錯密度增加從而強化了基體,CPC強度得到提高。Zhang等[13]在CPC中加入粒徑小于106 μm的摻銅磷酸三鈣顆粒,改性后的骨水泥抗壓強度提高了30%。Xia等[14]以納米氧化鐵顆粒填充CPC基體,降低了CPC內部孔隙率和孔隙體積,其抗折強度增加了一倍。Lin等[15]將納米磷酸銅顆粒與CPC復合,納米顆粒填充了水泥顆粒空隙,提高了結構密實度,抗壓強度提高。
1.1.2 纖維增強
纖維通過橋接、裂紋撓度和摩擦滑動等增強機制可對CPC基體進行力學增強。當水泥基體產生裂紋時,纖維橋接裂紋,阻止裂紋繼續擴展并改變裂紋擴展方向;纖維引起裂紋撓曲延長裂紋擴展距離,消耗能量;纖維在被拔過程中與水泥基體發生摩擦滑動,會進一步消耗來自應力的能量,從而提高水泥的抗斷裂性能。Zhang等[16]選用細菌纖維素(BC)纖維增強CPC,纖維表面的OH鍵與CPC表面Ca2+發生配位反應,形成纖維-基體強界面(見圖1),摻入2%(質量分數)BC纖維后抗壓強度提高了兩倍。Li等[17]發現2%(質量分數)玄武巖纖維可顯著提高了CPC的韌性,同時,抗折和抗壓強度也得到提高,但隨著纖維含量的增加,增強效果降低。Petre等[18]發現當CPC中加入5%(質量分數)聚乙烯醇纖維后,其斷裂功為(8.7±2.5)kJ/m2,達到皮質骨最低韌度值(1.5~15 kJ/m2)。
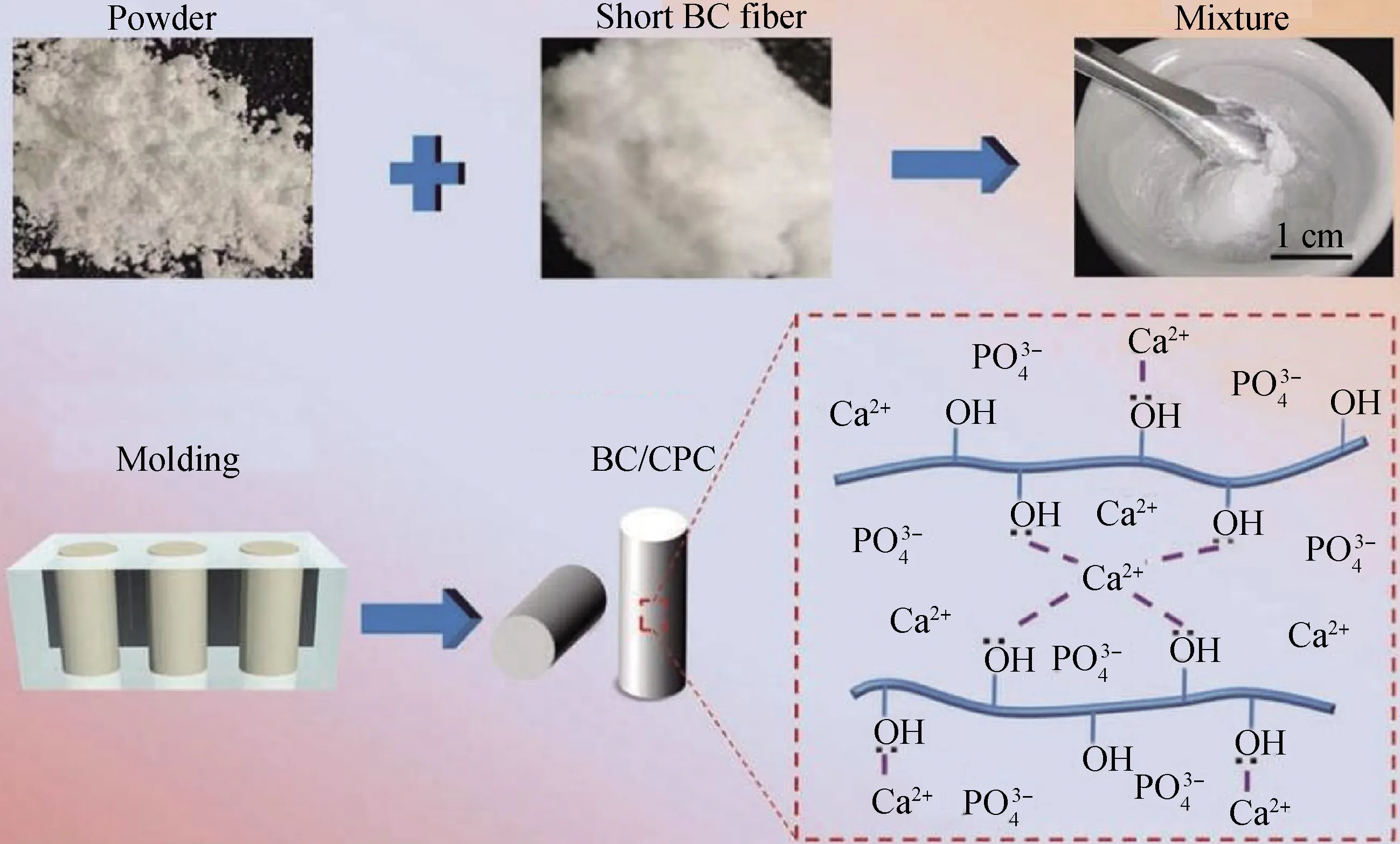
圖1 BC纖維與CPC界面反應的制備方法和機理[16]
1.1.3 優化制備條件
CPC粉體顆粒粒徑會影響其力學強度,顆粒越小,顆粒比表面積越大,與液相接觸面積越大,磷灰石晶體生成速率越快,會形成大量細晶和微晶,晶體密集纏繞使CPC力學強度增加。黃萍等[19]采用球磨技術對CPC粉末進行機械活化處理,原料粉末比表面積增大,原料反應活性提高,致使水泥固化后的水化產物黏結更加緊密,提高了水泥結構密實度,結果表明,原料經過球磨處理后的CPC抗壓強度約為未處理的兩倍。
當CPC固化的時候外部環境發生改變時,水泥性能會發生變化。Wang等[20]將石墨烯(RGO)/碳納米管(CNTs)增強的CPC在微波環境下進行固化反應,微波有助于離子擴散,加速固化反應,會促進RGO、CNTs和基體界面結合緊密,與未處理的復合CPC相比,微波處理后的復合CPC力學強度增高且先達到最大值。
1.2 可注射性
可注射骨水泥常用于填補骨質疏松引起的骨折損傷、骨折原位固定和腫瘤等疾病治療的微創手術中[21],是手術成敗的關鍵因素之一。CPC的可注射性是指在骨水泥注射過程中能夠保持均勻性的能力。當前,表征骨水泥可注射性的方法主要為:(1)使用萬能試驗機對注滿骨水泥的注射器進行外力加載,加載速度固定,計算骨水泥被擠出部分重量與初始重量的百分比;(2)對裝滿骨水泥的注射器進行固定的外力加載,計算骨水泥注射后的質量殘余率;(3)測試定量的骨水泥被完全注射所需要的注射力[22-25]。CPC原料顆粒內部分散度和漿料黏度顯著影響CPC漿料可注射性。
Hurle等[23]通過加入植酸(IP6)對CPC進行改性(見圖2),隨著IP6量增加,CPC基體中Ca2+與IP6中磷酸基團螯合產生的螯合物含量增加,使游離Ca2+含量降低,水泥漿體固化時黏度增加,固化反應速度延緩。但IP6加入提高了CPC表面電荷量,可有效分散水泥顆粒,使水泥漿體能有效通過注射器,在混合10 min后CPC仍保持良好的可注射性。Nezafati等[24]在以磷酸四鈣(TTCP)為主要成分的CPC中加入微乳化明膠顆粒(GMs)得到可注射骨水泥(GMs/CPC),隨著GMs用量增加,GMs/CPC凝結時間延長,注射時間增加;GMs/CPC的可注射率高于純CPC;其中,含10%(質量分數)GMs的骨水泥可注射性最佳。Amirian等[25]將海藻酸(ALG)-透明質酸(HA)微珠(ALG/HA)摻入CPC后,與CPC對比,在注射位移12 mm時所需注射力更低,且兩種骨水泥在注射過程中無裂縫出現(見圖3)。
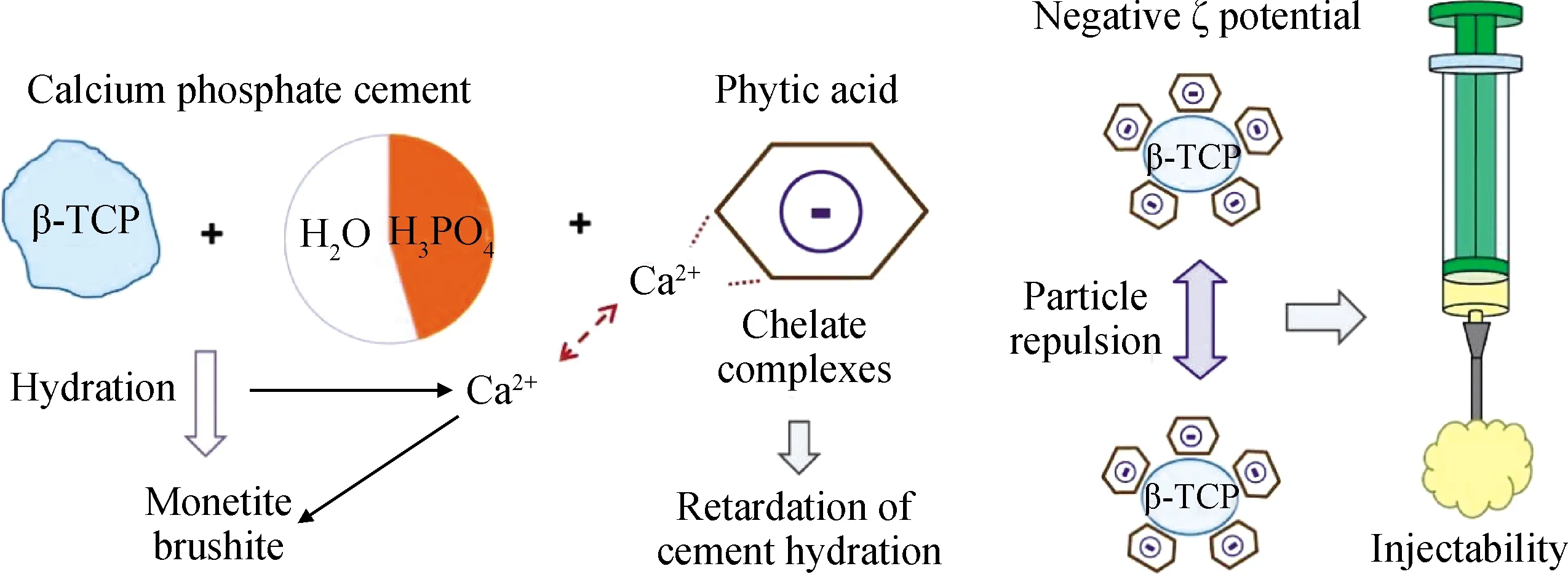
圖2 植酸與CPC粉體結合形成可注射CPC[23]

圖3 CPC和CPC/ALG-HA水泥的可注射性分析[25]
1.3 抗潰散性
在體內液體環境下,未固化完全的CPC漿體易受到周圍組織液體侵蝕,發生材料解體潰散,潰散的水泥顆粒易進入血管中隨血液流動,容易使血管堵塞,若潰散的水泥顆粒隨血液流動進入器官中,會引起肺栓塞等嚴重術后并發癥[26],因此,抗潰散性是CPC重要的性能之一。
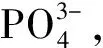

圖4 KGM/GG共混物的加入顯著提高了CPC的抗沖刷性能[28]
1.4 放射不透明性
在微創手術中,為及時掌握骨水泥注射情況,避免骨水泥滲漏或注射不足,骨水泥注射過程需要在放射顯影器下進行。但CPC與骨成分相似,X射線照射下兩者對比度低,難以區分,會影響手術操作判斷,因此需要提高CPC在X射線下的顯影效果。添加造影劑于骨水泥中可提高其放射不透明性,常用的造影劑主要為原子量高、比重大的高密度造影劑,如BaSO4和碘制劑等。
Liu等[31]把造影劑BaSO4引入玉米淀粉(starch)-CPC中,通過在大鼠皮下注射和股骨注射評價復合水泥放射不透明性,結果發現,摻有20%(質量分數)玉米淀粉的磷酸鈣復合骨水泥(CPS)與自體骨有相似的放射不透明性,而添加20%(質量分數)BaSO4和20%(質量分數)玉米淀粉-磷酸鈣復合骨水泥(CSB)、添加30%(質量分數)BaSO4的PMMA放射顯影密度均高于自體骨,能呈現出清晰的X射線對比影像(見圖5)。
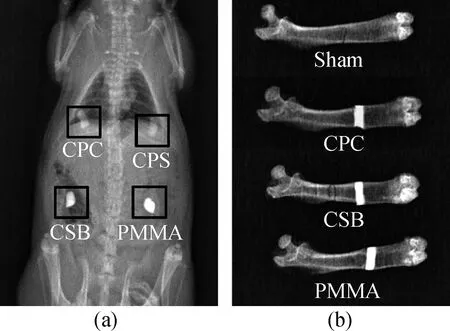
圖5 骨水泥X射線影像片(a)皮下植入和(b)股骨植入(CPC:磷酸鈣水泥;CPS:20%(質量分數)玉米淀粉-磷酸鈣復合水泥;CSB:添加20%(質量分數)BaSO4和20%(質量分數)玉米淀粉-磷酸鈣復合水泥;PMMA:添加30%(質量分數)BaSO4的聚甲基丙烯酸甲酯水泥;Sham為自體骨)[31]
碘比醇(iobitridol)為非離子型溶于水的含碘造影劑,性能穩定,滲透壓低,耐受性好,Le Ferrec等[32]將水溶性碘化造影劑碘比醇與CPC結合,當碘比醇含量在水泥中達到70 mg/mL時,CPC能快速釋放定量造影劑,且摻入碘比醇并不影響骨水泥的可注射性、力學強度和生物相容性。
在市場經濟條件下,各企業之間的競爭愈演愈烈,各企業在面對如此激烈的競爭時,往往會采用各種各樣的手段來提高企業的效益,諸如采用賒銷的辦法來刺激企業產品的輸出,減少產品的滯留,也能夠使顧客更加愿意去購買相應企業的商品。然而,賒銷政策的實施,雖有利于促進銷售,但也往往會帶來客戶拖欠款的現象。企業收不回應收賬款,會給企業帶來一定的資金危機,從而使企業不能夠持續穩定地發展。因此,市場上商業競爭過大也是企業應收賬款制度現存的一個大問題。
鉍是一種不透光元素,毒性低。Wu等[33]加入鋁酸鉍(BiA)來增強CPC輻射透明度,隨著BiA含量的增加,CPC的對比度提高,放射不透明度得到顯著改善,BiA-CPC也具有良好的細胞相容性。
2 CPC生物學性能
2.1 成骨活性
骨移植物的基本特性包括骨傳導、骨誘導、骨形成和結構支撐[34]。對于CPC,可通過改性促進其骨誘導、骨形成和成血管化等提高成骨活性。常用的改性方法主要為兩種:添加生物活性因子和添加生物活性離子。
2.1.1 添加生物活性因子
生長因子可以調控成骨細胞和破骨細胞基因表達,促進骨細胞分化,誘導血管生長。在CPC中加入生長因子后,可誘導新骨和血管生長,進一步促進骨損傷部位愈合。蛋白質基本組成單位氨基酸可促進骨髓間充質干細胞(BMSCs)增殖分化[35],賴氨酸為骨骼代謝重要的氨基酸,Shi等[36]將賴氨酸引入CPC,實驗發現對BMSCs成骨分化有顯著性改善,促進了纖維連接蛋白的固定。
降鈣素基因相關肽(CGRP)可以刺激血管皮內細胞增殖[37],通過促進血管生長,為骨生長傳輸營養物質,從而促進骨生長。Lv等[38]將CGRP與殼聚糖-Sr-CPC相復合后,釋放的CGRP可增強人臍靜脈內皮細胞增殖,顯著上調血管內皮生長因子(vascular endothelial growth factor, VEGF)基因表達和蛋白分泌,改善血管生成。
2.1.2 添加生物活性離子
微量元素在骨生長過程中發揮著重要作用,可促進骨質礦化和膠原合成,刺激成骨細胞增殖,誘導BMSCs分化為成骨細胞,抑制破骨細胞活性,刺激血管內皮生長基因表達促進血管生長,優化骨免疫調節特性。與生長因子成本高、半衰期短、釋放不穩定不易控制,僅適用于短期骨愈合相比,生物活性微量元素離子可通過多種方式儲于CPC中,且相對生物活性因子更容易調控其釋放速率。目前,在CPC中摻雜具有生物活性的微量元素離子,如Zn、Si、Cu和Sr等,成為一種提高骨水泥成骨活性的新型有效策略。

圖6 0% ZS/PLGA/CPC和10% ZS/PLGA/CPC復合材料分別植入4周(a)、8周(b)和16周(c)后的代表性組織學切片和新骨定量結果(d)(NB:新骨;M:材料)[43]
據報道[45],Cu2+刺激BMSCs增殖并分化為誘導礦化的成骨細胞,可調節VEGF,刺激新血管生長,有助于新骨生長。Zhang等[13]將合成的摻銅磷酸三鈣(Cu-TCP)顆粒,與由部分結晶磷酸鈣和無水磷酸二鈣組成的CPC混合制成Cu-CPC,Cu2+與CPC表面生成的羥基磷灰石(hydroxyapatite, HAp)晶體相結合導致Cu2+離子釋放量相對較低,小鼠BMSCs和人臍靜脈內皮細胞在Cu-TCP/CPC上均有良好的活性,骨和血管相關基因表達上調,Cu-CPC對血管化新骨再生具有促進作用。Lin等[15]用CuP納米顆粒作為Cu2+載體引入CPC中,結果表明,釋放的Cu2+刺激成骨分化基因和血管相關基因表達,從而促進血管生長和BMSCs增殖分化。
Sr元素具有雙重作用,一方面能刺激成骨細胞分化,另一方面又抑制破骨細胞活性,在骨質疏松治療中起著關鍵作用[46]。Schumacher等[47]研究了Sr-CPC對人間充質干細胞體外增殖和成骨分化的影響,結果表明,由Sr-CPC處理的人間充質干細胞中ALP活性高,Sr-CPC促進人間充質干細胞增殖和成骨分化。Schumacher等[48]研究了Sr-CPC對破骨細胞的影響,結果表明,Sr-CPC在體外不能抑制破骨細胞形成,但能顯著降低破骨細胞對骨基質的吸收。Lode等[49]采用SrCO3取代 α-TCP基骨水泥粉體中的CaCO3組分,制備了Sr-CPC,Sr摻雜增強了CPC的骨原細胞增殖和成骨分化,在人尸體脊柱手術中證實了Sr-CPC在球囊后凸成形術具有適用性。
2.2 生物可降解性
CPC水化產物HAp溶解度較低,導致CPC在體內降解緩慢,難以與新骨生長同步。此外,CPC水化晶體之間存在孔隙,但孔徑微小導致新生骨組織僅限于生長在表面,無法滲透進入結構內部[50]。為了提高CPC降解速度,同時增大其內部孔隙體積,目前主要采用的策略是在CPC中引入致孔劑。致孔劑在CPC內部可以發生快速溶解或降解,使水泥內部產生大孔,大孔可傳遞營養成分,允許成骨細胞、破骨細胞和成血管相關細胞進入孔隙內生長[51],同時,致孔劑降解引起的孔隙會增加體液接觸面積,提高骨水泥在體液中的溶解性,促進水泥顆粒降解,從而有助于骨修復重建。
Yamamoto等[52]將粒徑為200~500 μm具有不同熱處理歷史的低內毒素GMs分散在CPC中,與CPC相比,GMs/CPC更易降解和吸收,并伴隨著新骨生成(見圖7);GMs/CPC的溶解速率與GMs熱處理溫度相關,通過調節GMs預熱處理溫度可控制CPC體內吸收速率和降解速率,其中383 K下GMs熱處理24 h的復合CPC降解性最佳。Smith等[53]把葡萄糖微粒(GMPs)和PLGA微粒作為CPC的雙致孔劑;體外降解8周后,GMPs和PLGA微粒幾乎完全降解,復合水泥孔隙率顯著增加;同時,GMPs的加入提高CPC早期孔隙率,促進PLGA降解產物擴散,減輕了PLGA降解物造成局部酸性。Grosfeld等[54]GMPs作為CPC的致孔劑,將GMPs/CPC植入大鼠股骨缺損兩周后出現明顯降解,且骨生成量顯著增加。Lodoso-Torrecilla等[30]在CPC中摻入PLGA和PVP顆粒,發現低分子量的PVP加入可影響骨水泥早期降解性,PLGA在CPC中內部水解降解產生的酸性單體,對CPC的充分降解有利。
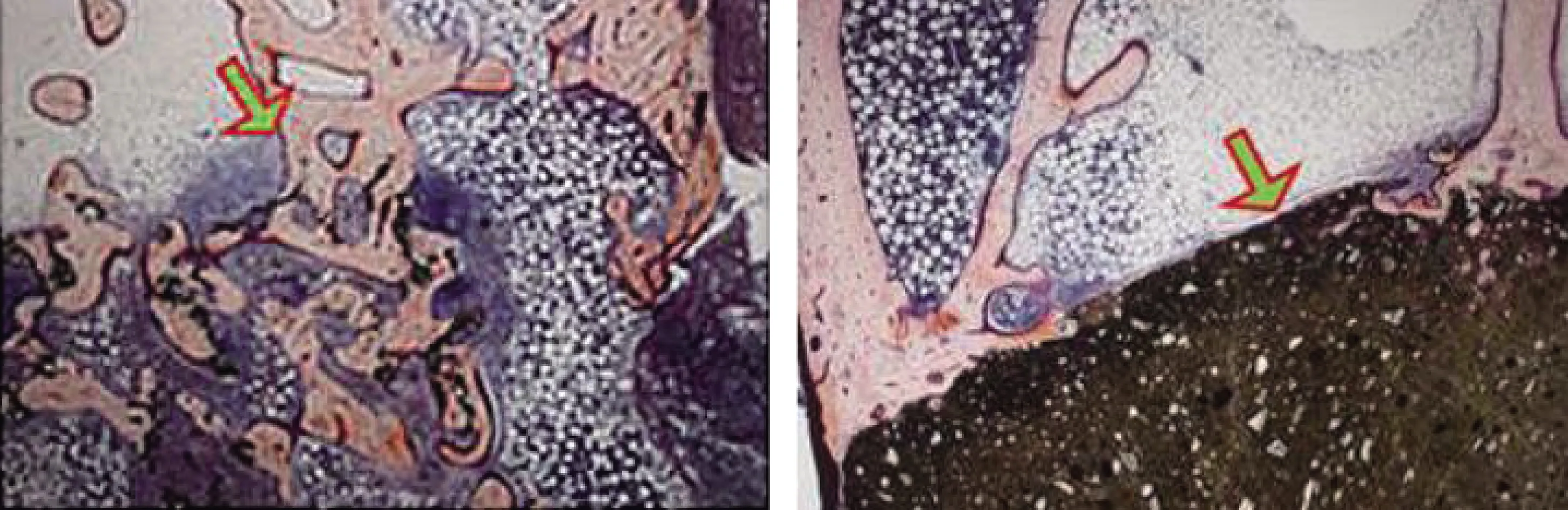
圖7 明膠微粒進行適當熱處理分散,使磷酸鈣骨水泥迅速吸收并伴隨骨形成[52]
2.3 載藥性
以CPC為載體的藥物緩釋體系是一種比較先進的給藥體系,藥物可以與CPC的固相或液相結合,附著在CPC表面或孔隙內,負載藥物的CPC復合體系具有載藥穩定性,可在骨缺損部位進行持續藥物釋放,使藥物維持在有效濃度范圍內,提高了藥物利用率,同時降低了藥物對于其他器官部位的刺激副作用。
Montazerolghaem等[55]在預混合酸性CPC中載入不同劑量的辛伐他汀發現,辛伐他汀可抑制破骨細胞分化和骨再吸收,但并不影響細胞增殖和生存能力。吳建煌等[56]用可降解的PLGA微球包裹利福平(RFP)藥物,與CPC復合得到RFP-PLGA-CPC發現,其固化體斷面孔隙比未改性的CPC多,有利于提高成骨性,且藥物可持續穩定局部釋放。Ghosh等[57]以含量不同的無定形晶態HAp作為CPC的固相,將萬古霉素和環丙沙星摻入固相中,研究發現,前體CPC組分中HAp處于初生沉淀無定形狀態時間越久,藥物擴散釋放越活躍,而凝結速率與藥物釋放速率和無定形HAp的含量成反比。
Prokopowicz等[58]將合成的介孔二氧化硅(CaP@MSi)與CPC制成雙相復合材料,用作鹽酸阿霉素(DOX)的給藥系統,結果表明,復合提高了CPC的成骨細胞活性,延長了DOX的釋放時間。Lucas-Aparicio等[59]將Si-β-TCP陶瓷粉末與微膠囊相變材料(MPCM)制備Si-CPC并負載萬古霉素,結果發現,Si-CPC具有零級釋放動力學,與負載的藥物濃度無關,能有效地調整藥物釋放動力學,抑制金黃色葡萄球菌的生長。Filippo等[60]將硫酸慶大霉素作為模型藥物,分別采用藥物微粒直接與CPC混合、負載藥物的固體脂質微粒與CPC混合、藥物直接與CPC和固體脂質微粒復合等三種方式進行性能對比,結果顯示,藥物微粒與CPC復合的效果較優,能抑制菌株及分離株活性,可長期緩慢釋放抗菌活性藥物,且其物理性能沒有減弱。
3 結語與展望
CPC具有良好生物活性和生物相容性,能任意塑形,自行固化,但是CPC性能與臨床所需仍有一定差距。
與天然骨相比,CPC脆性大,力學強度低,不能應用于承重部位,所以其力學性能改善一直被重點研究。根據顆粒和纖維增強機制,將納米顆粒和纖維引入CPC中,可使其內部結構致密,抗壓強度增大,同時纖維在內部承擔部分外界沖擊應力,可提高其韌性和抗沖擊能力。在體內植入環境下,CPC由于處于復雜的體液環境容易發生潰散,預設結構遭到破壞,顆粒沖散分布到其他部位,容易引起血管堵塞等并發癥,研究者們通過增強水泥顆粒內部黏聚力來提高CPC的抗潰散能力,防止其植入體內發生潰散。從臨床應用角度而言,CPC的可注射能力和放射不透明性都應引起重點關注,增強其可注射性有助于手術操作,而通過改善CPC的放射不透明性,使其與自體骨影像在放射條件下呈現不同程度亮度,便于操作人員觀察骨水泥注射進度,防止發生骨水泥滲漏和填充不足。
CPC降解緩慢,不能誘導成骨細胞增殖分化和新血管生長,其生物學性能亦被重點關注。生物活性因子和生物活性離子在成骨過程發揮著重要作用,將它們引入CPC中,植入體內后可刺激成骨相關基因,參與成骨過程,促進新血管產生。CPC植入體內后,細胞逐漸長入水泥內部,在其內部發生增殖分化,同時與周圍組織相結合,CPC應逐漸降解,最終新生骨組織取代CPC,骨缺損部位愈合。由于結構致密,內部大孔隙少,CPC降解速度緩慢,無法與骨生長速度相匹,將致孔劑摻入其中,促使內部產生大孔隙,可加速骨水泥降解。此外,CPC作為單一骨修復材料具有一定局限性,如何將其與藥物相結合成為了研究熱點;理想狀態下,藥物與CPC結合,隨著CPC在體內降解,藥物緩慢釋放,植入部位可持續保持一定的藥物濃度,使骨愈合和靶向治療能夠同步進行。總之,CPC理化性能和生物學性能如何綜合改性以滿足臨床應用需求,成為CPC未來研究的新挑戰。

