CT檢測非酒精性脂肪性肝病合并高危冠狀動脈斑塊患者冠狀動脈指標臨床意義探討*
蔡冬梅,吳文娟,姜亦倫,居敏昊
冠心病是非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)患者的主要死亡原因。NAFLD容易促進高危冠狀動脈斑塊(high-risk coronary plaques,HRP)的形成,而存在HRP提示斑塊的易損性[1-3]。在所有致命性心肌梗死和心源性猝死病例,超過70%是源于易損斑塊的破裂,嚴重影響冠心病患者的長期。異位脂肪沉積在NAFLD的發生發展過程中也發揮著重要的作用。NAFLD發展可能導致代謝紊亂和內臟脂肪增加,特別是心外膜脂肪組織(epicardical adipose tissue,EAT)和血管周圍脂肪組織增加。脂肪細胞因子通過直接融合釋放炎癥因子到達血管壁,加速冠狀動脈粥樣硬化的進程[4-8]。MRI是目前評估肝臟脂肪變性最準確的非侵入性檢查,但它并不適合某些存在MRI檢查禁忌證的患者,因此其臨床適用性受到了限制,并不能被廣泛推廣應用。CT可以規避MRI檢查所帶來的弊端,不過肝臟CT衰減容易受管電壓的影響,傳統單能CT檢測輕度肝臟脂肪浸潤的敏感度較低,其檢查價值有限。隨著雙能CT技術的迅速發展,其特有的雙能CT基質分解算法衍生出新的成像指標,即肝臟脂肪分數(hepatic fat fraction,HFF)有助于克服這個困難[9,10]。研究報道稱HFF可以通過分解肝臟組織、脂肪和碘,評估實際的肝臟脂肪含量。最近的研究表明HFF定量測定肝臟脂肪具有與磁共振波譜相媲美的診斷表現,臨床應用的可行性強且可重復性好[11]。本研究檢測了NAFLD合并冠狀動脈HRP患者HFF水平變化,現報道如下。
1 資料與方法
1.1 研究對象 2015年1月~2021年1月我院診治的NAFLD患者168例,男性114例,女性54例;平均年齡為(63.2±8.5)歲。NAFLD診斷符合《非酒精性脂肪性肝病診療指南(2010年修訂版)》,超聲檢查至少符合以下兩項:肝臟近場回聲彌漫性增強(“明亮肝”),回聲強于腎臟;肝內管道結構顯示不清;肝臟遠場回聲逐漸衰減[11,12]。納入患者碘過敏試驗陰性,心率<100次/分,無心律不齊,既往無嚴重的肝腎心腦血管疾病。排除標準:既往接受過冠狀動脈支架植入術或搭橋手術、因屏氣差或其他原因造成圖像質量不清、梗阻性黃疸、自身免疫性肝病、存在肝臟惡性腫瘤。本研究經我院醫學倫理委員會批準,患者及其家屬簽署知情同意書。
1.2 CT冠狀動脈成像檢查 使用SOMATOM Force雙源CT(Siemens公司,德國)進行冠狀動脈成像掃描。掃描前,囑患者舌下含服硝酸甘油片以擴張冠狀動脈。通過掃描定位像,確定掃描范圍。使用高壓注射器經外周靜脈注射對比劑優維顯(370 mgI/ml,Bayer公司,德國)60 ml,注射速率為4.5~5.0 ml/s。CT掃描參數:管電壓120 kV,管電流280 mA,準直器寬度為64 mm×2 mm×0.6 mm,厚度為0.75 mm,旋轉時間為0.28 s,球管旋轉時間為0.33 s/r。應用Frontier Version軟件(Siemens公司,德國)分析冠狀動脈斑塊。根據既往研究報道的HRP定義,至少符合以下幾項中的兩項:低密度斑塊(CT值<30 HU)、點狀鈣化斑塊(最大直徑<3 mm)、重構指數(冠狀動脈最狹窄處管腔面積/近遠端參考血管面積平均值)>1.1和餐巾環征(即冠狀動脈非鈣化斑塊周圍環狀高密度影)[13]。采用測量工具計算預先設定的CT閾值范圍內脂肪組織體積,包括心外膜脂肪組織體積(epicardical adipose tissue volume,EATV)和冠狀動脈周圍脂肪組織(pericoronary adipose tissue volume,PATV)。應用Syngo.via工作站(Siemens公司,德國),采用手動標定出冠狀動脈各分支鈣化灶,應用鈣化積分軟件計算冠狀動脈鈣化積分(coronary artery calcification score,CACS)。避開肝臟重要血管和膽管結構,在門靜脈水平(分別為左肝、右前葉和右后葉)隨機繪制3個感興趣區(ROI),約為2.0~2.5 cm2。在Syngo.via工作站基于雙能CT基物質分解算法自動計算HFF,取3個ROI的平均值。
1.3 檢測與評估 使用日本Sysmex公司提供的XE 5000型血細胞分析儀檢測血常規,計算中性粒細胞/淋巴細胞比率(NLR);使用美國Abbott Laboratories公司生產的全自動生物化學分析儀檢測血生化指標;采用Framingham危險評分評價患者冠心病事件風險[14]。
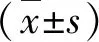
2 結果
2.1 NAFLD患者冠狀動脈CT成像表現 見圖1。

圖1 NAFLD患者冠狀動脈CT成像表現a:男,69歲。胸悶1月,CACS 為316.7。在肝臟門靜脈水平,肝實質平均CT值為30 Hu;b:右冠狀動脈中段混合斑塊;c:回旋支近段非鈣化斑塊,管腔重度狹窄,中遠段多發鈣化斑塊; d:男,62歲。胸部不適2月,CACS為971.3。肝實質密度降低,平均CT值為38 Hu;e:左冠狀動脈前降支近段多發體積較大鈣化斑塊和混合斑塊;f:回旋支近段鈣化斑塊和軟斑塊,局部管腔重度狹窄;g:女,47歲。反復胸悶心悸不適3年。肝實質平均CT值為54 Hu;h/i:左冠狀動脈前降支近段軟斑塊,其內見斑點鈣化,管腔輕度狹窄
2.2 三組心臟CT檢測指標比較 在168例NAFLD患者中,發現無冠狀動脈斑塊76例,存在冠狀動脈斑塊但不符合HRP者48例和HRP 44例。三組EATV、EAT CT值、PATV、PAT CT值、HFF和肝臟CT值等差異具有統計學意義(P<0.05,表1)。
2.3 三組臨床指標比較 三組吸煙史、合并高血壓、糖尿病、HDL、TG、TC、NLR和Framingham危險評分等差異具有統計學意義(P<0.05,表2)。
2.4 兩組冠狀動脈斑塊資料比較 HRP陰性組與HRP組冠狀動脈狹窄、低密度斑塊、點狀鈣化斑塊、重構指數和餐巾環征等差異具有統計學意義(P<0.05,表3)。

表1 三組心臟CT檢測指標比較

表2 三組臨床指標比較
3 討論
一般認為,HRP的存在預示著急性冠脈綜合征的發生。準確識別HRP高危人群有利于早期臨床干預,降低重大心臟不良事件的發生。多種心血管危險因素與HRP獨立相關,如吸煙、糖尿病和血管炎癥等。肝臟脂肪沉積可能參與了EAT的蓄積。

表3 兩組冠狀動脈斑塊資料【%,M(P25,P75)】比較
PAT是EAT的一部分,與冠狀動脈直接接觸,通過血管分泌和旁分泌作用,釋放多種炎性細胞因子和血管活性介質,如腫瘤壞死因子α、白細胞介素6、白細胞介素7和血管緊張素,引起冠狀動脈內皮細胞功能障礙,影響動脈粥樣硬化的脂質代謝。這些變化可能會增加NAFLD患者動脈粥樣硬化易感性,并推動斑塊不穩定性的進展[15]。HRP患者冠狀動脈更易發生嚴重鈣化和梗阻性病變,HRP患者冠狀動脈狹窄更為嚴重[16]。
超聲或傳統CT檢查對輕中度脂肪變性的NAFLD患者診斷敏感性差[17]。本研究在Syngo.via工作站基于雙能CT基物質分解算法自動計算NAFLD患者HFF,從而實現CT增強檢查對肝臟脂肪的定量測定。雙能CT測定對肝臟脂肪具有較好的診斷價值[18-19]。

