基于形態學和宏條形碼技術的南海西沙群島浮游動物多樣性的比較分析
王方晗,王 雷,孫婷婷,董志軍,3*
(1.中國科學院煙臺海岸帶研究所牟平海岸帶環境綜合試驗站,山東 煙臺 264003;2.中國科學院大學,北京 100049;3.中國科學院海洋大科學中心,山東 青島 266071)
被稱為“海洋之肺”的珊瑚礁系統是已知的生物多樣性最高的海洋生態系統,由多個相互依存的生物群落和珊瑚礁生境組成[1],具有極高的生態價值和經濟價值。浮游動物作為次級生產力的重要組成部分,在珊瑚礁系統功能、食物網動力學、生物地球化學循環和漁業資源補充等方面都起著至關重要的作用[2-4]。同時,浮游動物對酸化、低氧、升溫等海水環境變化以及重金屬、抗生素等人工污染物干擾十分敏感[5-6],其種類組成和群落結構可作為評估珊瑚礁生態系統質量和健康狀況的重要指標[7-8]。
浮游動物多樣性的研究依賴于物種的準確鑒定,傳統方法為利用光學技術根據形態特征進行鑒定,耗時較長且需要專業的分類學知識。同時個體微小、豐度極低的物種易被忽視,形態十分相似的不同物種也難以區分,具有一定的局限性[9],難以滿足現代化海洋生態監測與保護自動化、標準化的需求[10]。基于第二代測序 (next-generation sequencing,NGS)的宏條形碼技術能夠更為準確、快速地檢測環境樣本中的物種組成及豐度,目前已廣泛應用于生物多樣性監測[11]。
宏條形碼技術通過從樣品中直接提取基因組DNA,利用測序技術對目標物種進行定性或定量分析,常用于物種多樣性鑒定和外來入侵物種的監測,在環境微生物群落分析中得到廣泛應用[11]。宏條形碼技術在真核生物中的應用仍處于實驗和分析階段,但用于評估浮游動物等多細胞生物的時空分布特征及多樣性研究的潛力已得到廣泛承認[12]。通過對整個群落樣本的DNA進行測序,宏條形碼技術能夠在分類學上復雜的組合中識別任何生命階段的物種,包括隱存種以及傳統方法易忽視或無法鑒定的物種,顯著提高物種的檢出率[10,13-15],使物種多樣性鑒定結果更為準確。在發現非本土物種方面,宏條形碼技術也為脆弱海洋生態系統中入侵物種的監測提供重要信息[14,16]。
采用宏條形碼技術評估浮游動物多樣性,不僅需要相對完備的已鑒定標本參考基因序列庫[14],還需選擇合適的宏條形碼以保證合適的物種覆蓋度和物種敏感性[17],以避免大量物種的漏檢或無法有效區分近源物種。宏條形碼要求足夠多的可變區域用于物種識別,兩側則需為保守區域以正確結合引物[18]。傳統核糖體18S rRNA基因在無脊椎動物和脊椎動物的屬、科和高級分類群中表現出一致的差異模式[19],其V9高變區是海洋真核生物多樣性的標準標記,并已廣泛用于浮游動物的分析[14,20-22]。目前宏條形碼技術在浮游動物鑒定的應用中仍處于發展階段,相關參考數據庫仍不完整,因此,在進一步完善參考DNA序列數據庫的同時,至少對于代表性樣本,應同時進行傳統形態學鑒定,以確保浮游動物物種多樣性鑒定的準確性。
本研究于2019年5月在西沙群島14個調查站位 (主要為礁盤外沿和潟湖)采集浮游動物樣品,分別利用傳統形態學鑒定方法和基于18S V9高通量測序的宏條形碼技術進行形態學鑒定與分子鑒定,分析各站位浮游動物的物種組成,探究西沙群島浮游動物物種多樣性及空間分布特征,并從物種組成、豐度、優勢種、多樣性指數等方面對兩種方法進行比較,從而評估宏條形碼技術在浮游動物物種多樣性監測中的應用潛力。此外,由于以造礁石珊瑚為食的長棘海星 (Acanthasterplanci)近年來在全球主要分布海域大規模暴發,導致大量珊瑚礁生態系統功能退化、海洋生物多樣性降低等一系列生態問題[23],對西沙群島珊瑚礁的健康造成威脅。因此,本研究重點關注長棘海星的分布與豐度,以期為西沙群島長棘海星的防治提供信息支持。
1 材料與方法
1.1 樣品采集
于2019年5月14日—22日在西沙群島海域14個站位 (表1)采樣,使用淺水II型浮游生物網,參照《海洋監測規范》[24]采集樣品。每個站位垂直拖網兩次,獲得兩份浮游動物樣品,一份加入5%(體積分數)甲醛溶液固定用于形態學鑒定,另一份用篩絹 (孔徑0.160 mm)將海水過濾后,加入無水乙醇固定用于基于18S V9宏條形碼的分子鑒定。
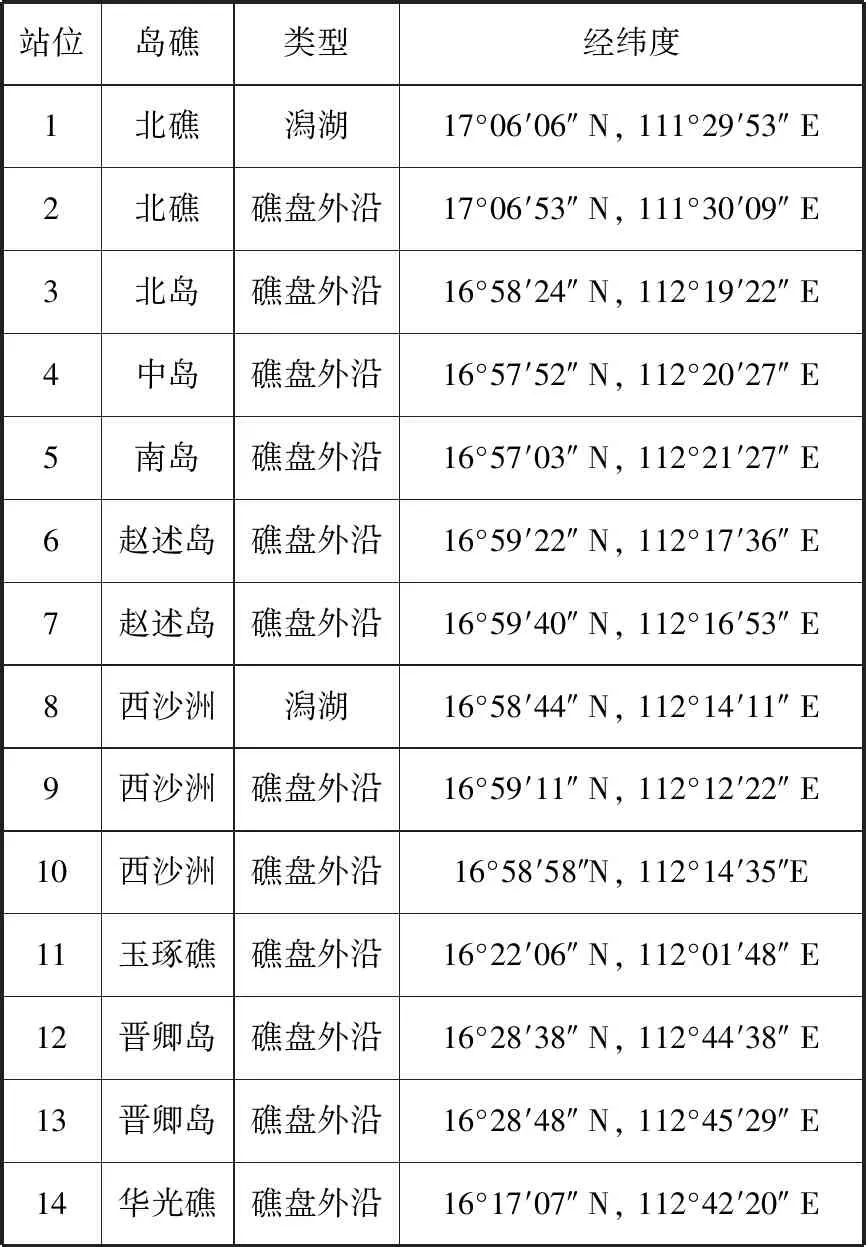
表1 西沙群島海域浮游動物多樣性調查站位概況Tab.1 Sampling stations of zooplankton diversity survey in areas of Xisha Islands
1.2 形態學鑒定
將浮游動物的甲醛保存樣品置于體視顯微鏡(OLYMPUS SZX10)下進行形態學鑒定分類和計數,浮游幼體鑒定至類,其他類別鑒定至種[25]。少數情況下樣本只能被鑒定至屬或更高的分類水平,在進行統計分析時,無法鑒定到種的類群按一種統計[26]。
1.3 宏條形碼技術分子鑒定
浮游動物無水乙醇保存樣本經同孔徑篩絹過濾除去乙醇后,采用十六烷基三甲基溴化銨 (cetyltrimethylammonium bromide,CTAB)和十二烷基磺酸鈉 (sodium dodecyl sulfate,SDS)方法[27]提取浮游動物樣本的基因組DNA,經瓊脂糖凝膠電泳檢測純度和濃度后,取適量DNA用無菌水稀釋至1 ng/μl。以稀釋后的DNA為模板,以1391F (GTACACACCGCCCGTC)和EukBr (TGATCCTTCTGCAGGTTCACCTAC)[28]為引物對18S V9基因片段進行PCR擴增。擴增產物經檢測與回收后進行文庫構建,檢驗合格后的文庫使用NovaSeq 6000上機測序。
從下機數據中拆分出各站位樣本數據,經過拼接[29]、嚴格過濾[30]、質量控制[31]及去除嵌合體序列[32]等流程后,獲得最終有效序列。利用Uparse軟件[33]將所有樣本的全部有效序列以97%的一致性聚類成為操作分類單元(operational taxonomic units,OTUs),以出現頻數最高的OTU序列為代表性序列,與Silva132數據庫比對進行物種注釋 (設定閾值為0.6~1.0)。由于18S V9引物物種覆蓋度較高,不僅能擴增出浮游動物,還能擴增出大量藻類、真菌及人類基因等[17],因此需對序列進行篩選,去除注釋為藻類、真菌、細菌、人類基因及未鑒定的序列,僅保留注釋為浮游動物的序列。此外,由于Silva132數據庫缺乏浮游動物中常見的一些分類群[34],為確保鑒定結果的準確性,將相對豐度較高 (>1‰)的OTUs比對至美國國家生物技術信息中心 (National Center of Biotechnology Information,NCBI)中的非冗余蛋白庫數據庫 (Non-redundant Protein Sequence Database,NR)進行進一步物種注釋,比對結果只保留序列的覆蓋度大于85%、相似度大于90%的浮游動物注釋結果[35]。
1.4 統計分析
浮游動物優勢種根據每個種的優勢度 (Y)[25]確定,使用R (4.0.2)的Picante包[36]對形態學及分子鑒定結果的浮游動物α多樣性指數進行計算,包括物種豐度指數 (d)[37]、Shannon多樣性指數 (H′)[37]、Simpson多樣性指數 (D)[38]和物種均勻度指數 (J)[37],具體計算公式如下:
(1)
(2)
(3)
(4)
J=H′/Hmax
(5)
式 (1)中:ni為第i種的個體數目,N為所有種類總個體數目,fi為該種在各站位中的出現頻率,定義Y值大于0.02的種類為本次調查的優勢種 (每個OUT序列作為一個個體數目計算)。式 (2)至 (5)中:S為樣品中種類總數,N為所有種類總個體數目,Pi為第i種的個體數目與樣品中的總個體數目的比值,Hmax為Shannon多樣性指數的最大值。使用SPSS 25.0 并應用Pearson相關系數對兩種鑒定方法獲得的多樣性指數進行相關性分析。
2 結果與討論
2.1 相對豐度
基于形態學特征在14個站位浮游動物樣本中共鑒定出浮游動物物種數目為86種(包括11門、17綱、18目、36科、63種,浮游幼體17類),其中橈足類種類最多 (40種),占總物種數目的46.5%,糠蝦類、毛顎類、水螅水母類、等足類、端足類、漣蟲類、多毛類、雙殼類等種類也有分布。西沙群島各島礁浮游動物豐度分布具有空間差異性,平均密度為707.53±378.34 ind/m3,其中玉琢礁站位的浮游動物密度最高,達1 446.76 ind/m3,西沙洲潟湖站位密度最低,僅為167.89 ind/m3。
通過18S V9引物測序后平均每個站位樣品獲得102 535條序列,經過質控后平均得到99 885條有效序列,聚類后所有站位樣品共得到3 013個OTUs。在序列數目與物種數目(即OTUs數目)關系的稀疏曲線中,物種數目增加的速度隨序列數目的急劇升高而逐漸降低,表明各站位的測序量足夠覆蓋大部分種類。將OTUs序列比對至Silva132數據庫進行物種注釋,能夠注釋到數據庫的OTUs數目為2 837(94.16%)。為減少可能存在的虛假差異,僅對OTU數量大于10的序列進行分析[39],同時去除未鑒定、未分類及注釋為藻類、真菌、細菌、人類基因以及哺乳綱動物的序列后,最終獲得233個浮游動物OTUs(包括22門、46綱、85目、120科、136屬、110種),其中185個OTUs屬于后生浮游動物,48個OTUs屬于原生浮游動物。
為直觀查看各站位浮游動物樣品在不同分類水平上相對豐度較高的物種及其占比,根據兩種方法的鑒定結果,選取每個站位在大部分物種鑒定至的分類水平 (門、綱、目)上相對豐度排名前10的物種,生成物種相對豐度柱形累加圖 (圖1)。結果表明形態學鑒定及18S V9分子鑒定中節肢動物均在西沙群島生物中占據主導地位,其在各站位中相對豐度分別為45.29%~88.78%及27.79%~82.84%,除形態學鑒定中的雙鞭毛蟲門 (11.54%)及分子鑒定中的毛顎動物門 (13.24%)外,其余門類平均相對豐度均未超過10%。在綱水平上,平均相對豐度最高的均為顎足綱 (形態學鑒定中占比63.10%,分子鑒定中占比37.47%),其次分別為甲藻綱 (形態學鑒定均為夜光蟲,11.54%)和軟甲綱 (分子鑒定,21.24%)。哲水蚤目 (25.29%)、劍水蚤目 (16.33%)及鞘口水蚤目 (12.55%)在形態學鑒定中占據主導,而分子鑒定中平均相對豐度較高的目則為哲水蚤目 (30.00%)、糠蝦目 (13.63%)及無橫肌目 (12.98%)。在形態學鑒定中占比最高物種為夜光蟲 (Noctilucascintillans,12.30%),其次為小紡錘水蚤 (Acartianegligens,10.90%),分子鑒定中則為糠蝦 (Paramesopodopsisrufa,11.80%)和肥胖軟箭蟲 (Flaccisagittaenflata,8.50%)。
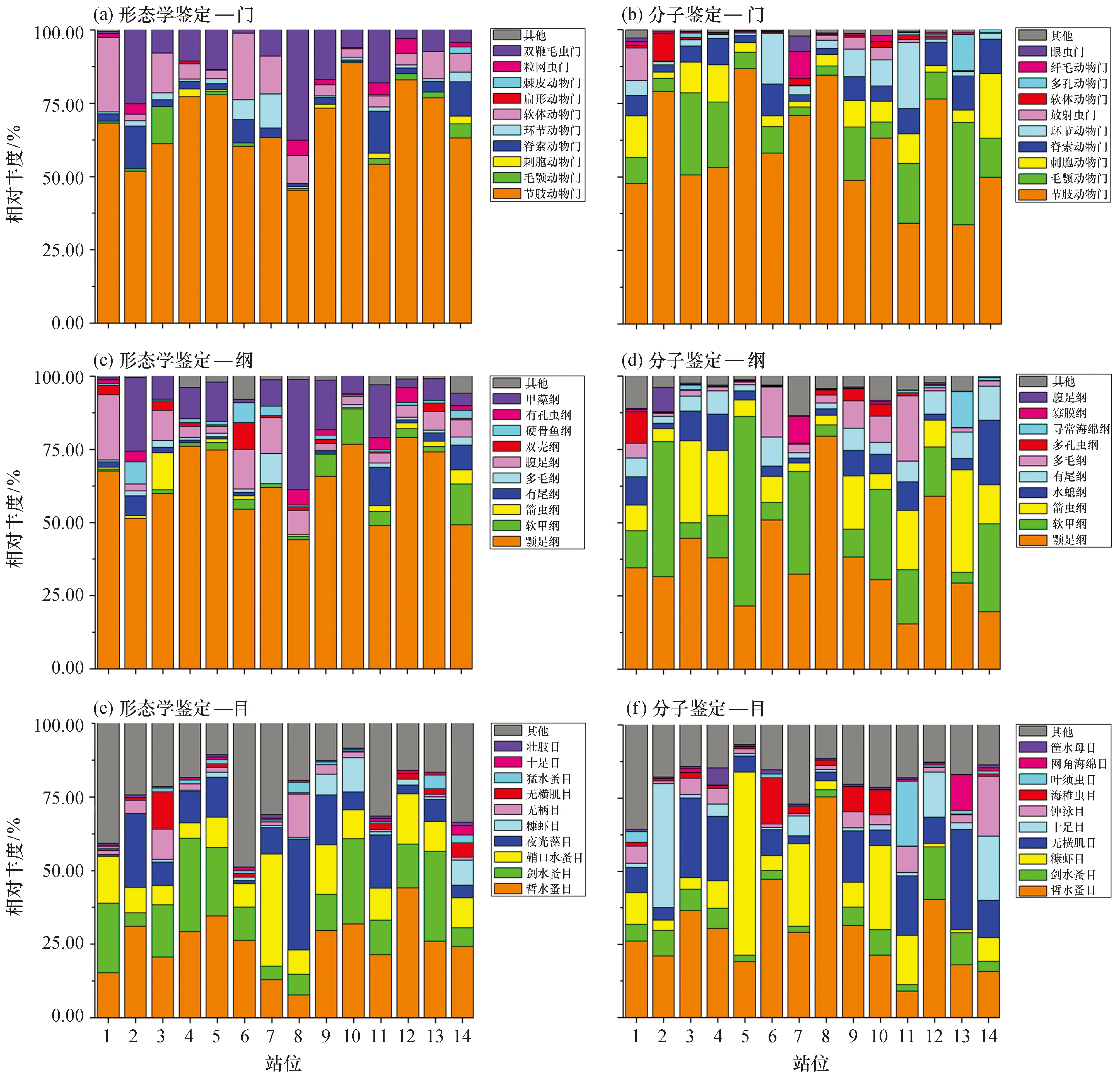
圖1 浮游動物樣本在各分類水平上相對豐度前10的物種及其占比Fig.1 Species and their proportion of the top 10 species with relative abundance of taxa in zooplankton samples.
對形態學鑒定和分子鑒定中相對豐度前10中的共有分類水平 (門、綱、目)進行比較,除刺胞動物門外 (r=0.696,p=0.006),各分類水平的相對豐度在各取樣站位上并無顯著相關性,但所有站位的平均相對豐度在門以及綱水平上呈現出顯著的相關性,在目水平上無顯著相關性 (表2)。
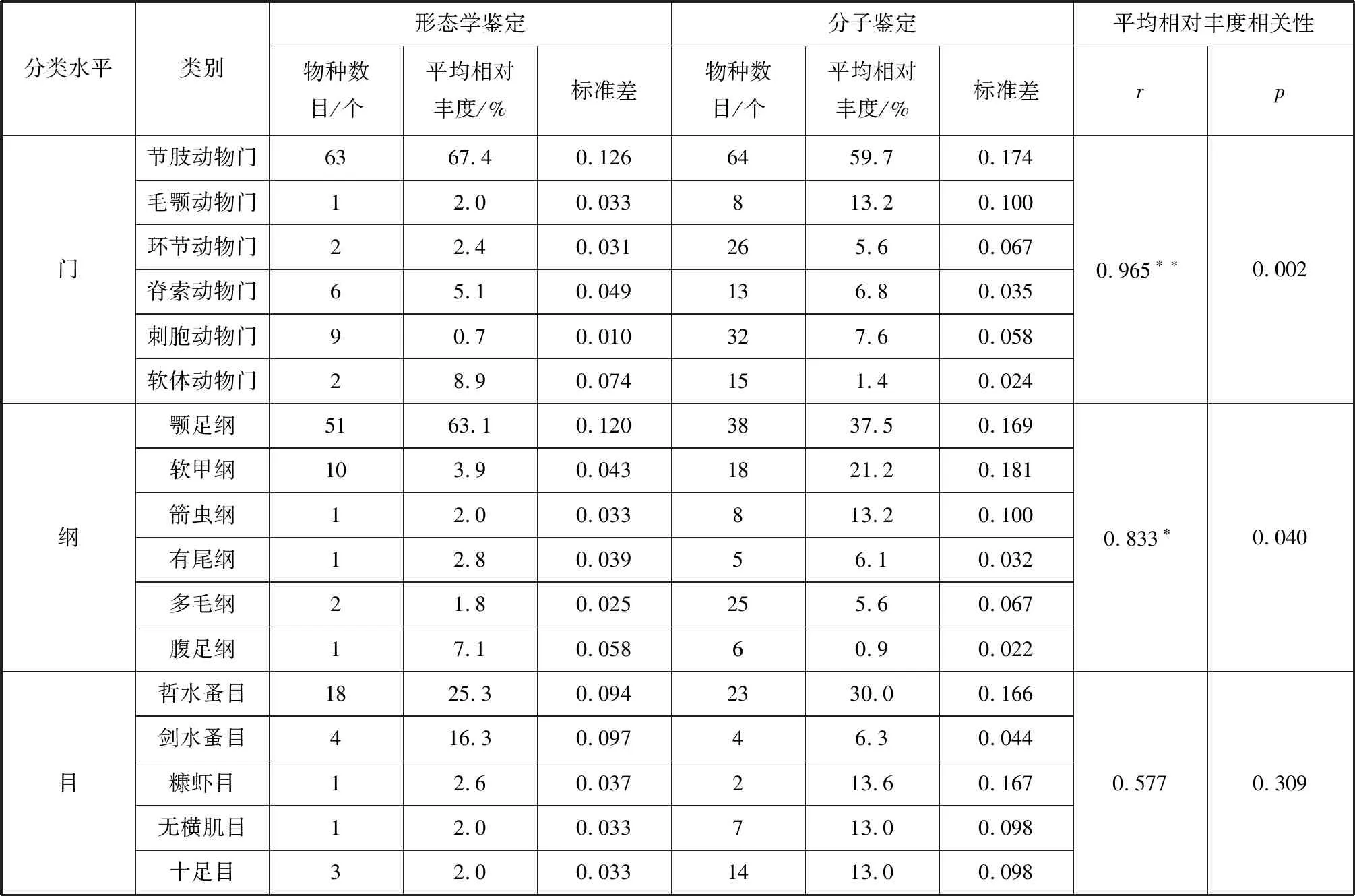
表2 形態學和分子鑒定各分類水平上相對豐度前10類別中共有類別的物種數目及平均相對豐度相關性分析Tab.2 Species number and correlation analysis of averaged relative abundance in the top 10 groups of the most abundance shared by results of morphological and molecular methods
2.2 浮游動物優勢種
根據每個物種的優勢度確定西沙群島調查海域的浮游動物優勢種 (表3),形態學鑒定在調查島礁區域發現夜光蟲、小紡錘水蚤、羽長腹劍水蚤 (Oithonaplumifera)、小擬哲水蚤 (Paracalanusparvus)、麗隆劍水蚤 (Oncaeavenusta)、孔雀麗哲水蚤 (Calocalanuspavo)6個主要優勢種;分子鑒定獲得糠蝦、肥胖軟箭蟲、長尾紡錘水蚤 (Acartialongiremis)、泳球水母 (Sphaeronecteshaddocki)、酋婦蟹 (Eriphiidaesp.)、赫氏巨囊蟲 (Megalocercushuxleyi)、孔雀麗哲水蚤、武平頭水蚤 (Candaciaarmata)、長腹劍水蚤 (Oithonasp.)及兩種哲水蚤 (Uncultured Calanoida)共11個優勢種。其中,兩種哲水蚤僅鑒定至目,酋婦蟹和長腹劍水蚤僅鑒定至屬。形態學鑒定與分子鑒定優勢種中均含有孔雀麗哲水蚤。此外,不同調查島嶼的優勢種種類也存在差異。
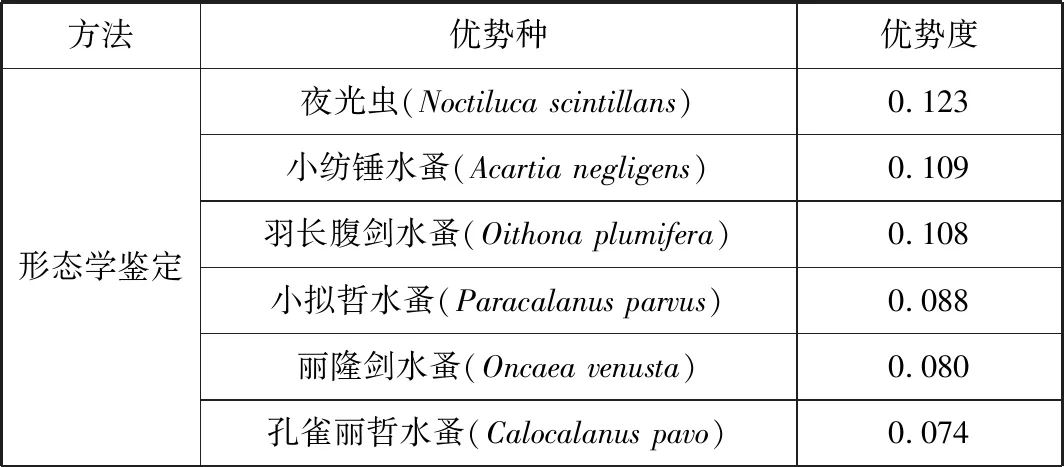
表3 兩種方法鑒定14個站位浮游動物優勢種Tab.3 Dominant zooplankton species identified by two methods in 14 stations
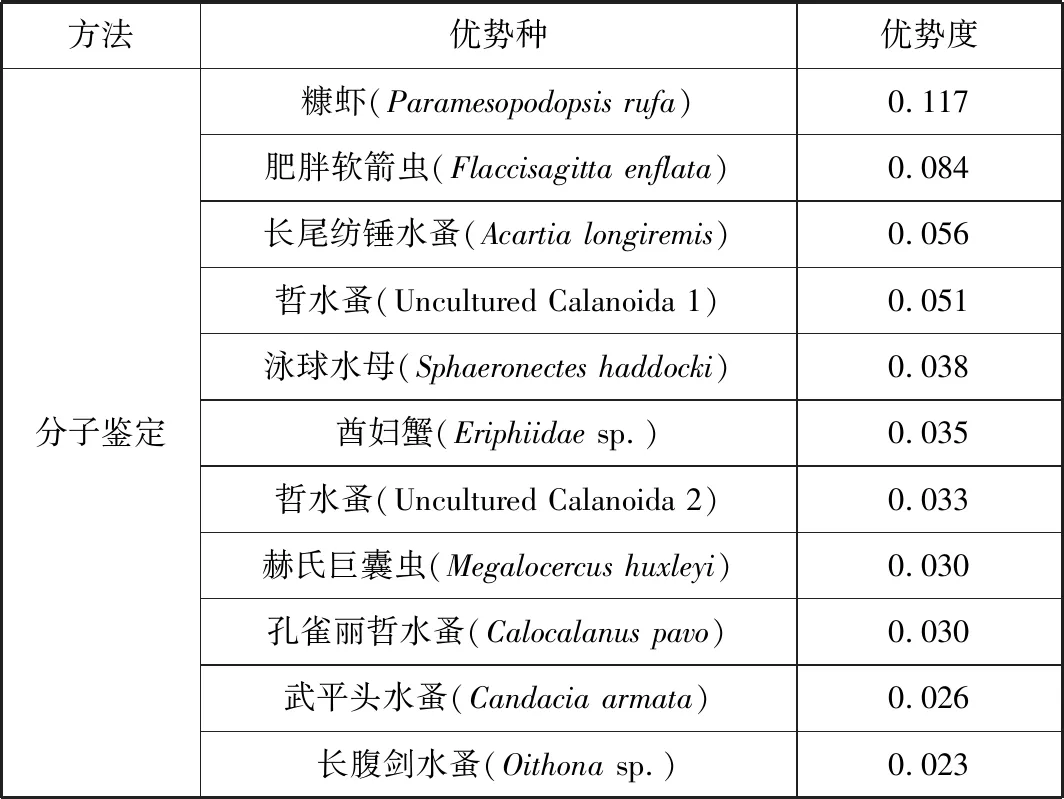
續表
2.3 物種多樣性指數
形態學鑒定和分子鑒定結果的物種多樣性指數如表4,宏條形碼技術作為一種半定量鑒定方法,無法獲得準確的個體密度,因此僅對兩種方法獲得的d、H′、D和J值進行比較。除站位14外,各站位基于分子鑒定的d值均高于基于形態學特征鑒定的結果。大部分站位 (71.4%)基于分子鑒定得到的H′值也均高于形態學鑒定的結果,但兩者差異較小,只有少數站位(1、5、10及11)的H′值在兩種鑒定方法之間存在較大的差異。除少數站位(1、5及8)外,大部分站位基于形態學鑒定獲得的D值與分子鑒定的結果均較為接近,兩種方法的平均D值差異性在3種多樣性指數中最小。所有站位上基于形態學鑒定的J值均高于分子鑒定,且兩者之間存在較大的差異,形態學鑒定的平均J值是分子鑒定的1.57倍。
在一致性方面,當關注所有站位時,基于兩種鑒定方法獲得的α多樣性指數均無顯著的一致性 (表4)。但當排除差異較大的少數站位 (1、5、10、14)后,差異較小的多數站位 (71.4%)中基于分子鑒定與基于形態學鑒定獲得的H′值 (r=0.802,p=0.005)、D值 (r=0.759,p=0.011)及J值 (r=0.664,p=0.036)均呈現出顯著的一致性。
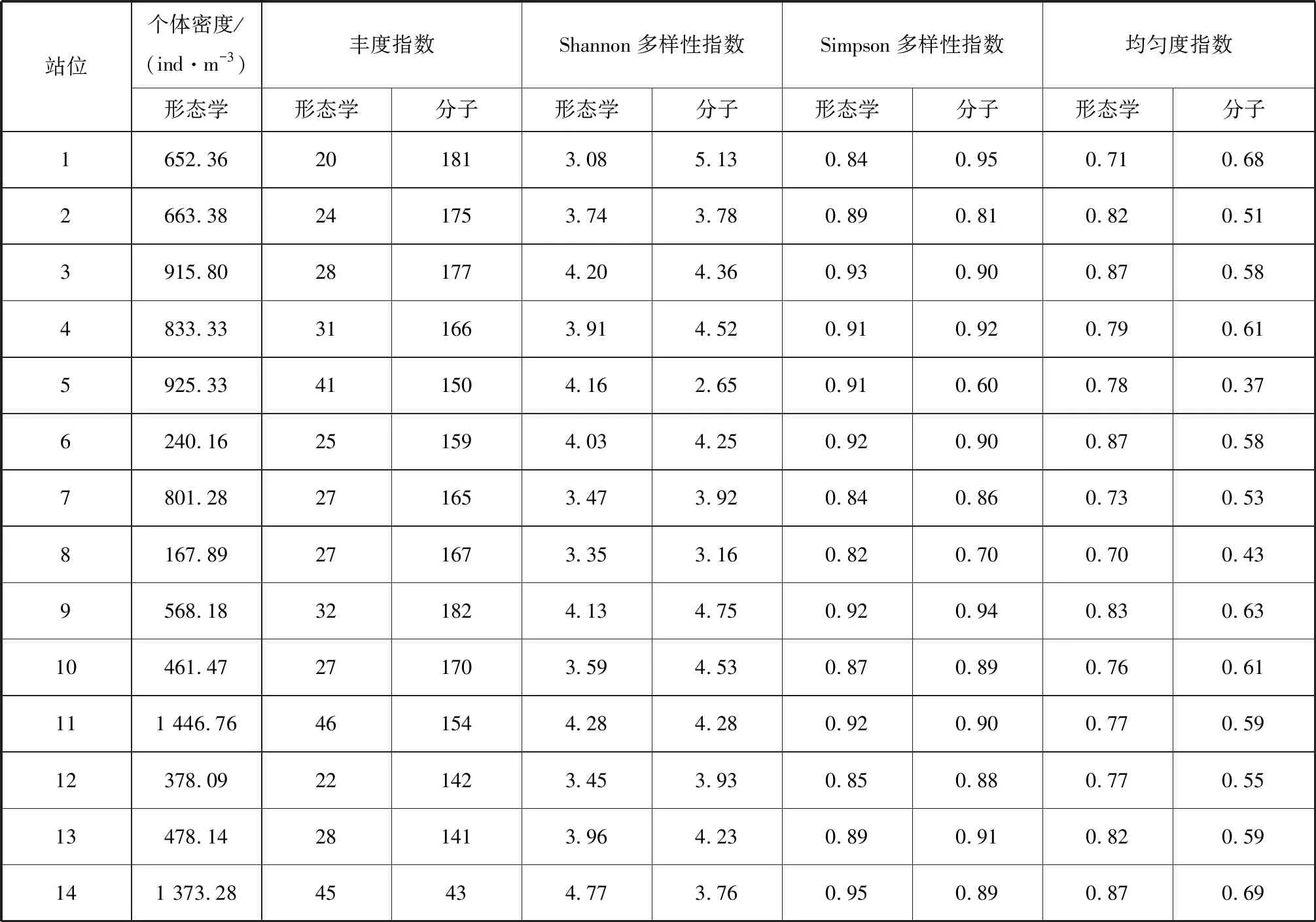
表4 形態學鑒定和分子鑒定的浮游動物個體密度和α多樣性指數Tab.4 Species densities and α diversity indexes by morphological and molecular identification
2.4 特殊浮游動物的宏條形碼技術鑒定
基于長棘海星暴發對珊瑚礁生態系統的危害性,本研究對西沙群島的調查重點關注各采樣站位中長棘海星的分布及豐度。形態學鑒定中僅在11號站位中發現海星羽腕幼體,但無法進一步確定是否為長棘海星。而在分子鑒定中出現注釋為長棘海星的OTUs,共66個,占全部OTU數量的0.8‰,主要分布于站位4 (中島),在其他5個調查站位 (3、7、8、9、10)也有少量出現 (OTU數量<10)。
在極微小生物的檢測中,宏條形碼技術也表現出明顯的優勢,檢測出48種原生動物OTUs,分別屬于8門,16綱,23目,而形態學鑒定僅檢測出夜光蟲及有孔蟲兩種原生動物。
2.5 討論
2.5.1 浮游動物多樣性 本研究通過形態學鑒定和基于18S V9的分子鑒定兩種方法,對比研究了西沙群島調查海域的浮游動物多樣性,研究結果發現本次調查海域浮游動物主要種類包括橈足類、軟甲綱和箭蟲綱,這3個類別的物種在兩種鑒定方法中均具有較高的相對豐度。此外,形態學鑒定中原生動物夜光蟲 (12.30%)的相對豐度最高,而分子鑒定的軟甲綱動物糠蝦 (11.75%)最高。形態學鑒定與分子鑒定獲得的大部分優勢種均為橈足類,這與其他西沙群島浮游動物多樣性調查結果一致[1,40]。其中形態學鑒定和分子鑒定共同檢出孔雀麗哲水蚤,分子鑒定獲得的優勢種中含有兩種未鑒定至種的哲水蚤,可能包含在形態學方法鑒定出的優勢種之中。由于采樣島嶼之間距離較遠,不同調查站位的優勢種種類存在差異;不同方法鑒定出的各站位優勢種也存在差異,可能是實驗過程中樣本分配或擴增過程中產生的誤差所致[41]。不同站位的浮游動物豐度具有差異性,一般礁盤外沿浮游動物豐度較高,而潟湖區域由于無珊瑚礁覆蓋,生態系統較為簡單,浮游動物豐度相對較低。其中,玉琢礁附近海域浮游動物豐度最高,西沙洲潟湖豐度最低。各站位浮游動物平均密度為707.53 ind/m3,總體上調查海域浮游動物豐度較低,符合熱帶珊瑚礁海域寡營養鹽的生境特征。
2.5.2 長棘海星分布與豐度 近年來長棘海星的暴發對珊瑚礁生態系統造成巨大威脅,李元超等 (2019)通過對2005—2019年間西沙群島主要島礁的珊瑚礁生態系統進行監測,認為西沙群島海域長棘海星的暴發頻率為每15年1次,目前正進入下一個長棘海星暴發周期,為避免珊瑚礁生態系統遭受嚴重破壞,應對長棘海星種群動態進行監控和預測,及時采取措施積極應對[42]。本次對西沙島礁浮游動物樣品的形態學鑒定中僅在玉琢礁樣本中發現海星羽腕幼體,且無法進一步確定是否為長棘海星,但利用宏條形碼技術發現長棘海星在七連嶼海域北島、中島、趙述島、西沙洲均有檢測到,主要集中在中島,雖然OTU數目較少 (僅占全部OTU數量的0.8‰),但仍對該區域珊瑚礁生態系統具有較大的威脅。
2.5.3 兩種鑒定方法比較 傳統的形態學鑒定方法耗時長、效率低,且需要專業的分類學背景。而DNA 宏條形碼技術通過高通量測序和數據庫比對,可實現大規模樣本的批量鑒定,能夠全面、快速評估物種多樣性,目前已廣泛用于多種生態系統中浮游動物多樣性的鑒定[13-14,43-44]。在大多數情況下,使用宏條形碼鑒定方法獲得的特定分類群物種的相對豐度與形態學鑒定結果呈現顯著相關性[6,14],本研究中使用兩種方法對西沙群島浮游動物多樣性進行鑒定時,相對豐度最高的類別均為橈足類,大部分優勢種類均為哲水蚤目,且在對兩種鑒定結果進行α多樣性指數分析時,分子鑒定的H′、D、J值在大部分站位與形態學鑒定結果呈現出顯著相關性。研究結果表明,宏條形碼技術的鑒定結果與傳統形態學等鑒定方法有較強的一致性,前者有希望成為浮游動物物種多樣性鑒定的高通量方法。
2.5.4 宏條形碼技術在浮游動物多樣性鑒定中的優勢 由于海洋生物物種數量龐大、樣品保存條件限制等,精確分類對海洋生物分類學家的分類鑒定水平具有很高要求。宏條形碼技術對觀察者的依賴性較小,使不同研究組產生的數據集之間的比較更為準確。雖然目前的參考數據庫仍不完整,但也隨時可以根據更新的參考數據庫快速進行重新鑒定,這一優勢在海洋生物多樣性的長期監測中或年際變化研究中具有良好的應用前景[21,39]。使用宏條形碼技術還可檢測出相對豐度極低或傳統形態學鑒定無法檢出或精確分類的物種,如本研究中長棘海星在分子鑒定中檢測到,而顯微鏡下經形態學鑒定僅能分類至海星羽腕幼體,無法確定是否為長棘海星,表明宏條形碼在生物入侵[16,22]或相對豐度極低的物種如暗礁隱秘物種[45]的檢測上也具有巨大的應用潛力。同時極微小生物如大部分原生生物在顯微鏡檢時可能會被忽略,造成多樣性的低估,而基于宏條形碼分析的分子鑒定則能夠有效避免這一問題。
2.5.5 宏條形碼技術在浮游動物鑒定中的問題及優化方案 宏條形碼對物種的精確鑒定依賴于引物的精心設計,18S V9引物物種覆蓋度更高,但物種識別敏感性較差[17],難以識別至種水平,本研究中僅有47.21%的浮游動物OTUs注釋至種水平,優勢種中還存在兩種僅注釋至目水平,表明18S V9引物在浮游動物物種水平多樣性監測上仍存在一些限制。目前常用于浮游動物多樣性鑒定的另一基因——線粒體細胞色素C氧化酶Ⅰ (cytochrome c oxidase Ⅰ,COⅠ)則專門針對后生浮游動物設計[46],在浮游動物中具有更高的物種分辨率,但由于該基因在物種間具有較大的序列變異,因此難以在更廣的分類單元上設計出適合的通用引物[47-48],極大限制了其在浮游動物宏條形碼鑒定中的應用。退化COⅠ引物、多標記、多引物對的使用可顯著提高物種多樣性鑒定的準確性[49]。除引物外,在基于閾值和聚類的方法中,閾值的選擇也會顯著影響物種識別的準確性,并導致對生物多樣性的低估或高估[13,50];數據庫的不完整也極大地限制了宏條形碼鑒定的應用,本研究中分子鑒定獲得的少數高豐度OTU序列以及部分豐度較低的序列在數據庫中并無覆蓋度和相似度滿足要求的注釋物種,或在數據庫中僅以未鑒定或未分類真核生物樣本形式存在,極大地降低了對浮游動物多樣性檢測結果的準確性。通過構建本地DNA條形碼數據庫,對通用數據庫進行補充,則可有效緩解這一限制[10,43]。其他可能導致鑒定結果產生假陰性 (樣本中存在物種但未檢測到)和假陽性 (物種被檢測但不存在)的技術限制也在不斷進行探究與優化,如優化DNA提取[51]和PCR擴增方法[46]、采用PCRfree建庫處理擴增錯誤和測序偽影[52]、開發高質量的參考序列數據庫、選擇合適的生物信息學步驟來適應物種間可變的序列差異閾值[50]以及改進現有軟件或開發新軟件等。
盡管宏條形碼分析對物種水平以上的分類群相對豐度的量化已被證明與形態學分析相吻合,但與形態學分析中的物種豐度數據并沒有很好的一致性,在多拷貝基因問題解決之前,宏條形碼仍是生物多樣性分析的半定量方法[42,53]。群落生物多樣性分析中分類群的豐度或相對豐度仍需進行準確量化,以便對群落特征和許多生物學指標進行評估,且由于宏條形碼技術無法反應生物的生長階段,目前浮游動物多樣性監測仍以形態學鑒定為主。而宏條形碼技術效率高、成本低且能夠有效彌補形態學鑒定法的某些缺陷,隨著該技術的不斷發展完善,在未來有望成為一種補充甚至替代現有物種多樣性評估的技術體系。
3 結論
本研究通過形態學方法和基于18S V9測序的宏條形碼技術,對西沙群島14個調查站位的浮游動物樣本生物多樣性進行鑒定。結果表明,此次調查海域浮游動物樣本主要種類包括橈足類、軟甲綱和箭蟲綱,這3個類別的物種在兩種鑒定方法中均具有較高的相對豐度。由于調查站位距離較遠,各站位浮游動物物種豐度、組成及優勢種存在差異,總體符合熱帶珊瑚礁海域的生境特征。與形態學鑒定相比,基于18S V9測序的宏條形碼技術鑒定具有更高的物種覆蓋度,且代表性類群的相對豐度和多樣性指數在大部分站位與形態學鑒定結果呈現出顯著相關性,表明宏條形碼技術在我國海洋浮游動物物種多樣性評估中具有較好的應用前景。

