基于溶藻弧菌感染的合浦珠母貝轉錄組數據分析IAP蛋白家族的表達變化
蔣美君鐘方杰喻達輝張斌嚴雪瑜
(1.廣西北部灣海洋生物多樣性養護重點實驗室/北部灣大學海洋學院,廣西 欽州 535011;2.欽州市水產技術推廣站,廣西 欽州 535099)
合浦珠母貝(Pinctada fucata)又稱馬氏珠母貝,是中國南海海域主要培育的海水珍珠貝,在我國海水養殖業中占有重要地位[1]。近年來,隨著珍珠養殖規模不斷擴大,種質資源退化和病害問題日趨嚴重,海水珍珠產量和質量明顯下降,嚴重威脅我國海水珍珠產業的持續健康發展[2]。合浦珠母貝僅具備非特異性免疫系統,極易被病原體和微生物侵染[3],提高合浦珠母貝自身免疫防御機制研究是如今重要的發展方向[4,5]。
溶藻弧菌(Vibrio alginolyticus)是一種嗜鹽性革蘭氏陰性短桿菌,主要生長在海洋或出海口,數量位于海水類弧菌之首,易引起魚、蝦、貝等海洋生物爆發流行性疾病[6,7]。已有研究發現,溶藻弧菌給石斑魚(Epinephelus coioides)[8]、凡納濱對蝦(Litopenaeus vannamei)[9]、近江牡蠣(Ostrea rivularis Gould)[10]等養殖產業造成了嚴重的經濟損失。Wang等[11]利用轉錄組測序技術分析合浦珠母貝響應溶藻弧菌感染的免疫機制,發現有636個差異表達基因響應了弧菌攻擊,這些基因主要參與了絲裂原活化蛋白激酶信號通路(MAPK signaling pathway)、趨化因子信號通路(chemokine signaling pathway)、細胞凋亡(Apoptosis)和Wnt信號通路(Wnt signaling pathway)等免疫相關信號通路。本研究通過利用轉錄組測序技術開展合浦珠母貝在溶藻弧菌早期感染下的分子免疫調控機制研究,并篩選出凋亡抑制因子(inhibitor of apoptosis proteins,IAPs)蛋白家族中的幾個關鍵差異表達基因進行基因表達變化分析,以期尋找和探索合浦珠母貝先天免疫調控機制的關鍵候選基因,為提高合浦珠母貝的非特異性免疫能力和培育具有優良性狀的新品種提供理論基礎[12]。
1 材料與方法
1.1 試驗材料
試驗用的1齡健康合浦珠母貝來源于廣西北海的珍珠貝養殖場,在實驗室條件下暫養7d后進行溶藻弧菌感染試驗。在暫養和試驗期間,每天定時投喂藻類。
1.2 試驗方法
1.2.1 溶藻弧菌懸液制備
將凍存的溶藻弧菌用牛肉膏蛋白胨固體培養基進行劃線分離活化2次,取活化的溶藻弧菌接種于牛肉膏蛋白胨液體培養基中,在28℃下200r·min-1振蕩過夜培養,1600r·min-1離心10min后棄上清液,重新懸浮于PBS溶液,并配制成濃度為4.0 OD的具有活性的溶藻弧菌懸液,4℃保存備用。
1.2.2 溶藻弧菌感染試驗及轉錄組測序
將合浦珠母貝用氯化鎂溶液進行麻醉開殼后,于閉殼肌注射100μL制備好的弧菌懸液;采集注射前0h和注射后6h和24h的合浦珠母貝肝胰腺組織樣品,每組各采集6個貝,所采集的組織樣品置于液氮中凍存后置于-80℃冰箱中待用。
1.2.3 轉錄組測序及IAP蛋白家族基因表達分析
將合浦珠母貝肝胰腺組織樣品在干冰保存的條件下送至中國上海美吉生物技術公司進行cDNA文庫構建和mRNA測序;再對轉錄組測序獲得的IAP蛋白家族中的基因按照p-adjust<0.001和|log2FC|≥1的標準進行差異表達分析,并利用KEGG(Kyoto Encyclopedia of Genes and Genomes)數據庫對差異表達基因進行功能注釋。
2 結果與分析
2.1 合浦珠母貝BIRC2基因在溶藻弧菌感染下的表達變化
轉錄組結果顯示,在感染溶藻弧菌后6h時,合浦珠母貝BIRC2基因的表達量顯著上升(P<0.05);而在24h時表達量下降,但仍顯著高于感染前(0h)的表達量(P<0.05),結果如圖1所示。基因功能分析結果顯示,BIRC2基因富集到了KEGG中的NOD樣受體信號通路(NOD-like receptor signaling pathway)、Toll和IMD信號通路(Toll and Imd signaling pathway)以及弓形蟲病(Toxoplasmosis)等信號通路。
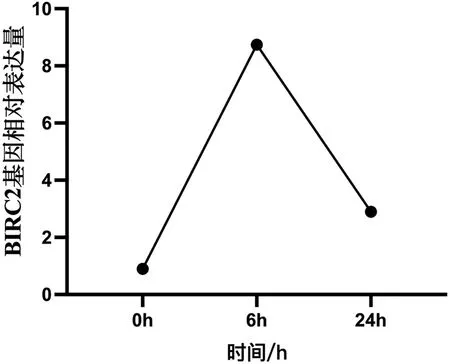
圖1 合浦珠母貝BIRC2基因在感染溶藻弧菌不同時間中的表達變化
2.2 合浦珠母貝BIRC3基因在溶藻弧菌感染下的表達變化
如圖2所示,在感染溶藻弧菌后6h時,合浦珠母貝BIRC3基因的表達量急劇上升,并顯著高于感染前0h和感染后24h(P<0.05),而24h與0h的基因表達量差異不顯著(P>0.05)。基因功能分析結果發現,BIRC3基因也富集到了NOD樣受體信號通路(NOD-like receptor signaling pathway)、Toll和IMD信號通路(Toll and Imd signaling pathway)以及弓形蟲病(Toxoplasmosis)等信號通路中。

圖2 合浦珠母貝BIRC3基因在感染溶藻弧菌不同時間中的表達變化
2.3 合浦珠母貝BIRC4基因在溶藻弧菌感染下的表達變化
如圖3所示,在感染溶藻弧菌后6h時,合浦珠母貝BIRC4基因的表達量較感染前(0h)有所增加,但與0h的表達量差異不顯著(P>0.05);而在24h時,BIRC4基因的表達量明顯下降,并顯著低于6h(P<0.05),但與0h的表達量差異不顯著(P>0.05)。基因功能分析結果發現,BIRC4基因被富集到了泛素介導的蛋白質水解(Ubiquitin mediated proteolysis)信號通路中。

圖3 合浦珠母貝BIRC4基因在感染溶藻弧菌不同時間中的表達變化
2.4 合浦珠母貝BIRC7基因在溶藻弧菌感染下的表達變化
基因表達結果顯示,在感染溶藻弧菌后6h時,合浦珠母貝BIRC7基因的表達量增加,并顯著高于感染前0h和感染后24h(P<0.05);而24h與0h的基因表達量差異不顯著(P>0.05),結果如圖4所示。基因功能分析結果顯示,BIRC7基因被富集到了弓形蟲病信號通路中。
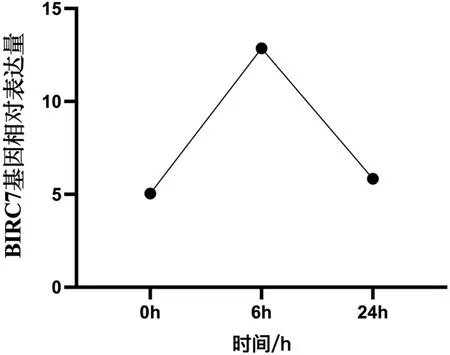
圖4 合浦珠母貝BIRC7基因在感染溶藻弧菌不同時間中的表達變化
3 討論
凋亡抑制因子(inhibitor of apoptosis proteins,IAPs)是一類具有抑制由病毒感染引起的細胞凋亡作用的內源性蛋白,大多數IAPs含有桿狀病毒IAP重復區域(baculoviral IAP repeat containing,BIRC)[13]。1993年Crook等首先在桿狀病毒CpGV和核多角體病毒OPMNPV中發現IAP家族[14],隨后的研究發現人類細胞中存在7種IAPs,包括NAIP(BIRC1)、cIAP1(BIRC2)、cIAP2(BIRC3)、XIAP(BIRC4)、Survivin(BIRC5)、Apollon(BIRC6)和Livin(BIRC7)[15]。目前已在池蝶蚌(Hyriopsis schlegeli)[16]、太平洋牡蠣(Crassostrea gigas)[17]和中華絨螯蟹(Eriocheir sinensis)[18]組織中發現IAP分子能夠抑制細胞凋亡。苗國英等[19]使用脂多糖(Lipopolysaccharide,LPS)模擬細菌感染對櫛孔扇貝(Chlamys farreri)進行刺激,發現CfIAP-1和CfIAP-1基因表達量在0~12h沒有明顯變化,在24h迅速上升達到最高點,到48h開始下降,72h恢復到正常水平,整體呈現先升高后下降的趨勢。Zhang等[20]利用鰻弧菌(Vibrio anguillarum)對太平洋牡蠣進行刺激,發現IAP基因表達量在0~12h逐漸升高,在12h時達到最高水平,然后從12~48h逐漸下降,也呈現出先升高后下降的趨勢。
本研究共發現有4個IAP蛋白家族的基因在合浦珠母貝感染溶藻弧菌后表達變化顯著,這4個基因的表達量均在感染期間(0~24h)呈現先升后降的趨勢,結果與上述研究結果基本一致。其中,合浦珠母貝的BIRC2、BIRC3和BIRC7基因在感染6h時表達顯著上調,并均與0h和24h差異顯著(P<0.05);BIRC4基因的表達量也在感染6h時明顯增加,并顯著高于感染24h時的表達量(P<0.05),但與0h的表達量差異不顯著(P>0.05)。通過基因功能分析發現,BIRC2、BIRC3基因富集到了KEGG中的NOD樣受體信號通路、Toll和IMD信號通路以及弓形蟲病等通路中;而BIRC4基因則富集到了泛素介導的蛋白質水解信號通路中,BIRC7基因富集到了弓形蟲病信號通路中。
綜上所述,本研究通過利用溶藻弧菌感染合浦珠母貝的轉錄組數據分析了IAP蛋白家族的基因表達變化,發現BIRC2、BIRC3、BIRC4和BIRC7基因的表達量發生顯著變化,并發現這些基因被富集到了一些免疫相關的信號通路中,表明IAP參與了合浦珠母貝的免疫應答反應過程,提示其在貝類非特異性免疫調節中發揮著重要作用。

