腌制葉用芥菜發(fā)酵菌分離鑒定及應用研究
胡丹丹 吳祖芳 孫志棟,* 陳山喬 翁佩芳
(1 寧波大學食品與藥學學院,浙江 寧波 315800;2 寧波市農業(yè)科學研究院,浙江 寧波 315040)
葉用芥菜(leaf mustard,BrassicajunceaCoss var. foliosa Bailey)簡稱葉芥菜,屬于十字花科蕓薹屬作物,是世界上重要的蔬菜作物及調料作物[1]。葉用芥菜原產于我國,為我國長江流域普遍栽培的腌制蔬菜,是芥菜中適應性較強的一個變種,類型和品種豐富,有大葉芥菜(var.rugosaBailey)、花葉芥菜(var.multisectaBailey)、雪里蕻(var.multicepsT sen et Lee)、莖瘤芥(var.tumidaT sen et Lee)和包心芥菜(var.capitataHart ex Li)等多種類型[2]。葉用芥菜作為人們日常食用的新鮮蔬菜,因其水分活度高而容易腐敗,難以貯藏,通過鹽漬加工成咸菜或酸菜是葉用芥菜常用的貯藏方式。我國大部分地區(qū)采用的傳統自然發(fā)酵方法,存在發(fā)酵時間長、蔬菜含鹽量高、亞硝酸鹽累積量大、質地軟等缺點[3]。研究表明,通過人工接種發(fā)酵劑的方式可以降低發(fā)酵蔬菜中亞硝酸鹽含量、縮短發(fā)酵時間并改善蔬菜口感[4]。
發(fā)酵菌是食品在發(fā)酵過程中所應用的微生物,目前應用于蔬菜發(fā)酵的主要是乳酸菌。乳酸菌代謝糖類產生有機酸如乳酸,分解蛋白質產生肽類和氨基酸,是發(fā)酵蔬菜的有益微生物。Won等[5]從韓國泡菜中分離出的清酒乳桿菌ADM14菌株可顯著降低前脂肪細胞3T3-L1內甘油三酯含量,對酸和膽鹽也有良好的耐受性,具有作為益生菌和替代治療性補充劑的潛力。Chi等[6]從135株乳酸菌中篩選低鹽泡菜發(fā)酵劑并應用到泡菜中,表明應用發(fā)酵劑發(fā)酵能夠加速風味形成并縮短泡菜的成熟期。據報道,從發(fā)酵食品(如腌菜)中分離出的乳酸菌對健康有多種益處,包括預防便秘、結腸炎、肝損傷和糖尿病等[7-10]。從已有的研究成果來看,腌制蔬菜中人工接種所用到的發(fā)酵劑多見于乳酸菌,而酵母菌則能產醇產酯并有利于風味的形成,如唐紅梅等[11]從川南腌菜中篩選出4株耐鹽、產香能力強的酵母菌株。我國有學者對發(fā)酵蔬菜的微生物生態(tài)研究表明,乳酸菌和酵母菌是發(fā)酵蔬菜中的優(yōu)勢菌群[12]。葉用芥菜在腌制過程中,乳酸菌和酵母菌混合使用則較少,同時因地域、原材料等限制,微生物菌群也表現出復雜多樣性。
本研究從自然發(fā)酵的葉用芥菜中分離篩選、鑒定乳酸菌和酵母菌,研究其特性,以期為腌制蔬菜發(fā)酵菌劑的開發(fā)應用奠定理論基礎,為實現腌制蔬菜的加工和增值提供技術支撐。
1 材料與方法
1.1 材料與試劑
腌制葉用芥菜,購自浙江省寧波市鄞州區(qū)新紫云堂公司。
乳酸細菌培養(yǎng)基(DeMan Rogosa and Sharpe agar,MRS)以及肉湯、孟加拉紅培養(yǎng)基、改良馬丁培養(yǎng)基,杭州微生物試劑有限公司;脫脂奶粉、氯化鈉、氫氧化鈉、鹽酸、酚酞均為分析純,國藥集團化學試劑有限公司;乳酸菌DNA提取試劑盒、酵母菌DNA提取試劑盒、通用引物乳酸菌正向引物27f:5′-A G A G T T T G A T C C T G G C T C AG-3′與反向引物1492r:5′-A A G G A G G T G A T C C A G CC-3′、通用引物酵母菌正向引物ITS1:5′-T C C G T A G G T G A A C C T G C GG-3′與反向引物ITS4:5′-T C C T C C G C T T A T T G A T A T GC-3′,生工生物工程(上海)股份有限公司;食鹽,購于華潤萬家超市。
1.2 主要儀器與設備
SW-CJ-2D型雙人單面凈化工作臺,蘇州凈化設備有限公司;PHS-3C型pH計,上海圣科儀器設備有限公司;Spectramax190型全波長酶標儀,美國美谷分子儀器(Molecular Devices)有限公司;5804R型高速大容量冷凍離心機,德國Eppendorf公司;LD2F-50L-II型立式高壓蒸汽滅菌器,上海申安醫(yī)療器械廠;JYL-C19V九陽多功能攪拌機,佛山市秋實電器有限公司;腌制桶,購于寧波邱隘市場。
1.3 試驗方法
1.3.1 發(fā)酵菌的分離純化 采用梯度稀釋涂布法對腌制芥菜中的乳酸菌、酵母菌進行分離篩選。取25 mL腌制芥菜汁加入225 mL生理鹽水中,振蕩搖勻,并逐級稀釋至10-1~10-6CFU·mL-1。乳酸菌:分別吸取0.1 mL涂布于含2%碳酸鈣的MRS固體培養(yǎng)基中,37℃培養(yǎng)48 h,挑取溶鈣圈大的菌落。酵母菌:分別吸取0.1 mL涂布于孟加拉紅培養(yǎng)基,28℃培養(yǎng)48~72 h,挑取典型的酵母菌菌落。對挑取的所有菌落反復分離純化,直至得到純菌落,進行斜面保藏并編號備用。
1.3.2 發(fā)酵菌的篩選
1.3.2.1 乳酸菌 生長曲線測定:將活化好的菌株按1%的接種量分別接入滅菌的MRS液體培養(yǎng)基中,37℃培養(yǎng)24 h,從0 h開始取樣,以未接種的MRS液體培養(yǎng)基作為空白對照,每隔2 h測一次波長600 nm下的吸光度值(optical density, OD),每個樣品重復3次,觀察各菌株的OD值隨發(fā)酵時間的變化。
產酸性能測定:將活化好的菌株按1%的接種量分別接入滅菌的MRS液體培養(yǎng)基中,37℃培養(yǎng)24 h,從0 h開始取樣,以未接種的MRS液體培養(yǎng)基作為空白對照,每隔4 h測一次pH值,每個樣品重復3次,觀察各菌株的pH值隨發(fā)酵時間的變化。
亞硝酸鹽降解率測定:亞硝酸鹽降解率參照劉芳等[13]的方法(溫度修改為37℃),根據鹽酸萘乙二胺法[14]測定亞硝酸鹽含量,計算亞硝酸鹽降解率:亞硝酸鹽降解率=(亞硝酸鹽原含量-降解后亞硝酸鹽含量)/亞硝酸鹽原含量×100%。
1.3.2.2 酵母菌 產氣能力檢測:吸取1%酵母菌的新鮮培養(yǎng)物加入含有杜氏小導管的豆芽汁液體培養(yǎng)基中,每隔12 h觀察杜氏小導管產氣情況,對酵母菌的產氣能力進行初步判斷,進一步篩選出性狀良好的優(yōu)良菌株。
蛋白酶活性檢測:將根據產氣能力篩選出的酵母菌菌株進行活化,按照1%的接種量均勻涂布于蛋白酶檢測固體培養(yǎng)基中,放置于28℃培養(yǎng)箱培養(yǎng)48 h, 觀察菌落周圍是否出現透明環(huán),有透明環(huán)表明該菌株具有蛋白酶活性。
產酯測定:將具有蛋白酶活性菌株按照1%的接種量加入豆芽汁培養(yǎng)基中,放置于28℃搖床中培養(yǎng)48 h 后,采用回流皂化方法[15]測定培養(yǎng)液中的總酯含量。
1.3.3 發(fā)酵菌的微觀形態(tài)學鑒定 根據發(fā)酵性能篩選出的優(yōu)勢乳酸菌和酵母菌進行增菌處理,吸取1 mL菌液于1.5 mL離心管中,以3 500 r·min-1離心3 min, 用生理鹽水沖洗2~3遍并再次離心,最后用2.5%的戊二醛進行固定,于浙江大學測試中心進行掃描電鏡和透射電鏡成像。
1.3.4 發(fā)酵菌分子生物學鑒定 根據發(fā)酵性能篩選出的優(yōu)勢乳酸菌和酵母菌通過試劑盒進行總DNA提取后,以細菌通用引物對乳酸菌進行16SrDNA擴增,其正向引物27f:5′-A G A G T T T G A T C C T G G C T C AG-3′;反向引物1492r:5′-A A G G A G G T G A T C C A G CC-3′。以真菌通用引物對酵母菌進行18SrDNA擴增,其正向引物 ITS1:5′-T C C G T A G G T G A A C C T G C GG-3′;反向引物ITS4:5′-T C C T C C G C T T A T T G A T A T GC-3′。
PCR擴增體系:乳酸菌:2×EasyTaq PCR Super Mix 25 μL,上下游引物各1 μL,模板DNA 2 μL,ddH2O補至50 μL。酵母菌:2×EasyTaq PCR Super Mix 25 μL,上下游引物各2.5 μL,模板DNA 2 μL,ddH2O補至50 μL。
PCR擴增條件:乳酸菌:94℃預變性5 min;94℃變性30 s,54℃退火30 s,72℃延伸90 s,循環(huán)30次;72℃終延伸20 min,4℃保溫。酵母菌:94℃預變性5 min;94℃變性1 min,54℃退火1 min,72℃延伸1 min,循環(huán)34次;72℃終延伸10 min,4℃保溫。
PCR擴增產物由瓊脂糖凝膠電泳檢測后,測序工作由生工生物工程(上海)股份有限公司完成。
1.3.5 系統發(fā)育樹的構建 將菌株測定的序列提交至NCBI進行 BLAST[16]比對,比對結果用MEGA 4軟件中的 Neighbor-Joining 法構建系統發(fā)育樹,以確定該菌株的分類地位。
1.3.6 發(fā)酵菌株的應用 將篩選出的優(yōu)良菌株應用到新鮮的芥菜中,測定發(fā)酵芥菜的理化指標,并與自然發(fā)酵的芥菜作比較。
1.3.7 理化指標測定
pH值:采用PHS-3C型pH計直接測定;
總酸:參考《GB/T 12456-2008食品安全國家標準 食品中總酸的測定》測定[17];
氨基酸態(tài)氮:參考《GB/T 5009.235-2016食品安全國家標準 食品中氨基酸態(tài)氮的測定》測定[18];
亞硝酸鹽含量:采用南京建成生物工程研究所亞硝酸鹽測試盒測定。
1.4 數據處理
每組試驗均進行3次生物學重復,所有數據用SPSS 26.0軟件進行差異顯著性(P<0.05)分析,采用OriginPro 9.0 軟件作圖。
2 結果與分析
2.1 發(fā)酵菌的分離
試驗根據溶鈣圈大小共純化分離出11株乳酸菌,依次編號為L1~L11。根據酵母菌菌落形態(tài)和菌落特征差異共分離純化出9株酵母菌,依次編號為Y1~Y9。
2.2 發(fā)酵菌的篩選
2.2.1 乳酸菌的篩選
2.2.1.1 生長曲線的測定結果 通常以600 nm波長下的吸光度值變化來反映菌株的生長和繁殖情況,在對11株乳酸菌進行活化過程中,L11生長較慢,故將其淘汰。剩下的10株乳酸菌生長曲線測定結果見圖1。所有菌株均在 4 h 后進入對數生長期。在2 h時,L8與L3、L9之間差異達顯著水平(P<0.05)。在14 h時L3、L8和L9菌體量較大,多數菌株均在16 h進入穩(wěn)定期,進入穩(wěn)定期后的L3、L8和L9生長繁殖速度與其他菌株相比較快,其中L9的生長情況比L8略好,且在6、14以及16 h時,L9與L3、L8之間差異均達顯著水平(P<0.05)。L10的生長繁殖速度較慢,菌體量較少,在24 h時的OD值僅為1.2。
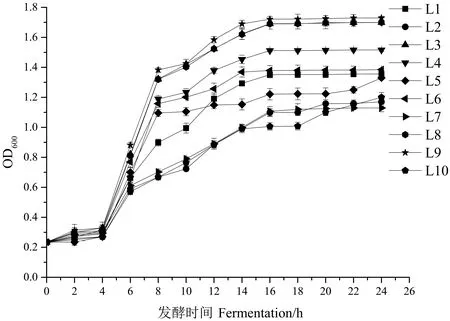
圖1 各菌株的生長曲線Fig.1 Growth curve of each strain
2.2.1.2 產酸性能的測定結果 產酸能力決定著蔬菜發(fā)酵周期,也是評判菌種發(fā)酵活力的重要指標[19]。每隔4 h測一次pH值,得到各菌株pH值隨發(fā)酵時間的變化曲線見圖2。結果表明,L8、L9產酸快,且產酸能力相近,尤其是在4~8 h時,L8、L9產酸速度明顯,pH值分別達到4.52、4.31;在12 h時,L3、L4產酸快,pH值分別達到4.32、4.31,L7和L10產酸慢,pH值分別達到4.76、4.70,且L3、L8、L9在8 h和12 h時,三者之間均達顯著性差異(P<0.05);各菌株在培養(yǎng)24 h后,pH值均達到穩(wěn)定值,說明各菌株均可使pH下降,但發(fā)酵液的最終pH值不同,按照由低到高順序排列為L9(3.68)、L3(3.79)、L4(3.79)、L8(3.81)、L5(3.82)、L2(4.08)、L6(4.08)、L7(4.31)、L10(4.40)。
2.2.1.3 亞硝酸鹽降解率的測定結果 亞硝酸鹽含量是影響腌制菜品質的重要因素,研究亞硝酸鹽降解能力高的乳酸菌對指導腌漬菜生產有重要意義[20]。由圖3可知,L8降解亞硝酸鹽的能力最強,降解率達到78.96%,其次是L9,降解率為76.72%,兩者之間差異不顯著(P>0.05);再次是L1和L3,降解率分別為73.44%、74.41%,L8與L1、L3之間降解亞硝酸鹽的能力達到顯著水平(P<0.05)。L10降解率最低,僅為47.73%。
綜合圖1~3,根據各菌株的生長曲線、產酸速度以及亞硝酸鹽降解率,最終從10株乳酸菌中確定L8、L9為本試驗所篩選出的優(yōu)勢乳酸菌。
2.2.2 酵母菌的篩選
2.2.2.1 產氣能力檢測結果 由于過多的氣體會使泡菜變軟[21],影響泡菜的口感和質地。根據表1可知,Y4、Y5以及Y7產氣能力較強,尤其是Y7,在28℃條件下發(fā)酵48 h,產氣量已充滿整個杜氏小管,而菌株Y1、Y2、Y3、Y6、Y8、Y9在72 h內均不產氣,因此將這6株菌作為復篩的出發(fā)菌株。
2.2.2.2 蛋白酶活性檢測結果 具有蛋白酶活性的菌株在蔬菜發(fā)酵過程中對風味形成有重要影響[22],
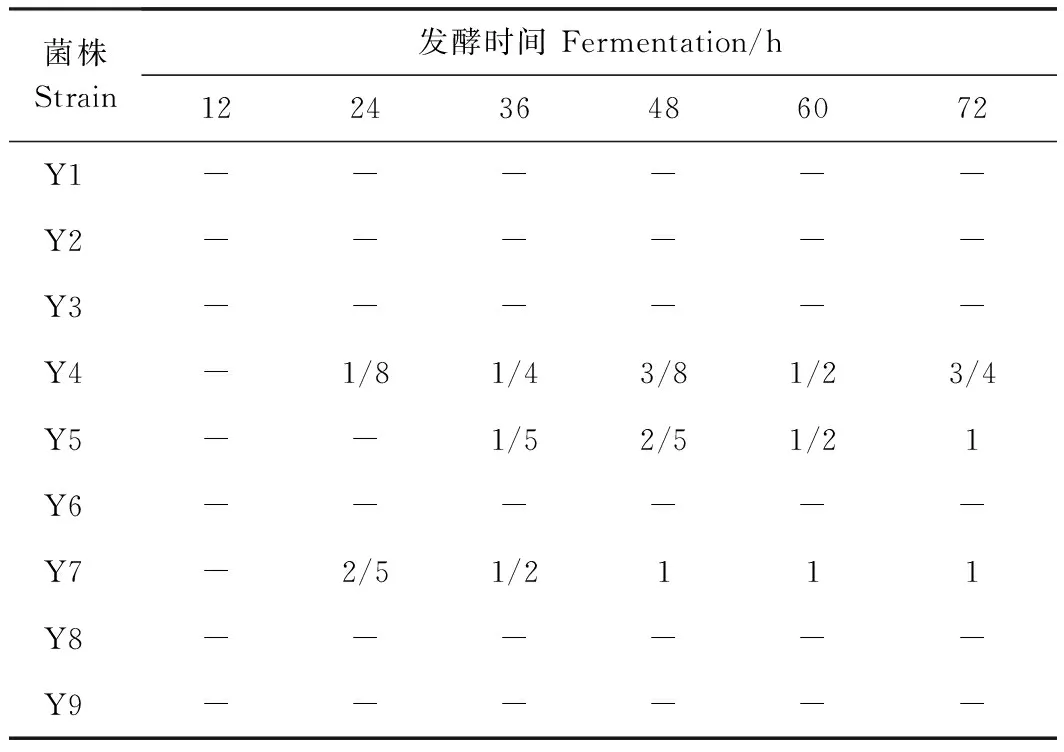
表1 不同菌株杜氏小導管產氣效果Table 1 Gas production in the Durham tube of different strains
可以分解蛋白質產生游離氨基酸,游離氨基酸對食品的滋味貢獻較大。根據表2可知,Y1、Y2、Y6、Y9菌落周圍均出現了透明環(huán),均具有蛋白酶活性,因此將這4株菌株作為下一步的復篩菌株。

表2 酵母菌蛋白酶活性檢測結果Table 2 Yeast protease activity test results
2.2.2.3 產酯檢測結果 酯類作為酵母發(fā)酵產物中主要的呈香物質[11],是香氣的來源,是評價酵母生香能力的重要指標,在蔬菜發(fā)酵過程中對風味有著有利的影響。由圖4可知,各菌株在培養(yǎng)48 h后,發(fā)酵液中Y9總酯含量最高,為0.386 3 g·100 mL-1,其次是Y1,總酯含量達到0.325 4 g·100 mL-1;Y2、Y6總酯含量相對較少,Y9菌株的總酯含量與Y1、Y2、Y6之間差異均達顯著水平(P<0.05)。表明Y9的產酯能力最強,適合發(fā)酵。
根據菌株的產氣能力、蛋白酶活性檢測以及產酯能力逐級篩選,最終從9株酵母菌中確定Y9為本試驗所篩選出的優(yōu)勢酵母菌。

圖4 各菌株的產酯能力Fig.4 Ester production capacity of each strain
2.3 選取的發(fā)酵菌鑒定
2.3.1 宏觀形態(tài)學鑒定 將篩選確定的3株優(yōu)勢發(fā)酵菌L8、L9以及Y9在平板上培養(yǎng),觀察其菌落特征,結果見表3和圖5。

表3 菌落形態(tài)特征描述Table 3 Description of colony morphology characteristics

圖5 菌株菌落形態(tài)Fig.5 Strain colony morphology

圖6 發(fā)酵菌株的電鏡成像Fig.6 Electron microscopy imaging of fermented strains
2.3.2 微觀形態(tài)學鑒定 將篩選的優(yōu)勢發(fā)酵菌L8、L9以及Y9進行掃描電鏡(scanning electron microscope,SEM)和透射電鏡(transmission electron microscope,TEM)觀察,結果如圖6所示。綜合觀察發(fā)酵菌株的掃描電鏡和透射電鏡成像發(fā)現,L8、L9菌體均呈桿狀,可以對L8、L9進行初步判斷,兩者可能均為乳桿菌,而Y9菌體呈卵圓形,為釀酒酵母菌的可能性較大。
2.3.3 分子生物學鑒定 菌株序列擴增電泳圖如圖7所示。測序結果在NCBI基因序列庫通過BLAST進行序列比對,得到相似性為99%~100%的序列,從中隨機選取100%典型菌株的序列用MEGA4軟件構建系統發(fā)育樹,結果見圖8。可以判定L8為短乳桿菌(Lactobacillusbrevis)、L9為植物乳桿菌(Lactobacillusplantarum),Y9為釀酒酵母菌(Saccharomycescerevisiae),這也與微觀形態(tài)學鑒定結果相符合。
2.4 接菌對葉用芥菜發(fā)酵的影響
將篩選出的優(yōu)良菌株均按1.5%(種子液菌體濃度約為107CFU·mL-1)的接種量接種至葉用芥菜中,與自然發(fā)酵的葉用芥菜對比部分理化指標,結果見圖9。pH值和總酸是評估發(fā)酵蔬菜成熟度的2個主要參數,大多數腌菜成熟時的pH值和總酸分別在3.2~4.2、0.6~2.4 g·100g-1范圍內,這與我國成熟的發(fā)酵蔬菜特征相對應[23]。由圖9-A、B可知,與自然發(fā)酵的葉用芥菜相比,接菌發(fā)酵降低了pH值、提高了總酸含量,在發(fā)酵終點時分別達到3.485、0.957 6 g·100g-1,且與自然發(fā)酵差異均達到顯著水平(P<0.05)。食品中氨基酸的含量是感官呈味的一項重要指標。由圖9-C可知,接菌發(fā)酵氨基酸態(tài)氮含量均高于自然發(fā)酵,氨基酸主要來源于腌制菜中蛋白質分解,一定濃度的發(fā)酵菌種有利于蛋白質分解,產生更多的游離氨基酸。亞硝酸鹽含量是評價發(fā)酵蔬菜和腌制蔬菜安全性的重要指標。由圖9-D可知,發(fā)酵初期,自然發(fā)酵與接菌發(fā)酵的亞硝酸鹽含量均呈上升趨勢,并且均有亞硝酸鹽峰值的出現,但接菌發(fā)酵組的亞硝酸鹽峰值遠低于自然發(fā)酵組,且接菌發(fā)酵與自然發(fā)酵兩者之間在發(fā)酵4、9及15 d時具有顯著性差異(P<0.05)。在發(fā)酵后期,接菌發(fā)酵的亞硝酸鹽含量僅為0.22 mg·kg-1。
從自然發(fā)酵和接菌發(fā)酵兩組的理化指標可以看出,接入優(yōu)良的發(fā)酵菌株可以提高腌制葉用芥菜的品質和安全性。
3 討論
蔬菜的發(fā)酵主要是由附著在蔬菜中的微生物經過一系列代謝活動引起,有研究表明,乳酸菌可以改善產品風味和質地,提高消化率[24],具有高耐酸性和益生菌特性[25]。同時在發(fā)酵蔬菜環(huán)境中存在著由蔬菜原料帶入的酵母菌,酵母菌在無氧環(huán)境下將糖類物質分解為乙醇,可以抑制發(fā)酵環(huán)境中腐敗菌的生長繁殖,還可以與發(fā)酵后期產生的有機酸發(fā)生酯化反應生成芳香族化合物,增加發(fā)酵成品的芳香氣味。研究表明,乙醇含量過多,會消耗大量糖類,降低發(fā)酵蔬菜的營養(yǎng)價值[26],因此在蔬菜發(fā)酵過程中,酵母菌的應用通常沒有乳酸菌廣泛。蔬菜發(fā)酵過程中的部分理化指標對發(fā)酵產品品質有重要作用,如氨基酸是發(fā)酵蔬菜重要的營養(yǎng)成分,氨基酸含量的高低代表著發(fā)酵蔬菜營養(yǎng)成分多少,且多種氨基酸會給發(fā)酵蔬菜提供豐富有層次感的鮮味和甜味[27]。亞硝酸鹽含量是評價發(fā)酵蔬菜和腌制蔬菜安全性的重要指標[28]。食用亞硝酸鹽含量較高的發(fā)酵蔬菜可引起中毒或增加癌癥患病幾率,因此國家標準發(fā)酵蔬菜中的亞硝酸鹽含量有著嚴格的要求[14]。本研究中接菌發(fā)酵的理化指標均優(yōu)于自然發(fā)酵,但對成品的營養(yǎng)價值和風味還有待進一步研究。
利用形態(tài)和生理生化特征鑒定菌種的傳統方法耗時長、過程繁瑣、不易確定菌種。本研究對目標菌株乳酸菌L8、L9和酵母菌Y9進行鑒定時,通過微觀形態(tài)學觀察結合分子生物學技術鑒定,包括以核酸為基礎,結合PCR擴增、凝膠電泳以及測序等現代分子生物學技術,充分顯示出鑒定方法的高效、快速及準確性,加快了優(yōu)良發(fā)酵菌種的篩選進程。

注:M為Maker。Note: M is Maker.圖7 發(fā)酵菌株擴增電泳圖Fig.7 Amplification electrophoresis diagram of fermentation strains
在對目標菌株進行篩選時,設置可靠靈敏的系統尤為重要,劉沁源等[29]、程凱森等[30]均通過可靠靈敏的系統篩選出優(yōu)良菌株。本試驗篩選出2株發(fā)酵性能良好的乳酸菌,分別是L8短乳桿菌(Lactobacillusbrevis)、L9植物乳桿菌(Lactobacillusplantarum)。陳荷鳳等[27]研究腌漬菜植物乳桿菌的分離鑒定特性發(fā)現,蔬菜在腌漬初期,產酸少繁殖快,以不耐酸的腸膜明串珠菌占優(yōu)勢,中后期主要轉為植物乳桿菌和短乳桿菌。本試驗是從自然發(fā)酵的芥菜鹽水產品中篩選菌株,屬于發(fā)酵中后期,篩選的2株乳酸菌與陳荷鳳等的研究較為一致。根據逐級篩選,篩選出的1株酵母菌是Y9釀酒酵母菌(Saccharomycescerevisiae),釀酒酵母菌常用于釀酒、制作面包以及餅干等[31],其呈現風味的主要物質為酯類,可以為產品帶來良好的香氣,但在蔬菜發(fā)酵中應用較少。本研究未利用誘變等手段對分離

圖8 發(fā)酵菌株的系統發(fā)育樹Fig.8 Phylogenetic tree of fermenting bacteria

注:不同小寫字母表示同一發(fā)酵時間不同處理間差異顯著(P<0.05)。Note: Different lowercase letters indicate significant differences at 0.05 level between different treatments at the same fermentation time.圖9 兩組芥菜發(fā)酵過程中pH值(A)、總酸(B)、氨基酸態(tài)氮(C)、亞硝酸鹽(D)的變化Fig.9 Changes of pH value(A), total acid (B), amino acid nitrogen (C) and nitrite (D) during the fermentation of two groups of mustard
篩選出的發(fā)酵菌株進行改良,因此對利用該菌種發(fā)酵提高發(fā)酵蔬菜的特征以及功能性成分尚有待進一步研究。
4 結論
本研究通過設置可靠靈敏的篩選系統,篩選出發(fā)酵性能優(yōu)良的3株菌種,即L8短乳桿菌(Lactobacillusbrevis)、L9植物乳桿菌(Lactobacillusplantarum)以及Y9釀酒酵母菌(Saccharomycescerevisiae),其中,L8的亞硝酸鹽降解率最高,為78.96%,L9的生長情況最好,但pH值最低,僅為3.68,Y9不產氣且具有蛋白酶活性,總酯含量達到0.386 3 g·100mL-1。將篩選出的3株優(yōu)良菌種應用于葉用芥菜腌制發(fā)酵,與自然發(fā)酵相比,接菌發(fā)酵的pH值、亞硝酸鹽含量降低了2.22%和88.13%,總酸含量、氨基酸態(tài)氮含量分別增加了9.02%和28.09%,提高了腌制葉用芥菜的營養(yǎng)和安全性。本研究結果為發(fā)酵葉用芥菜的優(yōu)勢益生菌菌種選擇提供了新的來源,為今后工業(yè)化生產奠定了技術基礎。

