續隨子ElSAD2基因的克隆與功能分析
王鑫雨,葛麗萍*,盛曉倩,牛聽風,包 鵬,李潤植
(1 山西農業大學 林學院,山西太谷 030801;2 山西農業大學 分子農業與生物能源研究所,山西太谷 030801)
續隨子(EuphorbialathyrisL.)為大戟科大戟屬,1~2年生草本植物,全株無毛,高可達1 m。根柱狀,莖直立,頂部二歧分枝,灰綠色;葉交互對生,線狀披針形,全緣,無葉柄;花序單生近鐘狀,雄花多數,雌花1枚。蒴果三棱狀球形,種子柱狀至卵球狀。花期4~7月,果期6~9月,在中國多個省區有分布或栽培[1]。20世紀80年代,美國加利福尼亞大學M.Calvin教授通過對油脂植物續隨子進行能源利用潛力的評價研究發現,續隨子的種子油中含有30%~40%類似于石油的碳氫化合物,這些油脂化合物可作為石油代用品,是一種很有開發前途的新型能源油料植物。危文亮等在2007年研究表明,續隨子種子含油率為43.3%,脂肪酸成分以C16、C18為主,其中油酸(C18∶1Δ9)含量高達83%,亞麻酸為2.5%,不飽和度適中[2]。研究認為,如果充分利用可耕土地,種植能源植物,并對其他農副產物的生物質進行加工,全球的植物能源開發潛力可達到435 EJ/年,遠遠超過初級能源的需求量[3]。
植物油脂是植物體內的儲能物質,在人類生產生活方面起著重要作用,尤其還可以用于生物燃料的產生[4]。植物油脂是由1個甘油分子和3個不同類型的脂肪酸分子相結合而成的高級脂類化合物。質體中的Δ9-硬脂酰-ACP脫氫酶 (stearoyl-acyl carrier protein Δ9desaturase,SAD)催化單不飽和油酸的合成,是控制植物細胞飽和脂肪酸與不飽和脂肪酸比例的關鍵酶。以硬脂酰-ACP(C18∶0-ACP)為底物,在第9~10碳原子之間脫氫形成一個雙鍵,催化生成油酰-ACP(C18∶1Δ9-ACP),在硫酯酶的作用下解離,轉運至內質網進行三酰甘油的組裝或再延長去飽和等過程,生成多不飽和脂肪酸[5-7]。多項研究表明SAD基因決定植物細胞中的不飽和脂肪酸含量。煙草中過表達黃羽扇豆(Lupinusluteus)的SAD基因,導致葉片油酸的含量增加[8]。在萊茵衣藻(Chlamydomonasreinhardtii)中,降低SAD的表達量,引起硬脂酸含量增加[9]。在甘藍型油菜(Brassicanapus)種子中過表達烏桕(Sapiumsebiferum)SAD基因,也引起油酸(C18∶1)、亞油酸(C18∶2)和亞麻酸(C18∶3)含量的變化[10]。在擬南芥[7](Arabidopsisthaliana)、蓖麻[11](Ricinuscommunis)和大豆[12](Glycinemax)等植物中也分離得到了SAD基因,并驗證了異源表達SAD基因可以提高宿主組織油脂含量。然而,有關續隨子SAD基因的研究尚未見報道。
本課題組前期已研究了續隨子種子油脂合成通路中ElDGAT1[13]、ElDGAT2[14]、ElFAD2[15]和ElPDAT1[16]基因。本研究基于續隨子種子轉錄組數據分析發現一條高表達的功能注釋為SAD的轉錄本,以續隨子為材料,應用生物信息工具分析續隨子SAD2蛋白的理化性質、高級結構和系統發育特征,PCR技術獲得該續隨子ElSAD2基因的cDNA序列,并分析該基因在不同器官中的表達譜,構建植物表達載體和酵母表達載體,通過異源表達ElSAD2基因分析煙葉及酵母細胞中的油脂含量變化,鑒定續隨子ElSAD2基因的功能。研究可為解析續隨子油脂合成的分子機理提供科學參考,可進一步應用于油料植物油脂產量和品質改良。
1 材料和方法
1.1 材 料
本研究所用續隨子種植于山西農業大學林業站苗圃。取材為續隨子根、莖、葉、花以及3個不同發育時期(花后15、30 和45 d)的種子。所有材料采集后立即置于-80 ℃超低溫冰箱保存。本氏煙草(Nicotianabenthamiana)種植于基質土中,設置光照培養箱生長條件為:溫度26 ℃,相對濕度60%,光照/黑暗16 h/8 h[17]。釀酒酵母(Saccharomycescerevisiae)突變菌株BY4389缺陷型酵母(MATaolelΔ∷LEU2ura3-52his4)、DH5α大腸桿菌、pMD18-T克隆載體、GV3101根癌農桿菌均保存于山西農業大學分子農業與生物能源研究所。
1.2 方 法
1.2.1 續隨子RNA提取、cDNA第一鏈的合成以續隨子根、莖、葉、花的混樣及3個不同發育時期(花后15、30和45 d)的種子轉錄組數據為基礎,選用模式植物擬南芥SAD(AtSADs)基因家族編碼的蛋白序列作為檢索序列,對續隨子種子轉錄組數據庫進行BLAST比對,并參考轉錄組數據功能注釋,分析得到續隨子Δ9-硬脂酰-ACP脫氫酶轉錄本,命名為ElSAD2。使用Trizol法提取續隨子根、莖、葉、花以及3個不同發育時期(花后15、30 和45 d)種子的總RNA。利用5×All-In-One RT MasterMix 反轉錄試劑盒合成cDNA,cDNA保存于-20 ℃冰箱備用。
1.2.2 續隨子各器官ElSAD2基因表達特性檢測及基因克隆以續隨子各器官cDNA為模板,使用NCBI中的 Primer-BLAST 對ElSAD2 基因編碼序列設計特異性引物(表1),以續隨子ElActin作為內參基因,使用2×RealStar Green Fast Mix(GenStar公司)試劑盒進行qRT-PCR反應。反應體系為:cDNA 模板0.5 μL, 2×RealStar Green Fast Mixture 5 μL,正向引物0.25 μL,反向引物0.25 μL,ddH2O 4 μL。引物退火溫度均為60 ℃,反應程序為兩步法:95 ℃、10 min,95 ℃、15 s,60 ℃、1 min,40個循環,溶解曲線拍照。

表1 引物信息
以表達量最高的cDNA為模板,使用目的基因特異引物及2×GPV8 HF Polymerase Master高保真酶擴增目的基因的ORF,目的片段經凝膠回收和純化后連入pMD18-T載體并轉入大腸桿菌中,選取陽性菌株,并測序驗證。
1.2.3 續隨子ElSAD2蛋白的理化性質分析以擬南芥AtSADs家族蛋白為序列源,對續隨子轉錄組數據進行BLAST比對,獲得續隨子ElSAD2基因候選氨基酸序列。將檢索到的氨基酸序列提交到CDD數據庫進行驗證分析,分析鑒定ElSAD2蛋白序列的保守結構域。用在線軟件 ProtParam 預測續隨子ElSAD2蛋白的分子量、理論等電點、不穩定性等理化性質。通過在線工具TMHMM Server v.2.0 (http://www.cbs.dtu.dk/ services/TMHMM/)預測續隨子ElSAD2的跨膜結構區域;通過Plant-mPLoc(www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi)在線軟件對續隨子ElSAD2蛋白的亞細胞定位進行預測。
1.2.4 續隨子ElSAD2蛋白二級結構和三級結構分析利用SOPMA網站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat. pl?page=npsa_sopma.html)預測ElSAD2的二級結構。用在線網站SWISS-MODEL對ElSAD2進行三級結構預測分析并建模。
1.2.5 續隨子ElSAD2蛋白的多序列比對和系統進化分析從NCBI中調取其他植物的SAD蛋白序列,用軟件DNAMAN對續隨子、擬南芥、蓖麻、煙草、茶樹和芝麻的SAD蛋白的氨基酸序列進行多序列比對。運用MEGA7.0軟件對續隨子和其他物種SAD蛋白的氨基酸序列采用鄰接法(NJ)構建無根系統發育樹,自舉檢驗值設置為1 000個循環[18]。
1.2.6 續隨子ElSAD2基因表達載體的構建根據已經克隆獲得的續隨子ElSAD2基因序列信息,使用Primer Primer5.0軟件設計帶有KpnI和XbaI酶切位點的引物。以上述重組質粒pMD18-T- ElSAD2為模板,進行PCR擴增,獲得帶有酶切位點(KpnI和XbaI)的ElSAD2目的片段,回收純化,同時對酵母表達載體pYES2.0進行KpnⅠ和XbaⅠ 雙酶切,用T4-DNA連接酶將ElSAD2基因連接到pYES2.0載體上,形成重組酵母表達載體pYES2.0-ElSAD2,將其轉至大腸桿菌DH5α中,繼續培養,提取質粒pYES2.0-ElSAD2,進行雙酶切驗證,將陽性菌液加入等體積的50%甘油,保存于-80 ℃冰箱備用。
用以上的重組質粒pMD18-T-ElSAD2為模板,進行PCR擴增,獲得帶有酶切位點(KpnⅠ和XbaⅠ)的ElSAD2目的片段,回收純化,同時對植物表達載體pCAMBIA1303用KpnⅠ和XbaⅠ進行雙酶切反應,酶切產物經回收純化后,用T4-DNA連接酶連接,得到重組表達載體 (pCAMBIA1303-ElSAD2)。再將其轉入大腸桿菌DH5α,繼續培養,經PCR和雙酶切試驗鑒定陽性克隆,將陽性菌液加入等體積的50%甘油,混勻后保存于-80 ℃冰箱備用。
1.2.7 續隨子ElSAD2基因的煙草葉片瞬時表達和突變體酵母功能互補檢測將構建成功的植物表達載體pCAMBIA1303-ElSAD2及空載體pCAMBIA1303通過凍融法轉入根癌農桿菌中,配制煙草侵染液,使用注射器侵染本氏煙草的葉片[19-20]。取侵染3 d后的葉片,提取RNA,并檢測目的基因是否有效表達。取侵染6 d后的葉片冷凍干燥,保存備用。
將上述構建成功的酵母表達載體pYES2.0-ElSAD2和空載體pYES2.0轉化到BY4389缺陷型酵母中,挑取轉化后的2種BY4389缺陷型酵母[轉基因的BY4389缺陷型酵母和轉空載的BY4389缺陷型酵母(EV)]單菌落和未轉化的BY4389缺陷型酵母[以下稱為野生型(WT)]單菌落分別接種于尿嘧啶缺陷的合成完全培養基SC-URA上,待長出菌落,進行菌液PCR檢測。將檢測結果為陽性的轉基因酵母置于誘導培養基,誘導表達,收集菌體。
1.2.8 脂肪酸甲酯和總油脂的提取與測定采用內標法對上述酵母和煙草葉片提取脂肪酸甲酯。稱取50 mg樣品研磨至粉末(設置3次生物學重復),加入50 μL的Tir17:0 作為內標 (濃度為10 mg/mL)。加入1.5 mL的2.5%的濃硫酸-甲醇混合液,80 ℃水浴2 h進行甲酯化,冷卻后,加入2 mL 0.9%KCl和1 mL正己烷,離心,取上清液至新的玻璃試管中,氮吹儀吹干,沉淀用50 μL的乙酸乙酯混勻溶解,轉移到GC小瓶中,-20 ℃保存備用。
采用氯仿-甲醇法分別提取酵母和煙草葉片的總油脂。分別稱取上述冷凍干燥的酵母和煙草葉片50 mg粉末置于離心管中(設置3次生物學重復),加入7.5 mL的氯仿∶甲醇(1∶2),混勻后于37 ℃抽提24 h,收集上層有機相。將收集的上層有機相混勻,加5 mL氯仿和9 mL 1%氯化鈉溶液,使氯仿∶甲醇∶水體積比為2∶2∶1.8,充分混勻后8 000 r/min離心10 min,收集下層有機相轉移至已稱重的玻璃管m0(g)中,待氮吹儀吹干后再次稱重,稱取總重量m1(g)。總脂肪酸含量=(提取后總重m1-提取前管重m0)/0.05。
2 結果與分析
2.1 續隨子ElSAD2基因的表達分析
提取續隨子根、莖、葉、花以及3個不同發育時期(花后15、30和45 d)種子的RNA,經核酸濃度儀檢測,RNA的濃度和純度合適,并通過凝膠成像儀觀察RNA條帶(圖1),使用反轉錄試劑盒合成cDNA。為鑒定續隨子ElSAD2基因是否行使功能,通過qRT-PCR分析續隨子ElSAD2基因在不同器官及種子不同發育時期的表達特性。實時熒光定量qRT-PCR(圖2)結果顯示:在花后30 d,ElSAD2基因的表達量最高,其次是花后45 d。
M. DL2000;1. 根;2. 莖;3. 葉;4. 花;5. 花后15 d種子;6. 花后30 d種子;7. 花后45 d種子圖1 續隨子各器官RNA瓊脂糖凝膠電泳M. DL2000; 1. Root; 2. Steam; 3. Leaf; 4. Flower;5. Seeds of 15 days after flowering; 6. Seeds of 30 days after flowering; 7. Seeds of 45 days after floweringFig.1 The agarose gel electrophoresis of RNA from Euphorbia lathyris organs
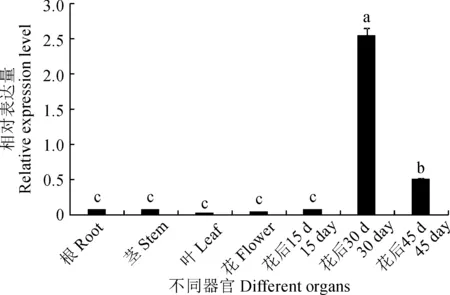
不同小寫字母表示差異顯著(P<0.05),下同圖2 ElSAD2基因在不同器官及種子不同發育時期的相對表達量Different normal letters on the bar represent significant difference (P<0.05), the same as belowFig.2 Relative expression of ElSAD2 in different organs and seed developing stages
2.2 續隨子ElSAD2蛋白理化性質及高級結構分析
通過NCBI-ORF Finder在線軟件對續隨子ElSAD2基因的開放閱讀框(ORF)及編碼氨基酸序列進行識別、比對,結果顯示:ElSAD2基因cDNA全長為1 665 bp,開放閱讀框(ORF)長度為1 194 bp,共編碼397個氨基酸殘基。ElSAD2相對分子量為45.21kD,理論等電點為6.29,為親水性蛋白。ElSAD2蛋白無信號肽和跨膜結構,亞細胞定位預測定位于葉綠體,推測該蛋白可能在葉綠體中發揮作用。
ElSAD蛋白二級結構預測(圖3)結果顯示,ElSAD2蛋白二級結構由α-螺旋、β-折疊、無規則卷曲和延伸連組成,所占比例分別為54.91%、5.54%、31.99%和7.56%。其中α-螺旋和無規則卷曲所占比例較大,β-折疊所占比例最小。
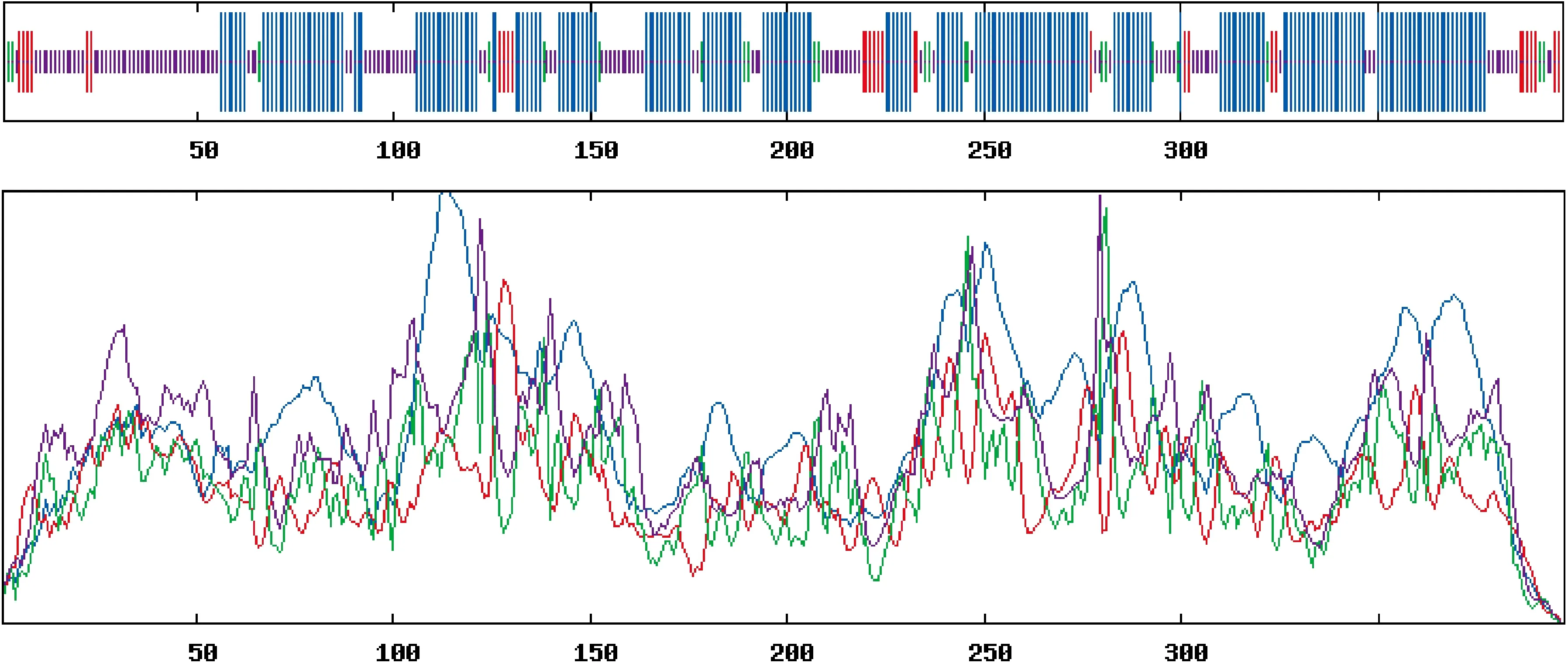
藍色.α-螺旋;紅色.延伸連;綠色.β-折疊;紫色.無規則卷曲;橫坐標表示氨基酸數圖3 ElSAD2蛋白的二級結構預測Blue. Alpha helix; Red. Extended strand; Green. Beta turn; Purple. Random coil;The horizontal axis represents the number of amino acidsFig.3 The second structure prediction of ElSAD2
利用SWISS-MODEL軟件以蓖麻硬脂酰酰基載體蛋白去飽和酶T199D突變株(PDB數據庫編號:2j2f.1)為模板對續隨子ElSAD2蛋白進行同源建模。如圖4所示,預測到ElSAD2蛋白活性形式為二聚體,在SAD保守區,4個α-螺旋束包圍的2個二價鐵離子,Fe離子的配基即是四螺旋束的氨基酸側鏈,兩個單體的二價鐵離子位于SAD二聚體底物結合凹槽的內部,共同組成了脫氫酶催化活性中心。
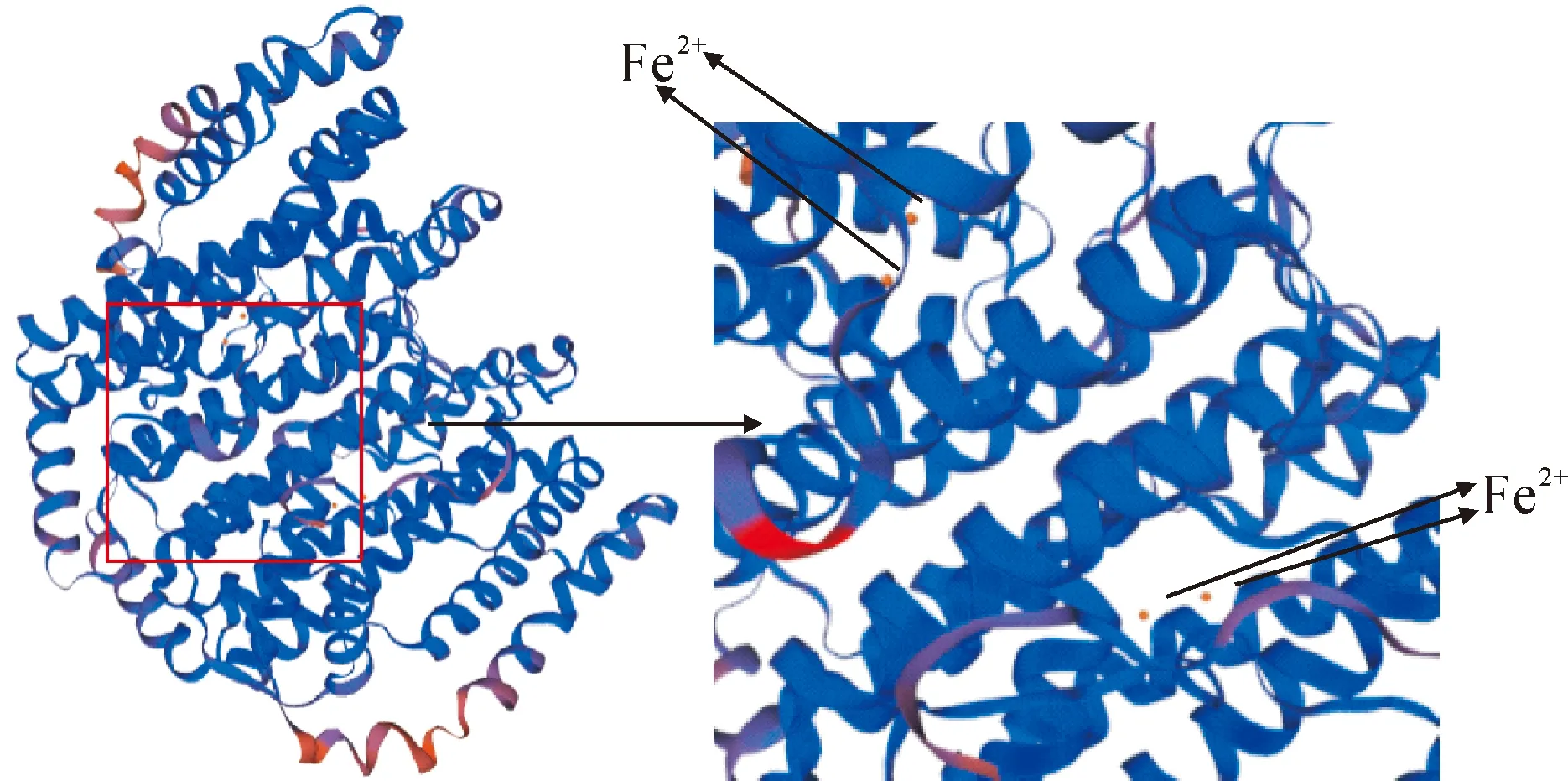
圖4 ElSAD2蛋白三級結構預測Fig.4 The tertiary structure prediction of ElSAD2 protein
2.3 續隨子ElSAD2蛋白保守域及系統進化分析
通過對續隨子、擬南芥、蓖麻、煙草、茶樹和芝麻這6種植物的氨基酸序列比對,結果表明,續隨子ElSAD2的關鍵氨基酸殘基與蓖麻RcSAD1和擬南芥AtSSI2完全相同, 氨基酸序列相似度高。續隨子ElSAD2中有兩個典型SAD特征的保守的組氨酸富集區,即EENRHG和DEKRHE(圖5),其中天冬氨酸(D)和組氨酸(H)為ElSAD2催化活性中心的二價鐵離子提供了必須結合位點,保證脫氫酶具有一定的催化活性。

AtSSI2. 擬南芥 (At2g43710); RcSAD1. 蓖麻(XP_002531889.1); NtSAD1. 煙草(XP_016449714.1); CsSAD. 茶樹 (XP_028086173.1);SiSAD. 芝麻 (NP_001291335.1); 綠色框代表2個保守的富含組氨酸的基序EENRHG和DEKRHE,紅色框標記決定功能性的氨基酸圖5 不同物種SAD氨基酸序列比對分析AtSSI2. Arabidopsis thaliana (At2g43710); RcSAD1. Ricinus communis (XP_002531889.1); NtSAD1. Nicotiana tabacum (XP_016449714.1); CsSAD. Camellia sinensis(XP_028086173.1); SiSAD. Sesamum indicum (NP_001291335.1);The green boxes represent two conserved histidine-rich motifs EENRHG and DEKRHE, the red box marks the amino acids that determine the functionalityFig.5 Sequence alignment of SAD proteins from different plant species
運用MEGA 7.0軟件對續隨子ElSAD2蛋白和其他植物SAD蛋白進行多序列系統進化分析,結果如圖(圖6),ElSAD2與蓖麻RcSAD1、茶樹CsSAD等親緣關系較近,聚為一支。

OeSAD.油橄欖(XP_022874955.1);GhSAD.陸地棉(XP_016699036.1);HlSAD.湖泊紅球藻(ABP57425.1); BnSAD.油菜(AAT65205.1);BrSAD.白菜(XP_009133630.1);SlSAD.番茄(XP_004234817.1);VvSAD.葡萄(XP_003635378.1);ZmSAD.玉米(NP_001151340.2);TaSAD.翼葉山牽牛(AAA82160.1);OsSAD.水稻(CAE03992.1);PsSAD.北美云杉(ABK24594.1);MtSAD.結核桿菌(NP_335274)圖6 ElSAD2與其他物種SAD蛋白的系統發育分析OeSAD. Olea europaea (XP_022874955.1); GhSAD. Gossypium hirsutum (XP_016699036.1); HlSAD. Haematococcus lacustris (ABP57425.1); BnSAD. Brassica napus (AAT65205.1);BrSAD. Brassica rapa (XP_009133630.1); SlSAD. Solanum lycopersicum (XP_004234817.1); VvSAD. Vitis vinifera (XP_003635378.1); ZmSAD. Zea mays (NP_001151340.2);TaSAD. Thunbergia alata (AAA82160.1); OsSAD. Oryza sativa (CAE03992.1); PsSAD. Picea sitchensis (ABK24594.1);MtSAD. Mycobacterium tuberculosis (NP_335274)Fig.6 Phylogenetic tree of ElSAD2 and other SAD proteins
2.4 續隨子ElSAD2基因克隆和表達載體構建
為解析ElSAD2編碼的酶蛋白是否具有SAD酶活性以及在續隨子油脂生物合成中的功能,我們克隆了ElSAD2基因,并分別構建了植物表達載體和酵母表達載體。以開花后30 d種子的cDNA為模板,通過高保真PCR擴增出ElSAD2基因片段,經過回收純化和測序驗證,成功克隆出ElSAD2。
用KpnⅠ和XbaⅠ酶分別雙酶切ElSAD2基因和酵母表達載體pYES2.0,使用T4連接酶將二者進行連接,通過雙酶切驗證得到重組酵母表達載體pYES2.0-ElSAD2(圖7,A)。用類似的方法,構建植物表達載體pCAMBIA1303-ElSAD2(圖7,B)。
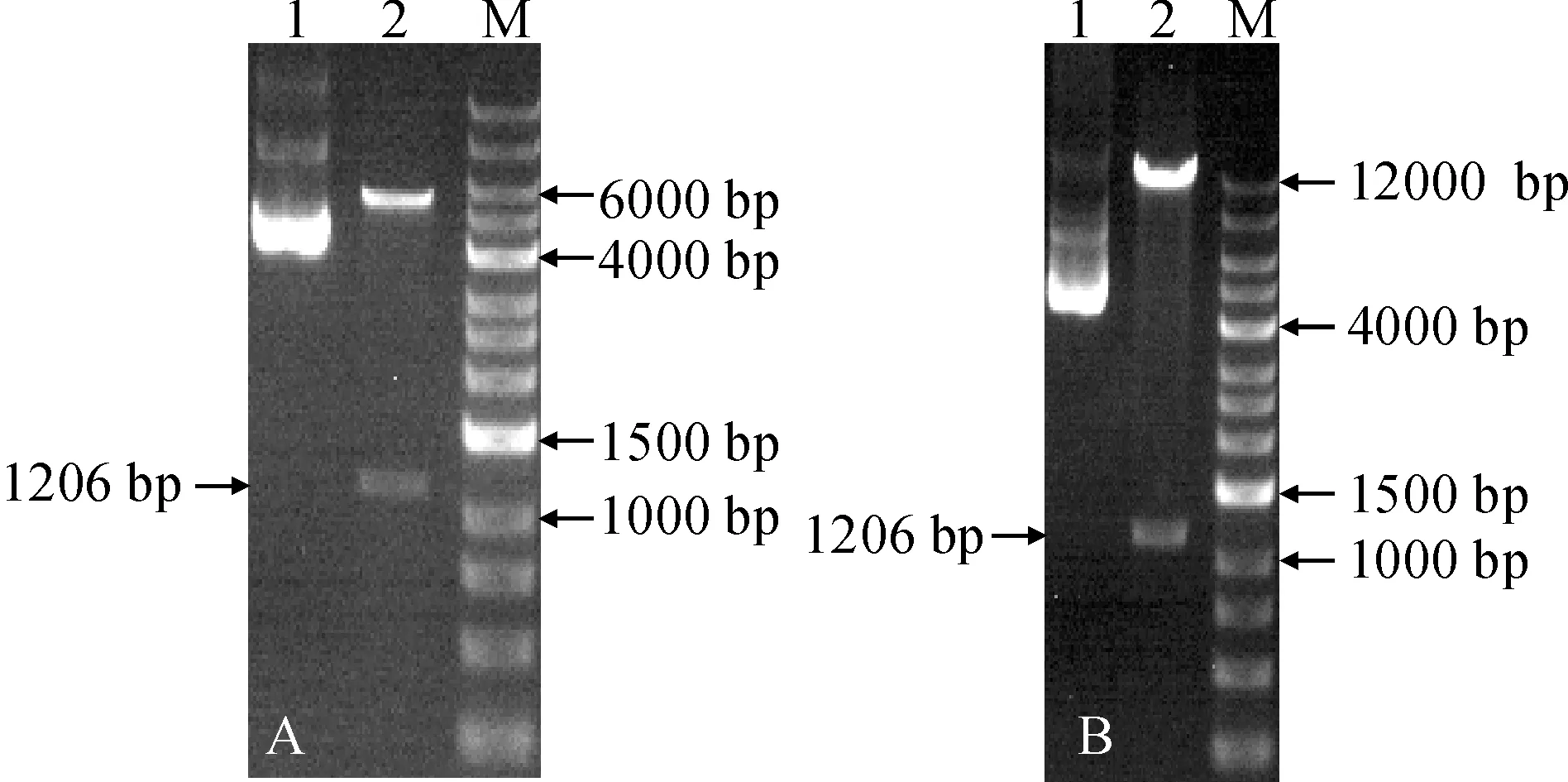
A. 重組酵母表達載體雙酶切驗證:1. pYES2.0;2. 雙酶切pYES2.0-ElSAD2;M. 12 000 bp marker;B. 重組植物表達載體雙酶切驗證:1. pCAMBIA1303;2. 雙酶切pCAMBIA1303-ElSAD2;M. 12 000 bp marker圖7 雙酶切驗證A. Double restriction enzyme digestion verification of recombinant yeast expression vectors: 1. pYES2.0; 2. Double digested electrophoresis pYES2.0-ElSAD2; M. 12 000 bp marker;B. Double restriction enzyme digestion verification of recombinant plant expression vectors: 1. pCAMBIA1303; 2. Double digested electrophoresis pCAMBIA1303-ElSAD2; M. 12 000 bp markerFig.7 Double restriction enzyme digestion verification
2.5 過表達ElSAD2促進煙葉總油脂含量升高及脂肪酸成分的變化
利用農桿菌介導本氏煙草瞬時表達ElSAD2基因,取根癌農桿菌瞬時侵染3 d后的煙草葉片提取總RNA,反轉錄成cDNA,以該cDNA為模板進行RT-PCR檢測ElSAD2基因是否有表達,結果顯示,轉pCAMBIA1303-ElSAD2基因煙草葉片能擴增出約1 194 bp大小的目的條帶,而轉pCAMBIA1303空載的煙草葉片無目的條帶。這表明瞬時轉化后的煙草葉片中目的基因ElSAD2能夠正常轉錄形成mRNA有效表達。
選擇野生型(WT)、轉pCAMBIA1303空載體(EV)以及轉pCAMBIA1303-ElSAD2的煙草葉片進行總油脂含量和脂肪酸組分測定。總油脂含量結果顯示(圖8),與野生型和轉空載相比,轉pCAMBIA1303-ElSAD2基因煙草葉片的總油脂含量提高了2.46%。脂肪酸組分分析顯示(圖9),與野生型和轉空載相比,轉pCAMBIA1303-ElSAD2基因煙草葉片的不飽和油酸(C18∶1Δ9)和亞油酸(C18∶2)分別增加了2.1%和2.4%,而棕櫚酸(16∶0)、硬脂酸(C18∶0)、亞麻酸(C18:3)和花生酸(C20∶0)的含量均下降,其中硬脂酸(C18∶0)下降了約2.7%。總之,ElSAD2增加了煙草葉片中總油脂含量,并且飽和脂肪酸含量下降,不飽和油酸顯著增加。結果表明,ElSAD2在煙葉組織中發揮SAD蛋白功能,催化18∶0-ACP生成18∶1Δ9-ACP,且促進總油脂的積累。
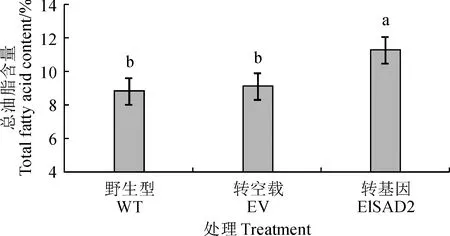
圖8 過表達ElSAD2基因的煙葉總油脂含量Fig.8 Total oil contents in tobacco leaves overexpressing ElSAD2
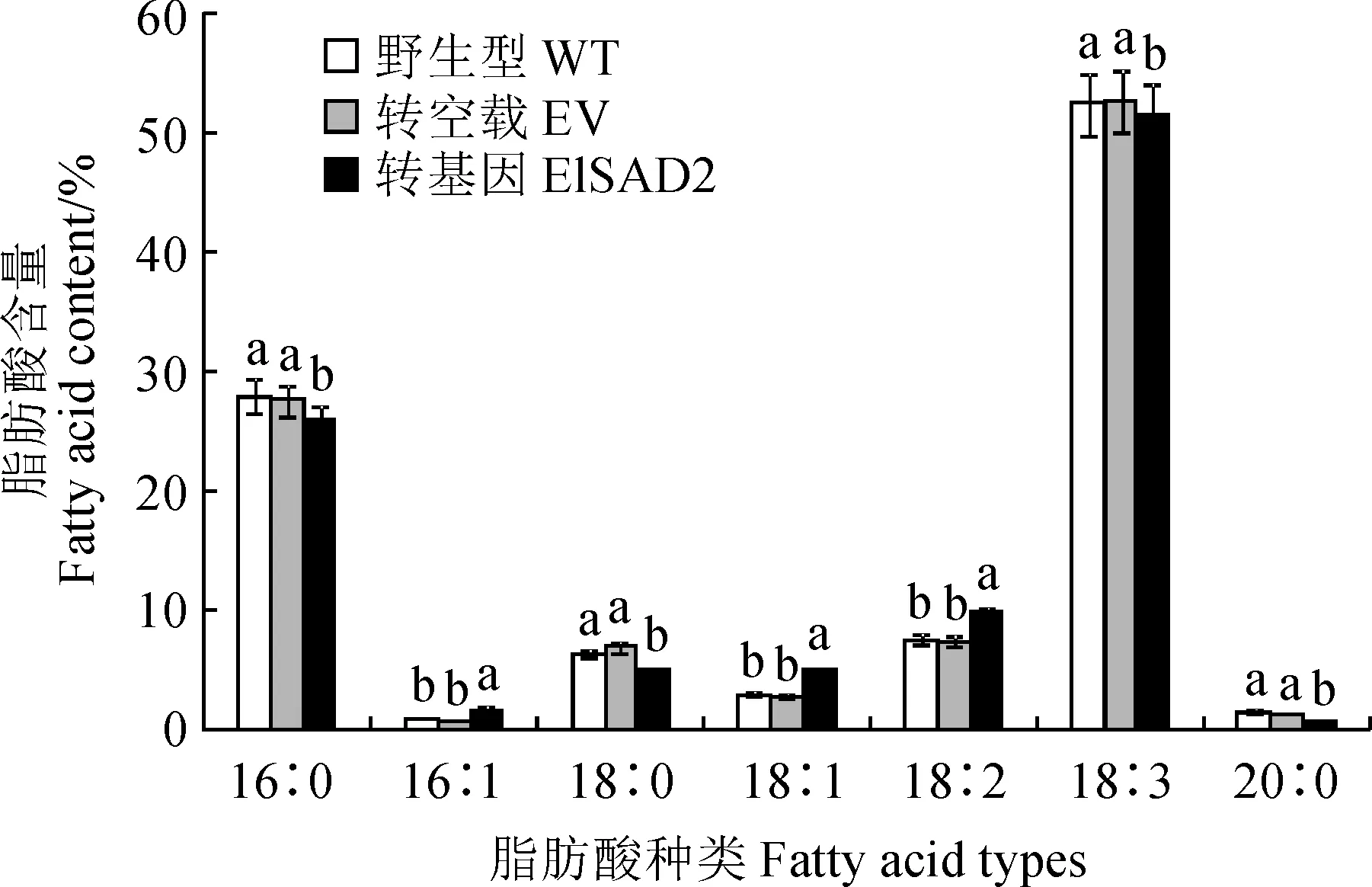
圖9 過表達ElSAD2基因的煙葉脂肪酸成分變化Fig.9 Changes of fatty acid profiles in tobacco leaves overexpressing ElSAD2
2.6 缺陷型酵母異源表達ElSAD2促進酵母總油脂含量升高和脂肪酸成分變化
將重組酵母表達載體pYES2.0-ElSAD2和空載體pYES2.0轉入BY4389缺陷型酵母中,同時通過尿嘧啶缺失的固體培養基來篩選轉化株,得到平板上的陽性克隆菌落,進行菌液PCR檢測。結果顯示:轉重組質粒pYES2.0-ElSAD2的BY4389缺陷型酵母中得到長度為1 194 bp的目的條帶,這與目的基因的ElSAD2的開放閱讀框(ORF)大小相符,轉基因BY4389缺陷型酵母在不含油酸的培養基中正常生長擴繁,未轉化的BY4389缺陷型酵母(WT)和轉空載的BY4389缺陷型酵母(EV)則無法正常生長,表明目的基因已成功轉入BY4389缺陷型酵母中,并能夠合成不飽和脂肪酸滿足自身生長需求。
將陽性菌株涂布于以半乳糖為碳源的SC-URA誘導培養基上,倒置于28 ℃培養箱,培養2~4 d出現菌斑,擴繁收集酵母,冷凍干燥研磨獲得酵母菌粉,選擇野生型(WT)、轉pYES2.0空載體(EV)以及轉pYES2.0-ElSAD2的BY4389缺陷型酵母進行總油脂含量和脂肪酸組分測定。總油脂含量測定結果顯示(圖10):與野生型和轉空載相比,轉pYES2.0-ElSAD2的BY4389缺陷型酵母中總脂肪酸含量增加了約4.0%。脂肪酸組分測定結果顯示(圖11):與野生型和轉空載相比,轉pYES2.0-ElSAD2的BY4389缺陷型酵母中棕櫚酸(16∶0)和硬脂酸(C18∶0)分別下降了約2.6%和4.8%,單不飽和脂肪酸油酸(C18∶1)增加了約6.6%,棕櫚油酸(C16∶1)含量有少量(約1.6%)增加。表明ElSAD2可以使BY4389缺陷型酵母不飽和脂肪酸含量升高,且主要以硬脂酰-ACP(18∶0-ACP)為底物,催化脫氫成為油酰-ACP(18∶1-ACP)。
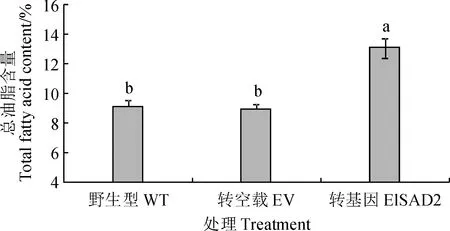
圖10 過表達ElSAD2基因的BY4389缺陷型酵母總油脂含量Fig.10 Total oil contents in SAD-defective yeast BY4389 overexpressing ElSAD2
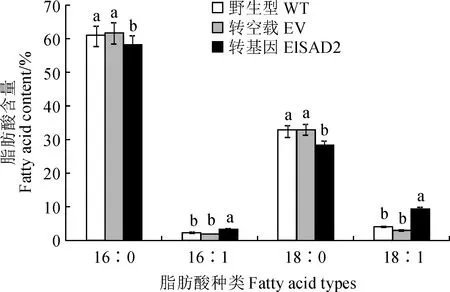
圖11 過表達ElSAD2基因的BY4389缺陷型酵母脂肪酸成分變化Fig.11 Changes of fatty acid profiles in SAD-defective yeast BY4389 overexpressing ElSAD2
3 討 論
新型能源植物續隨子種子含油率為43.3%,油酸含量高(83%),且作為林下植物,具有“不與人爭糧,不與糧爭地”的優勢,加速相關應用基礎研究對于該能源植物的開發利用極為重要。Δ9-硬脂酰-ACP脫氫酶在不飽和脂肪酸合成中發揮重要作用。研究表明,蓖麻RcSAD1和擬南芥AtSSI2均對18∶0-ACP具有底物選擇性,催化生成18∶1Δ9-ACP,形成油酸。因此,探究續隨子Δ9-硬脂酰-ACP脫氫酶的催化活性,為解析油酸合成機制,并為后續通過轉基因工程培育高油酸續隨子具有重要指導意義。
在獲得續隨子種子轉錄組數據情況下,通過BLAST比對分析,鑒定得到續隨子ElSAD2基因序列。ElSAD2基因cDNA全長為1 665 bp,開放閱讀框長度為1 194 bp,共編碼397個氨基酸殘基。ElSAD2蛋白三級結構與蓖麻RcSAD1相似。Lindqvist等通過X射線晶體衍射方法分析的蓖麻RcSAD的晶體結構,是第一個鑒定了三級結構的SAD蛋白,該SAD為同型二聚體,4個α-螺旋與Fe2+共同形成SAD活性中心[21]。通過保守結構域分析發現,續隨子ElSAD2中有兩個典型SAD特征的保守組氨酸富集區,即EENRHG和DEKRHE。系統發育分析顯示,續隨子ElSAD2蛋白與同科植物蓖麻RcSAD蛋白相似度最高,具有較高的同源性,說明SAD在進化中是非常保守的,這進一步說明SAD是一種非常重要的脂肪酸去飽和酶。
表達模式分析發現,ElSAD2基因在不同器官中均有表達,尤其在開花后30 d種子中表達量最高。這與麻瘋樹JSAD基因表達譜一致,麻瘋樹JSAD基因在麻瘋樹的幼嫩根、莖、葉、花、果實以及成熟葉片中都有表達,在幼嫩的果實(正發育的果皮和種子)中表達最旺盛[22]。陸地棉GhSAD2基因在花后25 d的種子中表達量達到最高值[23]。紫蘇PfSAD5在開花后30 d種子中表達較高[24]。推測SAD酶在種子發育過程中發揮主要作用,參與油脂的合成。
農桿菌介導的葉片瞬時轉化廣泛應用于植物外源基因的快速表達和功能鑒定。釀酒酵母由于其生長周期短,穩定性好等優勢,常用于外源基因的表達來驗證基因功能[25]。BY4389缺陷型酵母中OLE1基因發生缺失突變,酵母中失去脫氫酶活性,無法正常合成不飽和脂肪酸[26]。本研究構建了植物表達載體和酵母表達載體,通過異源表達ElSAD2基因分析煙葉及酵母細胞中的油脂含量變化,鑒定ElSAD2基因的功能。研究發現轉基因煙葉中ElSAD2基因參與了油脂合成,使得不飽和油酸顯著增加,轉基因的BY4389缺陷型酵母中的油酸含量升高。煙草葉片瞬時表達和BY4389缺陷型酵母功能互補結果表明ElSAD2能高效催化硬脂酸生成油酸,促進細胞總油脂合成積累。
本研究鑒定得到續隨子ElSAD2基因,確定該基因具有SAD酶的典型特征。對該基因的序列特征和表達模式進行了分析,并通過異源表達鑒定該基因的功能。本研究為深入解析能源植物續隨子種子油脂合成和富集油酸的分子調控機制提供了科學參考,ElSAD2基因可作為靶基因應用于油料作物油脂產量及不飽和脂肪酸合成的基因工程。

