不同光質對杉木組培苗生根的影響及其機理初探
唐 銀,李玲燕,許珊珊,鐘明慧,鄭雪燕,葉義全*
(1 福建農林大學 林學院, 福州 350002; 2 國家林業局杉木工程技術研究中心, 福州 350002; 3 林木逆境生理生態及分子生物學福建省高校重點實驗室, 福州 350002; 4 福建洋口國有林場, 福建南平 353200)
杉木(Cunninghamialanceolata)是中國長江以南地區主要的造林樹種,具有材性優良、速生和無病蟲害等特性,是一種優質的建筑裝飾用材,深受廣大林農喜愛[1-2]。第八次全國森林資源清查結果顯示,中國杉木人工林造林面積和蓄積量分別占全國人工林造林總面積和人工林總蓄積的19.01%和25.18%,面積和蓄積均居于中國主要造林樹種的首位,在促進中國林業健康發展、林農脫貧致富和生態環境改善中發揮重要作用[3]。隨著杉木人工林造林面積的不斷增大,市場對杉木優質種苗的需求也在不斷增長。優質苗木能在造林早期快速生長占據有利生態位,提高造林效果,因此杉木優質苗木的培育是提高造林質量的關鍵環節[4]。組織培養因其具有周期短、速度快和易實現規模化生產等優點,已成為杉木優質苗木繁育的重要手段之一。盡管目前已有許多學者對杉木組培展開了一系列研究,涉及外植體消毒[5]、愈傷組織誘導[6]、增殖擴繁[7-10]、生根[11]、煉苗移栽[12]等方面,并取得一定的成效。然而,目前杉木組培中仍存在著增殖系數低、生根率不高以及生根不穩定等問題,極大限制了該技術的推廣應用。此外,近年來隨著一些杉木高世代良種,如‘洋020’等開始在全國杉木產區的逐步推廣,極大提升了中國杉木人工林經濟效益與良種化水平,然而與這些高世代良種材料相匹配的種苗快繁技術體系尚未完全建立,這也在一定程度上限制了這些材料的推廣應用[4,13]。因此,針對杉木高世代良種材料種苗快繁技術中存在的技術瓶頸問題,研究建立與之相匹配的苗木繁育技術是當前杉木苗木培育產業持續健康發展面臨的迫切技術需求。
光是影響植物生長的重要環境因子,它不僅是植物生長的能量來源,而且還能作為信號分子參與植物生長發育的調控[14]。在影響植物生長發育和形態建成的光條件中,光強和光質是最為重要的兩種因素。大量研究表明,不同光質和光強可通過對植物體內光合碳同化產物合成、運輸、分配和內源激素含量等一系列生理過程的影響,從而對植物生長產生重要的調控[15-19]。因此,適宜的光質組合或光強的選擇對苗木培育至關重要。值得注意的是,近年來一些研究相繼發現不同的光質組合除了能促進植物生長外,它們對組培苗的生根同樣具有顯著的促進效果。例如,紅∶藍∶遠紅光=6∶3∶1是最適宜誘導蝴蝶蘭(Phalaenopsisssp.)生根的光質組合[20],金線蓮(Anoectochilusroxburghii)幼苗生根誘導階段最適宜的LED光質組合為紅∶藍=8∶2[21]。類似研究結果在黃花高山杜鵑(RhododendronL.)[22]和紅心杉(Cunninghamialanceolata)[23]的研究中也有發現。盡管目前也有少量關于光質對杉木組培苗生根的研究報道,但這些研究主要著重分析不同光質對生根和生理的影響,鮮有分析不同光質組合介導的組培苗生根調控機理,目前有關不同光質組合介導的杉木組培苗生根調控機理如何?尚不清楚,而該機理的闡明又是揭示杉木組培苗適應不同光環境的關鍵所在。
有鑒于此,本試驗以杉木優良無性系‘洋020’繼代苗為研究材料,首先以白光為對照,比較藍光、紅光以及不同紅藍光組合處理下組培苗生根率的差異,篩選出最適宜‘洋020’生根的光質組合條件。其次,以白光為對照,比較它與生根率最高和生根率最低的光質處理之間在生長、光合色素含量、葉綠素熒光參數、內源激素含量與比值以及葉綠體超微結構之間的差異。旨在從光合、內源激素和葉綠體超微結構等角度揭示不同光質介導的杉木組培苗生根調控機理,從而為杉木組培苗工廠化育苗提供理論依據。
1 材料和方法
1.1 試驗材料
本試驗在福建農林大學田間實驗室進行(26°05′N和119°13′E),以杉木優良無性系‘洋020’繼代培養獲得的無菌組培苗為材料。
1.2 材料培養與處理
(1) 第一輪試驗,設置如下光質配比處理:1)白光對照處理(WCK);2)紅光處理(R);3)紅∶藍=2∶1處理(R2B1);4)紅∶藍=3∶1處理(R3B1);5)紅∶藍=4∶1處理(R4B1);6)藍光處理(B);7)紅∶藍=1∶2處理(R1B2);8)紅∶藍=1∶3處理(R1B3);9)紅∶藍=1∶4處理(R1B4);10)紅∶藍=1∶1處理(R1B1)。將‘洋020’組培繼代苗切成長度為(3.0 ± 0.2) cm的莖段轉接于生根培養基(1/2 MS+0.3 mg/L IBA)上,每瓶接種3個莖段,每個處理3次重復,每個重復10瓶,隨后將轉接好的組培苗置于試驗設置的不同光質條件下進行培養。其中,培養的光周期與溫度條件為光照14 h/25 ℃、黑暗10 h/22 ℃,相對濕度為75%,光照強度為45 μmol·m-2·s-1。生根培養35 d后統計生根率。
(2)第二輪試驗,根據第一輪不同光質組合下培養結果,選取白光處理為對照(WCK),同時選取生根率最低(藍光,B)和生根率最高(紅∶藍=3∶1, R3B1)的處理,共設置3個處理,重新按第一輪試驗中方法進行材料準備和培養。培養35 d后,取樣進行相關指標觀測分析。
1.3 觀測指標及方法
1.3.1 植株生物量和苗高取第二輪試驗材料,將3個處理中組培苗全部取出,用純水沖洗干凈,并吸干水分,以萬分之一的天平來測定植株生物量,同時用直尺測量不同處理下組培苗苗高。
1.3.2 葉片葉綠素熒光動力學參數組培苗葉綠素熒光動力學參數測定參考陶文文等[24]的方法。第二輪試驗生根培養處理結束后,使用便攜式葉綠素熒光測量儀PAM-2500(WALZ,德國)進行葉綠素熒光動力學參數測定。上午9:00開始進行測定,隨機選擇組培苗中部的成熟葉片,用濕巾擦凈葉片表面后,將其置入暗盒進行20 min的暗適應處理,在弱光條件下測定葉片初始熒光(Fo),隨即給葉片一個飽和脈沖光測得葉片最大熒光值(Fm);打開光化光(110.0 μmol·m-2·s-1)持續照射5 min誘導熒光動力學,并隔 20 s 打開飽和脈沖測量光適應下的葉片最大熒光(Fm′);PSⅡ最大光化學效率(Fv/Fm)、PSⅡ潛在光化學活性(Fv/Fo)、光化學猝滅系數(qP)、非光化學猝滅系數(NPQ)與實際PSⅡ光化學效率(ФPSⅡ)等相關參數則按照Baker[25]的方法計算。
1.3.3 葉片光合色素含量采用乙醇-丙酮混合浸提方法對杉木葉片的光合色素含量進行測定[26]。第二輪試驗結束后,選取與測定葉綠素熒光參數相同部位的成熟葉片,用純水沖洗干凈,吸干葉片表面水分;隨后將葉片剪碎并充分混勻,稱取0.05 g葉片樣品于5 mL離心管中,加入提取液于黑暗條件下浸提3 h,期間每隔0.5 h將離心管拿出上下顛倒混勻;提取結束后于12 000 g下離心10 min,取上清液測定其在663、645和470 mm波長下的吸光值D663、D645、D470;最后根據如下公式計算不同處理下葉片葉綠素(Chl)和類胡蘿卜素(Car)含量。
Chla =(12.7D663-2.69D645)×[V/(1000×W)]
Chlb =(22.9D645-4.68D663)×[V/(1000×W)]
Chl(a+b)=(20.2D645+8.02D663)×[V/(1000×W)]
Car=(1000D470-3.27 Chla-104Chlb)/229
式中,V為提取液體積(mL),W為葉片鮮重(g)。
1.3.4 內源激素含量第二輪試驗處理結束后,將組培苗莖尖及嫩葉取下,用液氮速凍后放入做好標簽的離心管中,將樣品送往上海恒遠生物科技有限公司用ELLISA酶聯免疫法進行赤霉素(GA)、脫落酸(ABA)、生長素(IAA)、細胞分裂素類(CTK)、玉米素核苷(ZR)等激素含量的測定。
1.3.5 葉綠體超微結構葉綠體超微結構按葉義全等[27]的方法進行。第二輪試驗處理完畢時,選擇不同大小的成熟葉片組織塊各10片,用2.5%戊二醛-磷酸緩沖液固定6 h后,然后用0.1 mmol·L-1磷酸漂洗液進行3次漂洗,每次15 min;隨即用2%鋨酸固定液固定2 h,之后再用0.1 mmol·L-1磷酸漂洗液漂洗3次,每次15 min;分別在以下幾個不同體積分數梯度的乙醇洗脫液中進行連續脫水的處理:體積分數為50%乙醇放置15~20 min、體積分數為70%乙醇放置15~20 min、體積分數為90%乙醇放置15~20 min、體積分數為90%乙醇和體積分數為90%丙酮(1∶1,v/v)放置15~20 min、體積分數為90%丙酮放置15~20 min,以上操作需要在冰上進行;體積分數為100%丙酮在室溫環境下放置15~20 min,3次。處理結束后將樣品送上海師范大學電鏡中心進行樣品分析和拍照。
1.4 數據處理分析
本試驗數據采用SPSS 22.0進行單因素方差分析,不同處理間采用LSD法在0.05水平下進行多重比較。采用Origin 8.5軟件作圖。
2 結果與分析
2.1 不同光質配比對杉木優良無性體系組培苗生根的影響
不同光質組合處理對杉木優良無性系‘洋020’組培苗生根存在不同的影響(圖1),其生根率表現為R3B1(紅∶藍=3∶1)>R4B1(紅∶藍=4∶1)>R(紅光)>R1B4(紅∶藍=1∶4)>R1B2(紅∶藍=1∶2)>R2B1(紅∶藍=2∶1)>WCK(白光)>R1B1(紅∶藍=1∶1)>R1B3(紅∶藍=1∶3)>B(藍光)。其中,B、R1B3、R1B1處理的生根率顯著低于WCK,最低的B處理(12.50%)比WCK顯著降低74.40%(P<0.05);R1B2、R1B4、R、R2B1處理的生根率均與WCK無顯著差異;而R3B1和R4B1處理的生根率顯著高于WCK,最高的R3B1處理較對照顯著提高45.61%。因此,在后續研究中選擇在本試驗中生根率最高的R3B1處理、生根率最低的B處理以及WCK進行后續生長和生根調控機理的研究。
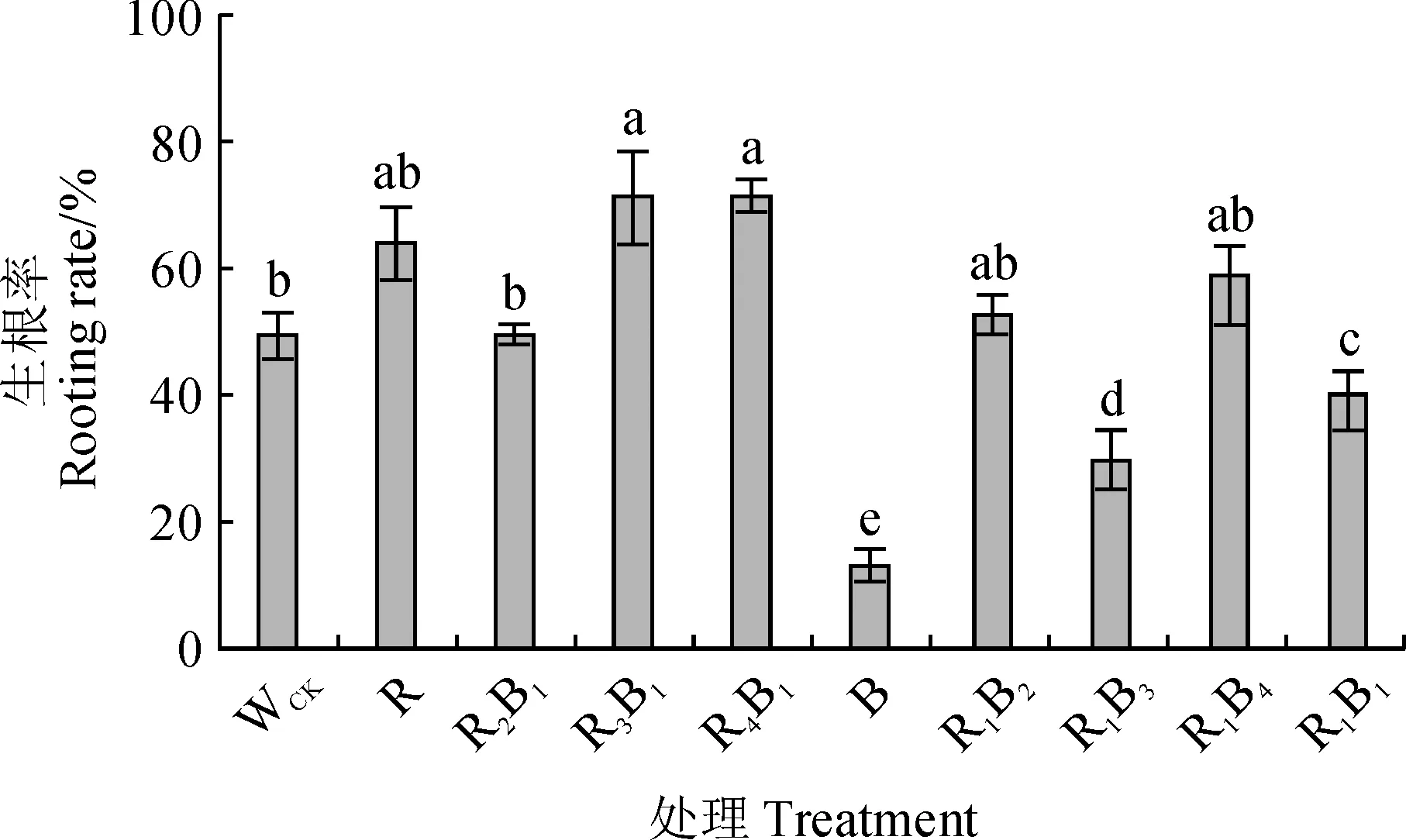
WCK.白光(對照);R.紅光; B.藍光;R2B1.紅∶藍=2∶1;R3B1.紅∶藍=3∶1;R4B1.紅∶藍=4∶1; R1B2.紅∶藍=1∶2;R1B3.紅∶藍=1∶3;R1B4.紅∶藍=1∶4;R1B1.紅∶藍=1∶1;不同字母表示不同處理之間在0.05水平差異顯著(P<0.05);下同圖1 不同光質條件下杉木組培苗的生根率WCK. White light (control); R. Red light; B. Blue light;R2B1. Red∶Blue=2∶1; R3B1. Red∶Blue=3∶1; R4B1. Red∶Blue =4∶1; R1B2. Red∶Blue =1∶2; R1B3. Red∶Blue =1∶3;R1B4. Red∶Blue =1∶4; R1B1. Red∶Blue =1∶1; The different normal letters indicate significant difference among treatments at 0.05 level (P<0.05). The same as belowFig.1 The rooting rate of tissue cultured seedlings of Cunninghamia lanceolata under different light qualities
2.2 不同光質處理對杉木優良無性系組培苗生長的影響
由圖2可知,不同光質處理對組培苗生物量和苗高生長同樣存在不同影響,均以R3B1處理最高,WCK居中,B處理最低。其中,R3B1處理杉木組培苗生物量和苗高分別比WCK提高13.54%、7.87%,比B處理分別提高29.93%、18.33%,且與B處理的差異均達到顯著水平(P<0.05),R3B1處理苗高與WCK的差異也達到顯著水平。說明適當的紅、藍光質組合處理可顯著提高杉木組培苗生物量和苗高生長。
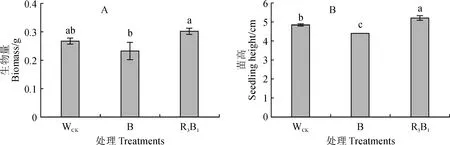
圖2 不同光質條件下杉木組培苗的生物量和苗高Fig.2 The biomass and plant height of C. lanceolata seedlings under different light qualities
2.3 不同光質處理對杉木組培苗葉片葉綠素熒光動力學參數和光合色素含量的影響
圖3,Ⅰ、Ⅱ顯示,在不同光質處理下,組培苗葉片葉綠素熒光動力學參數最大熒光(Fm)、可變熒光(Fv)、PSⅡ最大光化學效率(Fv/Fm)、PSⅡ潛在光化學效率(Fv/Fo)和實際PSⅡ光化學效率(ФPSⅡ)均表現為R3B1>WCK>B,而初始熒光(Fo)、非光化學淬滅系數(NPQ)和光化學淬滅系數(qP)均表現為B>WCK>R3B1,但除了Fv/Fo外,上述熒光動力學參數指標在不同光質處理之間均不存在顯著差異。其中,R3B1處理的Fv/Fo值比WCK增加0.54%,B處理中Fv/Fo值比WCK減少10.46%(P<0.05;圖3,Ⅱ)。同時,在不同的光質條件下,杉木組培苗葉片的葉綠素a、葉綠素b、葉綠素總量以及類胡蘿卜素含量均表現為R3B1>B>WCK,而且R3B1處理下杉木組培苗葉片的光合色素含量均與WCK有顯著差異(P<0.05),而B處理均與WCK無顯著差異(圖3,Ⅲ)。可見,R3B1處理能顯著提高杉木組培苗葉片的光合色素含量和PSⅡ潛在光化學效率。
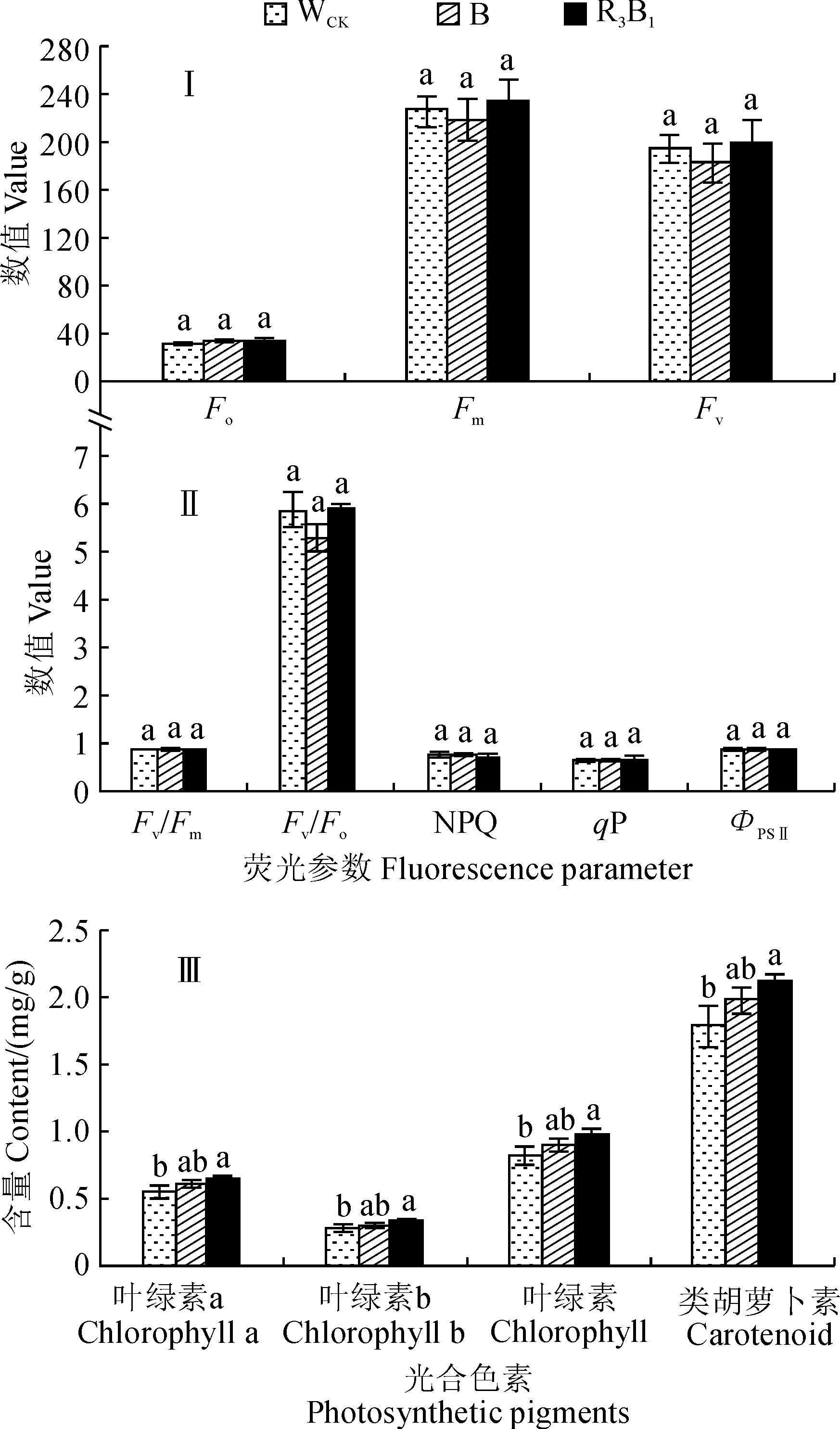
圖3 不同光質條件下杉木組培苗葉片的葉綠素熒光動力學參數和光合色素含量Fig.3 The chlorophyll fluorescence kinetic parameters and photosynthetic pigment content in leaves of C. lanceolata seedlings under different light qualities
2.4 不同光質處理對杉木組培苗葉片和莖中內源激素含量和比值的影響
圖4顯示,不同光質處理下杉木組培苗葉片和莖中內源激素赤霉素(GA)和生長素(IAA)含量均表現為R3B1>WCK>B,且各處理間均差異顯著(P<0.05);其中R3B1和WCK處理葉片中GA含量較B處理分別顯著增加18.67%、16.41%,其IAA含量則分別顯著增加21.31%、8.35%(圖4,Ⅰ),而R3B1和WCK處理莖中GA含量分別較B處理顯著增加32.06%、13.58%,其IAA含量分別顯著增加14.56%、10.18%(圖4,C)。同時,杉木組培苗葉片和莖中脫落酸(ABA)和細胞分裂素(CTK)含量均表現為B>WCK>R3B1,且各處理間均差異顯著;R3B1、WCK處理葉片中ABA含量分別較B處理顯著降低19.37%、5.73%,其CTK含量則分別顯著降低14.52%、6.38%(圖4,Ⅰ),而二者莖中ABA含量分別較B處理顯著降低16.47%、10.33%,CTK含量則分別顯著降低12.27%、10.11%(圖4,Ⅲ)。杉木葉片和莖中玉米素核苷(ZR)含量在不同光質處理間均不存在顯著差異(圖4,Ⅰ、Ⅲ)。此外,在不同光質處理下,杉木葉片和莖中不同激素含量比值GA/ABA和IAA/ABA均R3B1處理最大,WCK次之,B處理最小,而CTK/GA比值則表現相反,而且不同處理間大多存在顯著差異(圖4,Ⅱ、Ⅳ)。以上結果說明不同光質處理能夠通過改變植株葉片和莖中的GA和IAA的激素含量以及GA/ABA和IAA/ABA等激素比值進而影響幼苗的生長。
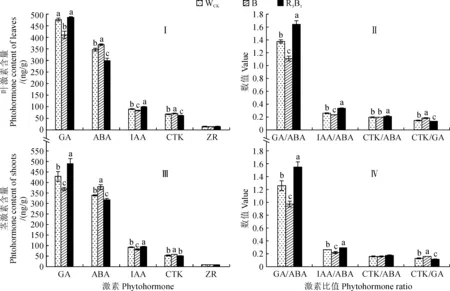
圖4 不同光質處理下杉木組培苗葉片(Ⅰ、Ⅱ)和莖中(Ⅲ、Ⅳ)的內源激素含量和比值Fig.4 The contents and ratios of endogenous hormones in leaves (Ⅰ, Ⅱ) and shoots(Ⅲ, Ⅳ) of C. lanceolata seedlings under different light qualities
2.5 不同光質處理對杉木組培苗葉片葉綠體超微結構的影響
不同光質條件對杉木組培苗葉片葉綠體超微結構具有不同的影響(圖5)。在白光(WCK)條件下,葉綠體存在體積較小的淀粉粒和嗜鋨體顆粒,葉綠體基粒片層數量不多,基質片層排列疏松(圖5, A、B);與白光對照相比,在藍光(B)條件下,葉綠體中淀粉粒體積膨大,基質片層排列松散,基粒片層數量減少(圖5,C、D);在紅∶藍=3∶1(R3B1)條件下,葉綠體中淀粉粒和嗜鋨體顆粒數量減少,基質片層、基粒片層結構清晰,基粒類囊體排列緊密有序(圖5,E、F)。可見,適當的光質條件有利于杉木組培苗葉片葉綠體中碳同化產物的輸出,減輕因碳同化產物積累而引起的植物光合作用受抑。
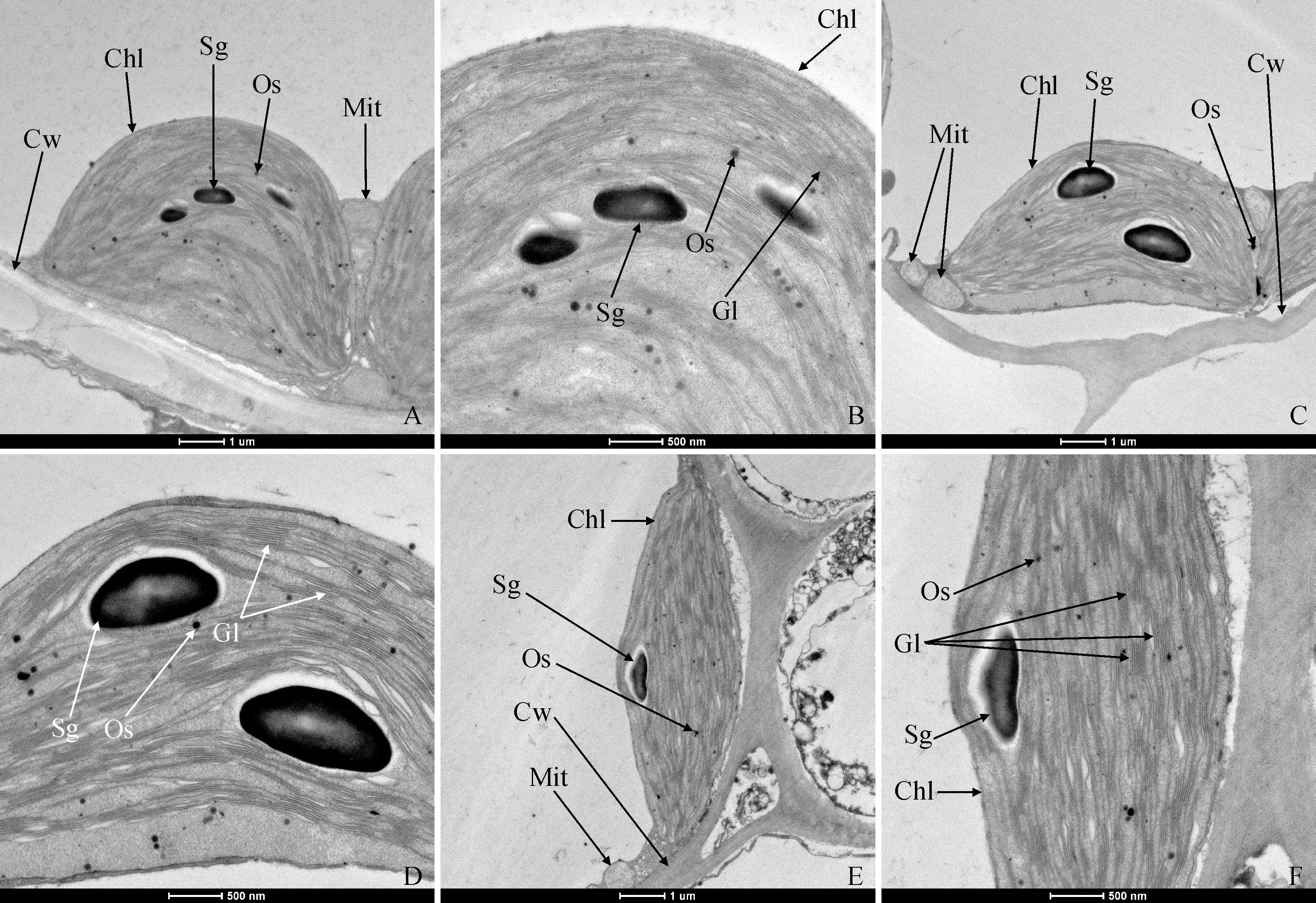
Cw.細胞壁;Chl.葉綠體;Sg.淀粉粒;Os.嗜鋨體顆粒;Mit.線粒體;Gl.基粒片層;A-B.白光(WCK);C-D.藍光(B);E-F.紅藍光(R3B1)圖5 不同光質處理下杉木組培苗葉片葉綠體超微結構Cw. Cell wall; Chl. Chloroplast; Sg. Starch granule; Os. Osmiophilic; Mit. Mitochondria; Gl. Grana lamella;A-B. White light (WCK); C-D. Blue light (B); E-F. Red-blue light (R3B1)Fig.5 The chloroplast ultrastructure in leaves of C. lanceolata seedlings under different light qualities
3 討 論
光是影響植物生長和形態建成的重要因素,不同的光質及其組合對植物生長和形態建成的影響存在一定的差異。本研究發現,在杉木組培苗生根過程中,相較于藍光而言紅光更有利于組培苗生根,在單純以紅光為光源的條件下組培苗生根率遠高于藍光處理,而且以紅光為主要光源輔以少量藍光要比以藍光為主要光源輔以少量紅光的生根率更高,其中紅藍光質組合(R3B1)最有利于杉木組培‘洋020’的生根。這與已有研究中紅心杉[23]、菊花等[28]、玉簪[29]和金線蓮等[21]的生根結果類似,說明以紅光為主要光源的復合光質促進組培苗生根存在一定普遍性,盡管不同種類植物生根對于復合光質中其他光質比例的需求存在差異。
在本研究篩選出適宜‘洋020’生根的最佳光質組合處理基礎上,我們進一步以白光為對照,同時結合生根率最低的藍光處理,分析3個處理之間組培苗葉片光合色素、葉綠素熒光參數、葉綠體超微結構和內源激素含量的差異,以期揭示不同光質組合介導的組培苗生根和生長的調控機理。研究結果表明,不同光質處理間組培苗的生物量表現為紅藍光質組合(R3B1)>白光(WCK)>藍光(B)。眾所周知,植物生物量的積累主要來源于光合碳同化產物的積累,而生物量的積累又與光合色素含量和植物對光能利用率等密切相關[30]。本研究發現,不同光質處理條件下杉木組培苗葉片葉綠素和類胡蘿卜素含量均表現為:紅藍光質組合(R3B1)>藍光(B)>白光(WCK),與上述生物量大小順序并不完全一致,因此導致不同處理間的組培苗生物量積累的差異,除光合色素含量外,可能還存在其他因素。
進一步分析各處理杉木組培苗葉片葉綠素熒光參數發現,除PSⅡ潛在光化學效率(Fv/Fo)大小表現為紅藍光質組合(R3B1)>白光(WCK)>藍光(B)外,不同處理間其余葉綠素熒光參數均不存在顯著差異。已有研究表明Fv/Fo的提高有利于增加具有活性PSⅡ反應中心的數量,增強將光能轉化為化學能的效率,為光合碳同化過程提供充足的能量,進而提高光合效率[31]。因此,紅藍光質組合(R3B1)處理條件下植株葉片具有較高的Fv/Fo值也是導致不同處理間生物量積累差異的原因之一。此外,從葉綠體超微結構來看,在紅藍光質組合(R3B1)條件下葉綠體中淀粉粒和嗜鋨體顆粒數量相對少,且基質和基粒片層結構清晰,基粒類囊體排列緊密有序,而在藍光條件下其片層結構松散,淀粉粒數量增加,且體積大。大量淀粉粒的存在也不利于光合產物的輸出,而且還會對植物光合作用產生抑制[32]。因此,不同處理間葉綠體超微結構的差異也是導致杉木組培苗生長差異的可能原因之一。可見,在紅藍光質組合(R3B1)處理條件下,杉木組培苗生物量高于白光和藍光處理,主要由于紅藍光處理下葉片具有較高的光合色素含量、光能利用率和合理的葉綠體超微結構,從而使植株具有較強的碳同化和輸出能力。
植物的生根與內源激素含量關系密切,尤其與生長素(IAA)和細胞分裂素(CTK)的含量及其比值密切相關[33]。一般而言,IAA能促進不定根的形成,而CTK則抑制生根。本研究發現不同光質處理下杉木組培苗葉片和莖中IAA含量均表現為紅藍光質組合(R3B1)>白光(WCK)>藍光(B),而CTK表現則剛好相反,可見紅藍光質組合(R3B1)處理有利于促進組培苗IAA合成,抑制CTK合成或促進其降解,最終促進組培苗生根。除二者含量外,IAA/CTK比值也是影響植物生根的重要因素。器官分化調控理論認為,IAA/CTK比值大于1時有利于促進不定根形成,而該比值小于1時則有利于不定芽分化,而當該比值接近1時,則傾向于無組織結構的愈傷組織的形成[34]。本研究中發現,在紅藍光質組合(R3B1)處理杉木組培苗葉和莖中IAA/CTK的比值分別為1.67和1.81,分別是藍光處理的1.42和1.31倍,由此可見,促進IAA的積累,降低CTK的含量,進而提高IAA/CTK比值是不同光質條件下組培苗生根差異的主要原因。
不同光質條件下植物的光形態建成大都通過光受體信號轉導途徑,調控下游的激素合成相關基因的表達,進而最終實現對植物生長的調控[35]。例如,遮陰條件引起的紅光:遠紅光比值下降會通過光受體隱花色素(phytochrome)調控下游PIF(phytochrome interacting factor)轉錄因子來增強生長素合成相關基因的表達,增加生長素含量,進而促進植物生長,形成典型的避蔭反應[36]。一些研究表明,不同光質也可通過影響植物內源激素的穩態平衡,從而對植物的生長產生影響[37]。蘇娜娜等[38]研究發現,紅光可促進黃瓜幼苗下胚軸中IAA和赤霉素(GA)的積累,促進黃瓜幼苗的伸長生長,而藍光下IAA和GA含量顯著下降,從而表現出矮化表型。類似地,余讓才等[39]研究也表明,與對照相比,藍光處理顯著抑制水稻幼苗GA和IAA的積累,從而抑制幼苗生長。相關研究也發現在紅光條件下三葉青具有較高的株高與其具有較高的IAA和GA水平密切相關,而在藍光下剛好相反,從而使植株表現出矮壯的表型[40]。本研究中,紅藍光質組合(R3B1)處理條件下杉木組培苗葉片和莖中IAA和GA含量顯著高于白光和藍光處理,這與該處理下植株具有較高的苗高結果相一致。盡管目前在杉木中不同光質介導的IAA和GA含量變化調控的確切機制尚不清楚,但一些研究表明這可能與紅光可通過光敏色素調控GA和IAA合成相關酶活性,進而促進二者積累,而藍光可通過增加吲哚乙酸氧化酶活性,促進IAA分解,進而導致IAA含量下降有關[41-43]。因此,上述結果共同表明,不同光質處理引起組培苗苗高生長的差異可能通過不同光質調控GA和IAA水平來實現。此外,作為脅迫型激素,脫落酸(ABA)對植株株高生長通常起著負調控的作用,而且在植物生長發育過程中它與GA存在一定程度的拮抗作用[44]。在本研究紅藍光質組合(R3B1)處理條件下,杉木組培苗葉片ABA含量顯著低于藍光和白光處理,因此具有較低的ABA含量可能也是紅藍光處理下組培苗具有較高苗高的原因之一。值得注意的是,部分研究表明植株的高低與其內源激素含量比值也存在一定關系。例如,在不同桃樹品種中,矮化和半矮化桃樹品種GA/ABA和IAA/ABA的比值顯著低于野生型,而CTK/GA的比值顯著高于野生型品種[45]。類似結果在黃瓜中也有發現[46]。在本研究中,紅藍光質組合(R3B1)處理條件下杉木組培苗葉片和莖中GA/ABA和IAA/ABA的比值顯著高于白光和藍光處理,而其CTK/GA的比值顯著低于白光和藍光處理,與前人研究結論類似。因此,具有較高的GA/ABA和IAA/ABA比值以及較低的CTK/GA比值也是紅藍光處理下組培苗具有較高株高的原因之一。
綜上所述,不同光質處理可能通過杉木組培苗光合色素含量、光能利用率、內源激素含量等的影響,進而對組培苗的生根和生長產生調控。其中:(1)紅藍光質組合(R3B1)處理下生根率顯著高于藍光和白光對照處理與其具有較高的IAA含量、較低的CTK含量以及較高的IAA/CTK比值有關;(2)紅藍光質組合(R3B1)處理下組培苗苗高顯著高于藍光和白光對照處理與其具有較高的GA和IAA含量、較低的ABA含量以及較高的GA/ABA和IAA/ABA比值有關;(3)與藍光和白光對照處理相比,紅藍光質組合(R3B1)處理更有利于促進光合色素含量增加,提高葉片光能利用效率以及促進葉片葉綠體基質和基粒片層結構的形成,即增強碳同化產物的輸出是紅藍光質組合(R3B1)處理促進組培苗生物量積累的重要原因。

