延齡草甾體皂苷對腦缺血大鼠星形膠質細胞GFAP、Cx43及Wnt3a/Dvl3信號通路的影響
李慢中,歐陽俊搖,楊樂,莊雨明,詹宇,鄒海艷,趙暉
1.首都醫科大學附屬北京世紀壇醫院藥學部,北京 100038;2.首都醫科大學中醫藥學院,北京 100069;3.臨床合理用藥評價北京市重點實驗室,北京 100038
延齡草為百合科延齡草屬植物延齡草Maxim.的干燥根及根莖,具有鎮靜安神、活血止血通絡等功效。臨床常用于治療高血壓、神經衰弱、眩暈頭痛及腦震蕩后遺癥等。甾體皂苷為延齡草的主要活性成分。藥理研究顯示,延齡草甾體皂苷(TSTT)能降低局灶性腦缺血大鼠梗死體積,減輕神經細胞損傷,改善腦血流灌注。但其抗腦缺血損傷的作用機制尚不明確。
星形膠質細胞是中樞神經系統數量最多、分布最廣的膠質細胞,對維持神經元結構和功能具有重要作用。腦缺血后,星形膠質細胞激活并大量增殖,活化的星形膠質細胞可攝取細胞毒性物質,維持中樞微環境穩定,并為神經元提供養分,保護神經元。縫隙連接蛋白43(Cx43)構成的半通道及縫隙連接是腦缺血后星形膠質細胞-神經元間信息傳遞及物質轉運的重要途徑。研究顯示,Wnt信號通路可調控星形膠質細胞縫隙連接蛋白,影響星形膠質細胞功能及神經元存活。本研究采用免疫熒光染色檢測大鼠缺血腦組織星形膠質細胞標志蛋白膠質纖維酸性蛋白(GFAP)和Cx43表達,分析TSTT對星形膠質細胞活化及縫隙連接通訊的影響,利用實時熒光定量PCR檢測Wnt3a和Dvl3基因表達,分析TSTT對Wnt3a/Dvl3信號通路的調控作用,探討TSTT保護神經元-星形膠質細胞的作用機制。
1 材料與方法
1.1 動物
8周齡SPF級雄性SD大鼠72只,體質量300~320 g,北京維通利華實驗動物技術有限公司提供,動物生產許可證號SCXK(京)2016-0011。飼養于首都醫科大學實驗動物中心,使用許可證號SYXK(京)2018-0003,飼養溫度20~25 ℃,相對濕度40%~50%,自由攝食飲水。適應性飼養1周后進行實驗。本實驗經首都醫科大學實驗動物倫理委員會審批(AEEI-2018-052)。
1.2 藥物及制備
延齡草藥材購自湖北恩施,由首都醫科大學中醫藥學院李佳副教授鑒定為百合科延齡草屬植物延齡草Maxim.的干燥根及根莖。TSTT由首都醫科大學中藥藥效物質基礎研究實驗室制備,每克提取物相當于原藥材16.55 g,使用時分別稱取65、33 mg TSTT用10 mL蒸餾水溶解。銀杏葉提取物片(金納多),40 mg/片,德國威瑪舒培博士藥廠,批號1380817,將60 mg金納多溶于10 mL蒸餾水,配制成濃度為6 mg/mL溶液。
1.3 主要試劑與儀器
無水乙醇(北京化工廠,批號B0301002),羊血清(北京中杉金橋有限公司,批號ZLI-9021),GFAP抗體(美國Millipore,貨號MAB360),Cx43抗體(英國Abcam,貨號ab66151),動物組織總RNA提取試劑盒、FastQuant cDNA第一鏈合成試劑盒、SuperReal熒光定量預混試劑(北京天根生化科技有限公司,貨號分別為DP431、KR106、FP205)。ASP300全自動脫水機(德國Leica),101-OAB電熱鼓風干燥箱(天津市泰斯特儀器有限公司),Mastercycler pro梯度PCR儀(德國Eppendrof),CFX Connect熒光定量PCR儀(美國Bio-Rad),Eclipse生物顯微鏡(日本Nikon),NIS-Elements Basic Research圖像采集分析系統(日本Nikon),HT7700透射電鏡(日本Hitachi)。
1.4 造模
參考文獻[8]采用線栓法建立大腦中動脈栓塞致局灶性腦缺血大鼠模型。60只大鼠經異氟烷(5%誘導、2%維持)麻醉后,仰臥位固定,頸正中皮膚消毒后切口,暴露右側頸總動脈、頸外動脈和頸內動脈,分離迷走神經。結扎頸總動脈和頸外動脈,動脈夾夾住頸內動脈遠心端,在頸總動脈分叉處剪一小口,將尼龍線圓鈍端插入頸內動脈,撤掉動脈夾,將尼龍線緩慢送入18~20 mm,有阻力感后停止進線,結扎動脈殘端,縫合皮膚。大鼠完全清醒后進行神經行為學觀察,出現左側肢體障礙者(不能完全伸展左前肢,行走時向左側傾倒或轉圈)納入實驗。另取12只大鼠作為假手術組,相同方法麻醉后,僅暴露動脈分支,不閉塞中動脈。
1.5 分組及給藥
造模過程中11只大鼠死亡、1只大鼠造模失敗,最終48只成模大鼠納入實驗。將成模大鼠隨機分為模型組、金納多組和TSTT低、高劑量組,每組12只。給藥劑量根據課題組前期研究結果確定,TSTT低、高劑量組分別予33、65 mg/kg TSTT溶液灌胃,金納多組予60 mg/kg金納多溶液灌胃,灌胃體積10 mL/kg,造模后2 h灌胃給藥1次,之后每24 h灌胃1次,連續15 d。假手術組和模型組灌胃等體積生理鹽水。
1.6 取材
每組隨機選取2只大鼠,異氟烷麻醉后用300 mL生理鹽水快速左心室灌注沖洗,4%多聚甲醛-2.5%戊二醛-0.1 mol/L磷酸鹽緩沖液心內灌注固定,灌注時間60 min,待大鼠固定完全后,斷頭取腦,切取缺血灶周圍1 mm×1 mm×1 mm組織,放入2.5%戊二醛中固定,用于電鏡觀察。
每組隨機選取5只大鼠,異氟烷麻醉后用300 mL生理鹽水快速左心室灌注沖洗,4%多聚甲醛心內灌注固定,灌注時間45 min,待大鼠固定完全后,斷頭取腦,置于4%多聚甲醛中4 ℃固定1周,切取大腦前囟-0.4~0.4 mm冠狀面組織,放入包埋盒中石蠟包埋,切取0.5 μm石蠟切片,用于免疫熒光染色。
每組隨機選取5只大鼠,異氟烷麻醉后斷頭處死,迅速剝離腦組織,分離缺血邊緣腦組織,放入液氮中,置于-80 ℃冰箱保存,用于實時熒光定量PCR檢測。
1.7 透射電鏡觀察
0.2 mol/L磷酸鹽緩沖液漂洗腦組織,24 h后鋨酸固定至組織完全變黑。脫水,包埋,烤箱加溫聚合,超薄切片機連續切片(100 nm),制備6~10張連續超薄切片,裱于獨眼銅網,對切片進行醋酸雙氧鈾和枸櫞酸鉛雙重染色,置于電鏡下觀察神經元和星形膠質細胞超微結構。
1.8 免疫熒光染色
石蠟切片置于烘箱中60 ℃烤片60 min,常規脫蠟水化,檸檬酸鹽緩沖液高熱修復抗原20 min,冷卻至室溫后用10%羊血清封閉60 min,加入GFAP(1∶600)和Cx43(1∶100)一抗,4 ℃孵育48 h,復溫后加入Alexa488-IgG(1∶300)和DyLight594-IgG(1∶200)二抗,37 ℃避光孵育120 min,DAPI封片,置于生物顯微鏡下觀察,圖像采集分析系統進行分析。在缺血邊緣皮層、紋狀體各選取3個視野,分別統計GFAP和Cx43陽性表達的積分光密度。
1.9 實時熒光定量PCR檢測
按試劑盒說明提取大鼠缺血邊緣腦組織總RNA,以總RNA為模板反轉錄合成cDNA,配制擴增反應體系混合液進行PCR。PCR反應條件:95 ℃預變性15 min,95 ℃變性10 s,共40個循環,52 ℃退火31 s,72 ℃延伸30 s。以β-actin為內參,采用2法計算目的基因相對表達量。引物由日本Takara公司合成,引物序列見表1。

表1 各基因PCR引物序列
1.10 統計學方法
采用SPSS21.0統計軟件進行分析。計量資料以±表示,方差齊用方差分析,組間比較用LSD檢驗,方差不齊采用Kruskal-Wallis非參數檢驗。<0.05表示差異有統計學意義。
2 結果
2.1 延齡草甾體皂苷對模型大鼠神經元和星形膠質細胞超微結構的影響
假手術組大鼠神經元形態規則,細胞核較大,核膜清晰,核仁明顯,染色質分布均勻,電子密度低,細胞質內可見多種細胞器;星形膠質細胞結構規則,胞核呈卵圓形,核膜清晰,染色質分布均勻,細胞器結構清晰完整。模型組大鼠神經元胞核明顯固縮,核膜不規則,核仁消失,染色質呈塊狀聚集在細胞核周圍,電子密度增加,細胞質內細胞器明顯減少、結構疏松,可見大量空泡;星形膠質細胞腫脹明顯,細胞核形狀不規則,核膜模糊,染色質消融,核周出現空白區,細胞器減少,結構疏松。與模型組比較,TSTT低、高劑量組和金納多組大鼠神經元和星形膠質細胞超微結構損傷明顯減輕。見圖1。
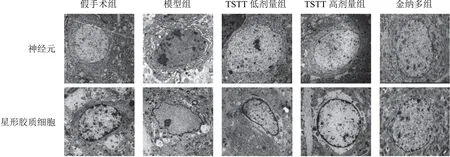
圖1 各組大鼠神經元和星形膠質細胞超微結構(×1 500)
2.2 延齡草甾體皂苷對模型大鼠缺血邊緣皮層、紋狀體膠質纖維酸性蛋白和縫隙連接蛋白43表達的影響
與假手術組比較,模型組大鼠缺血邊緣皮層、紋狀體GFAP和Cx43表達顯著升高(<0.01);與模型組比較,TSTT低、高劑量組和金納多組大鼠缺血邊緣皮層、紋狀體GFAP和Cx43表達顯著降低(<0.01)。見圖2、圖3、表2。
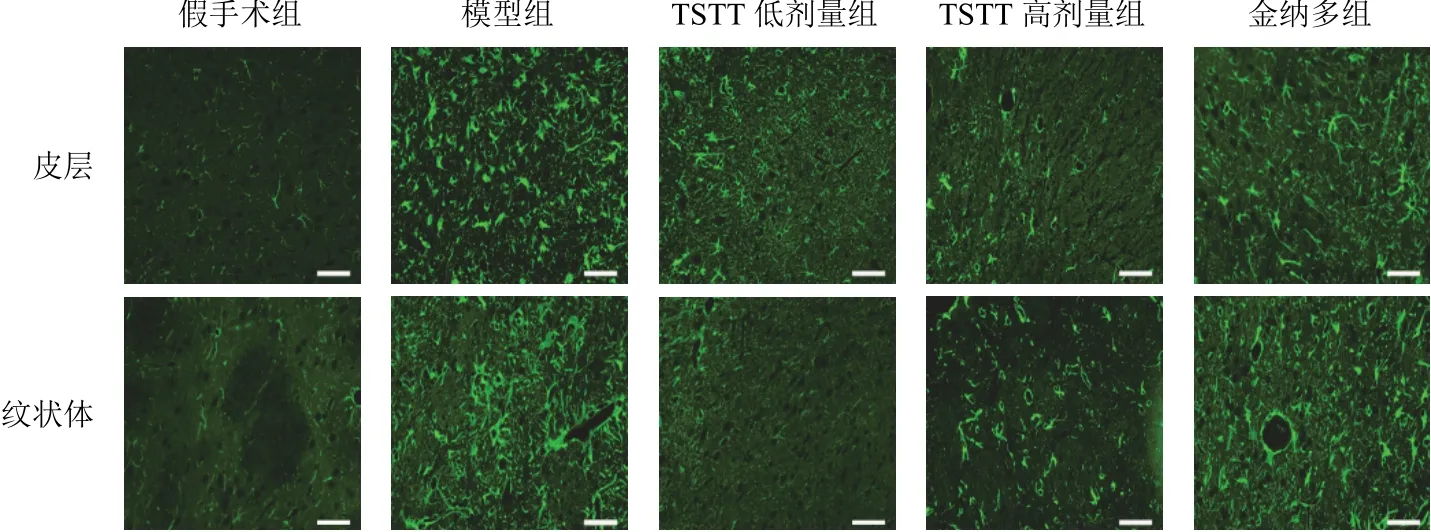
圖2 各組大鼠缺血邊緣皮層和紋狀體GFAP陽性表達(免疫熒光染色,標尺=50 μm)
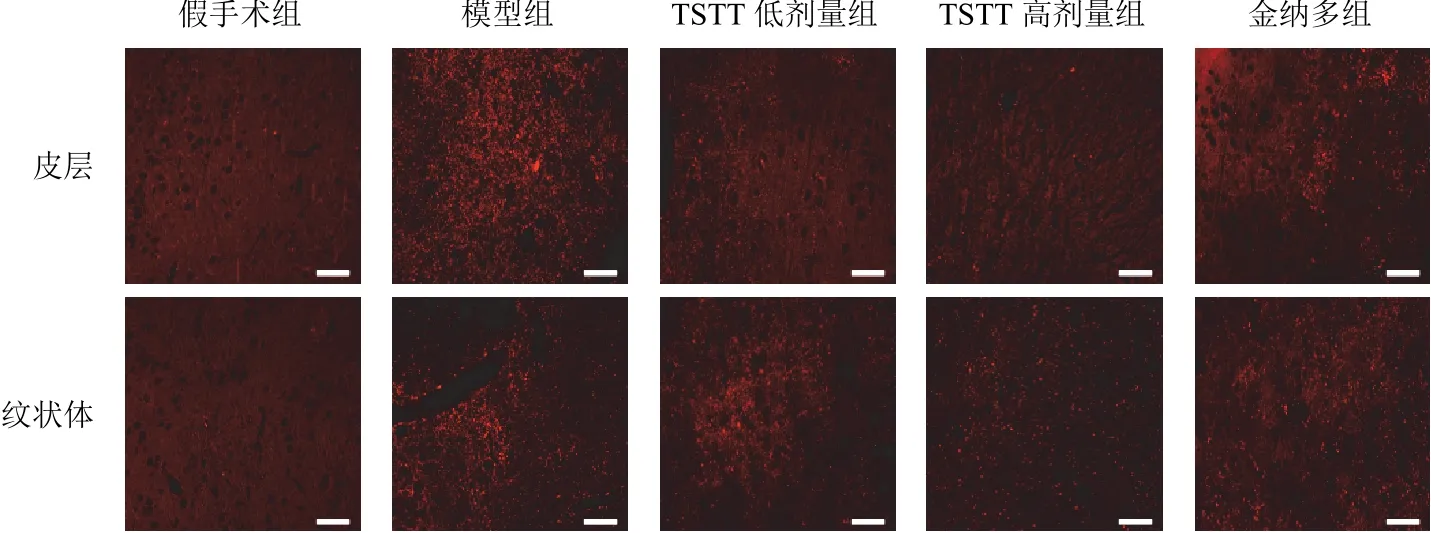
圖3 各組大鼠缺血邊緣皮層和紋狀體Cx43陽性表達(免疫熒光染色,標尺=50 μm)
表2 各組大鼠缺血邊緣皮層、紋狀體GFAP和Cx43表達比較(±s,積分光密度)
2.3 延齡草甾體皂苷對模型大鼠缺血邊緣腦組織Wnt3a、Dvl3基因表達的影響
與假手術組比較,模型組大鼠缺血邊緣腦組織Dvl3基因表達顯著降低(<0.01),Wnt3a基因表達有升高趨勢,但差異無統計學意義(>0.05);與模型組比較,TSTT高劑量組和金納多組大鼠缺血邊緣腦組織Wnt3a和Dvl3基因表達顯著升高(<0.05,<0.01),TSTT低劑量組大鼠缺血邊緣腦組織Dvl3基因表達顯著升高(<0.05)。結果見表3。
表3 各組大鼠缺血邊緣腦組織Wnt3a和Dvl3基因表達比較(±s)
3 討論
星形膠質細胞對維持神經元結構和功能至關重要,是治療腦缺血損傷的潛在靶點。腦缺血后,星形膠質細胞大量激活,呈肥大、增生樣改變。活化的星形膠質細胞對神經元具有雙重作用:一方面通過增加攝取谷氨酸、清除氧自由基以及分泌神經營養因子發揮神經元保護作用;另一方面也可誘導炎癥反應,促進神經細胞凋亡。因此,調節星形膠質細胞功能對維持神經元功能、促進腦卒中康復具有重要意義。
本研究利用透射電鏡觀察神經元和星形膠質細胞超微結構發現,模型組大鼠神經元出現核固縮、核仁消失,星形膠質細胞出現明顯腫脹、染色質消融等病理變化。免疫熒光染色結果顯示,模型組大鼠缺血邊緣皮層、紋狀體星形膠質細胞標志蛋白GFAP表達明顯升高,TSTT低、高劑量可以明顯減輕神經元和星形膠質細胞超微結構損傷,降低大鼠缺血邊緣皮層、紋狀體GFAP表達,提示TSTT可抑制腦缺血大鼠星形膠質細胞過度活化,減輕神經元損傷。
Cx43是星形膠質細胞最主要的縫隙連接蛋白,在星形膠質細胞間、星形膠質細胞-神經元間及細胞外環境間進行信息傳遞和物質運輸中具有重要作用。Cx43不僅向神經組織提供營養,維持細胞外離子平衡,還可調控離子和細胞擴散。研究顯示,Cx43是腦缺血損傷中的重要調節因子。腦缺血損傷后Cx43表達升高,促進星形膠質細胞通過縫隙連接釋放大量炎癥因子和趨化因子,加劇神經炎癥反應。同時,Cx43過表達會誘導谷氨酸受體激活,產生自由基,進一步作用于細胞膜生成脂質過氧化物,導致神經元死亡,造成大腦的不可逆性損傷。研究發現,通過藥物干預或Cx43抑制劑下調Cx43表達,可縮小腦梗死體積,保護神經元,促進神經功能康復。本實驗結果顯示,TSTT可下調大鼠缺血邊緣皮層、紋狀體Cx43表達,改變星形膠質細胞縫隙連接功能,對缺血腦組織發揮保護作用。
Wnt通路在真核生物中高度保守,對細胞增殖、遷移、凋亡和干細胞維持等具有重要作用。Wnt蛋白是Wnt通路的啟動因子,分為Wnt1和Wnt5a兩個亞族。Wnt3a是Wnt-1亞族的重要成員,可激活經典的Wnt通路。Wnt信號激活后,Wnt蛋白與七次跨膜受體卷曲蛋白或低密度脂蛋白受體相關蛋白家族結合,募集胞質中的散亂蛋白(Dvl)至胞膜附近,將信號傳至胞內,參與下游靶基因轉錄及表達的調控。研究發現,Wnt信號在星形膠質細胞生成和活化過程中扮演重要角色。Wnt3a可抑制星形膠質細胞活化,降低局灶性腦缺血大鼠缺血邊緣GFAP表達,減輕炎癥反應,且對Cx43蛋白表達具有廣泛的調控作用。本研究發現,模型組大鼠缺血邊緣腦組織Wnt3a基因表達較假手術組有升高趨勢,可能與腦內源性神經再生激活、神經前體細胞向神經元細胞及神經膠質細胞分化有關。TSTT可上調模型大鼠缺血邊緣腦組織Wnt3a和Dvl3基因表達,提示TSTT調控Wnt3a/Dvl3信號通路在抑制星形膠質細胞異常活化過程中發揮重要作用,其具體機制有待進一步研究。前期研究表明,延齡草甾體皂苷類成分能抑制局灶性腦缺血大鼠炎癥因子如腫瘤壞死因子α、白細胞介素-1β和白細胞介素-6釋放,抵抗超氧化物歧化酶和丙二醛氧化損傷,保護神經元。
綜上所述,TSTT可通過降低腦缺血大鼠缺血邊緣皮層、紋狀體GFAP和Cx43表達,上調缺血邊緣腦組織Wnt3a/Dvl3基因表達,抑制星形膠質細胞異常活化,減輕腦缺血大鼠神經元和星形膠質細胞超微結構損傷。

