扶正補血牛筋食療方對5-氟尿嘧啶所致骨髓抑制大鼠造血功能的影響
葉慧,郝曉蓓,汪旭,徐桂華,楊敏,潘婭嵐,王慶,許悅
(南京中醫藥大學,江蘇 南京 210023)
骨髓抑制是放化療后常見且嚴重的不良反應,具體表現為患者白細胞、血小板和血紅蛋白等血細胞減少,影響放化療療效和預后[1],目前尚缺乏針對性的理想治療藥物。近年來,中醫藥在緩解骨髓抑制中的有效性日益凸顯,大量研究驗證了不同中醫藥手段對其的療效[2]。扶正補血牛筋食療方是依據經典方當歸補血湯與課題組“扶正食療方”[3],結合中醫“精氣血”互生理論所研發的中醫食療方,由當歸、黃芪、黃精、牛蹄筋等中藥材與食材組成,具有益氣養血填精、固本培元的功效。基于此,本研究采用5-氟尿嘧啶(5-Fluorouracil,5-Fu)誘導大鼠化療后骨髓抑制模型,探討扶正補血牛筋食療方治療骨髓抑制的作用,為臨床應用中醫食療方改善骨髓抑制提供實驗依據。
1 材料與方法
1.1 動物
SPF 級雄性SD 大鼠48 只,8 周齡,體質量220~260 g,購自上海杰斯捷實驗動物有限公司,飼養于南京中醫藥大學實驗動物中心SPF 級動物中心,許可證號碼:SCXK(滬)2018-004,實驗動物合格證編號:2018000402381。大鼠均適應性喂養1 周,喂養期間自由飲水、攝食,室溫20~26 ℃,相對濕度40%~60%。本研究已經南京中醫藥大學動物實驗倫理委員會批準(批號:201910A018)。
1.2 藥品
1.2.1 扶正補血牛筋食療方制備
參照當歸補血湯配比、黃精與黃芪作用的最佳配比[4]及前期課題基礎[5],確定當歸∶黃芪∶黃精∶牛筋質量比例為1∶5∶2∶40。根據當歸補血湯人體用藥量(36 g/60 kg)[6]和動物與人之間等效劑量換算[7]得到扶正補血牛筋食療方的大鼠臨床等效劑量為5.04 g/kg,2倍劑量為10.08 g/kg。
制備過程:①取牛蹄筋一根(約800 g)洗凈切塊,放入普通常壓鍋中,加入適量水,大火煮沸,撈出洗凈浮沫后置回鍋內。加入1 800 mL清水,旺火煮沸后改用文火熬制2.5 h。②取當歸20 g,黃芪100 g,黃精40 g,加3 倍量水浸泡0.5 h 后加入牛筋湯內,先大火煮沸10 min,后改文火煎50 min。見牛筋軟爛,湯汁呈濃稠黃色,即可出鍋,置4 ℃過夜。③棄去上層油脂,解凍,過濾,旋蒸濃縮。將扶正補血牛筋食療方按劑量濃縮成0.504 g/mL 的常規生藥濃度(低劑量組)與1.008 g/mL的2倍劑量高濃度(高劑量組),分裝后4 ℃保存備用。
1.2.2 單純牛筋湯的制備
800 g 牛蹄筋洗凈斬塊,放入普通常壓鍋中,加入適量水,大火煮沸,撈出洗凈浮沫后置回鍋內。加入1 800 mL 清水,旺火煮沸后改用文火熬制2.5 h。見牛筋軟爛,湯汁呈乳白色,即可出鍋,置4 ℃過夜。棄去上層油脂,解凍,過濾,旋蒸濃縮。濃縮制成與高劑量食療方同樣濃度的牛筋湯,分裝后4 ℃保存備用。
1.2.3 鯊肝醇混懸液
按照12 mg/(mL·d)的濃度配制鯊肝醇溶于阿拉伯膠的混懸液[8],混勻后分裝,并于4 ℃保存備用。
1.3 主要試劑及儀器
主要試劑:5-氟尿嘧啶(美國Sigma-Aldrich 公司,批號:WXBD1215V);鯊肝醇(美國CSNpharm公司,批號:CSN10379-002);蘇木素、伊紅(武漢谷歌生物科技有限公司);無水乙醇、二甲苯(上海久億化學試劑有限公司)。
主要儀器:旋轉蒸發儀(型號:RE-52A,上海研承儀器有限公司);小動物麻醉機(型號:R500IP,深圳市瑞沃德生命科技有限公司);VetScan HM5 動物血細胞分析儀(型號:06/2014,美國ABAXIS);脫水機(型號:JJ-12J,武漢俊杰電子有限公司);石蠟包埋機(型號:JB-P5,武漢俊杰電子有限公司);石蠟超薄切片機(型號:RM2016,上海徠卡儀器有限公司);光學顯微鏡(型號:Nikon Eclipse CI,日本尼康)。
1.4 動物模型制備
大鼠適應性喂養1 周后,48 只大鼠依據隨機數字表隨機分為空白組8只和造模組40只。造模組參考文獻[9]及試劑說明書,按150 mg/kg 劑量尾靜脈注射5-氟尿嘧啶(用生理鹽水稀釋至10%濃度)造模。空白組尾靜脈注射等量生理鹽水。
1.5 分組及給藥
造模成功的40 只大鼠依據隨機數字表隨機分為模型組(僅造模)、陽性對照組(造模后給予鯊肝醇)、單純牛筋湯組(DN組,給予單純牛筋湯)、扶正補血牛筋食療方低劑量組(FZBXN-L組,給藥劑量為0.504 g/mL)、扶正補血牛筋食療方高劑量組(FZBXN-H組,給藥劑量為1.008 g/mL),每組8 只,各組大鼠均給予普通飼料。造模成功后14 d內,各組每天定時灌胃,灌胃前溶液復溫至37 ℃左右,灌胃量1 mL/100 g,同樣條件下正常組和造模組灌胃等量生理鹽水。
1.6 觀察指標及方法
1.6.1 外周血細胞計數檢測
于造模后24 h 和第5、10、15 天,對空白組、模型組大鼠進行眼眶取血,采用血細胞分析儀分別檢測外周血白細胞(WBC)、紅細胞(RBC)、血小板(PLT)計數與血紅蛋白(HGB)含量。造模后第15 天,對各組大鼠進行眼眶取血,并檢測外周血細胞計數結果。
1.6.2 免疫器官指數檢測
實驗結束后,頸椎脫臼處死大鼠,迅速摘取胸腺,剔除多余脂肪和結締組織,稱重,計算胸腺指數。
胸腺指數(%)=胸腺重量(g)/ 大鼠體重(g)×100%
1.6.3 骨髓病理檢查與脾結節計數
快速取各組大鼠的股骨和脾臟,新鮮組織于4%多聚甲醛中固定24 h 以上,進行脫水、包埋、切片、脫蠟、HE染色。將骨髓病理切片置顯微鏡下觀察組織病理學變化并拍照,同時在鏡下進行脾結節計數。
1.7 統計學方法
采用SPSS 22.0 進行統計學分析,數據描述用均數±標準差(±s)表示,不同時間點外周血細胞計數變化,采用重復測量方差分析,同一時間點各組之間的血細胞計數變化、脾結節計數、胸腺指數的多組間均數比較采用單因素方差分析,組間兩兩比較方差齊者用LSD 檢驗,方差不齊者采用Dunnett′s T3 檢驗。以P<0.05表示差異具有統計學意義。
2 結果
2.1 5-氟尿嘧啶誘導骨髓抑制模型大鼠的外周血細胞計數變化情況
動物造模后外周血細胞計數大致呈下降的趨勢,其中WBC、PLT、HGB 經一定時間干預后有恢復趨勢。WBC、PLT、HGB 在開始注射5-Fu 后第10天左右降到最低值,并在造模后15 d向模前水平趨近,造模后RBC呈現持續下降趨勢。見圖1。根據以上實驗結果,采用尾靜脈注射5-Fu方法制備化療后骨髓抑制模型,可以導致WBC、RBC、PLT、HGB 計數同時降低,提示造模成功。
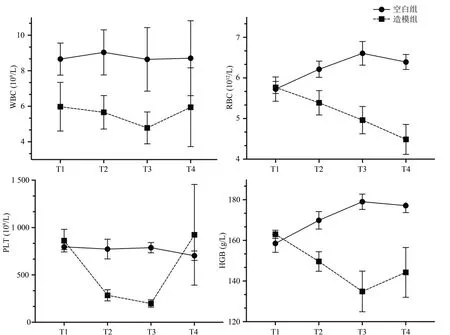
圖1 造模后大鼠外周血細胞計數的經時變化
2.2 各組大鼠外周血象檢測結果比較
干預結束后,與空白組比較,5-Fu 能顯著降低外周血中WBC、RBC、HGB(P<0.05,P<0.01),PLT 差異無統計學意義(P>0.05)。與模型組比較,陽性對照組外周血的WBC、RBC、PLT、HGB 顯著升高(P<0.05,P<0.01)。DN 組可以顯著提升WBC 計數(P<0.05),對RBC、PLT、HGB 存在一定升高趨勢,但差異無統計學意義(P>0.05)。FZBXN-L 組對促進WBC、PLT 升高有明顯作用(P<0.05,P<0.01),對升高RBC、HGB 計數有一定優勢,但無統計學意義(P>0.05)。FZBXN-H 組對提升WBC、RBC、PLT、HGB 數量有顯著作用(P<0.05,P<0.01)。見表1。
表1 各組大鼠外周血細胞計數情況比較(±s)
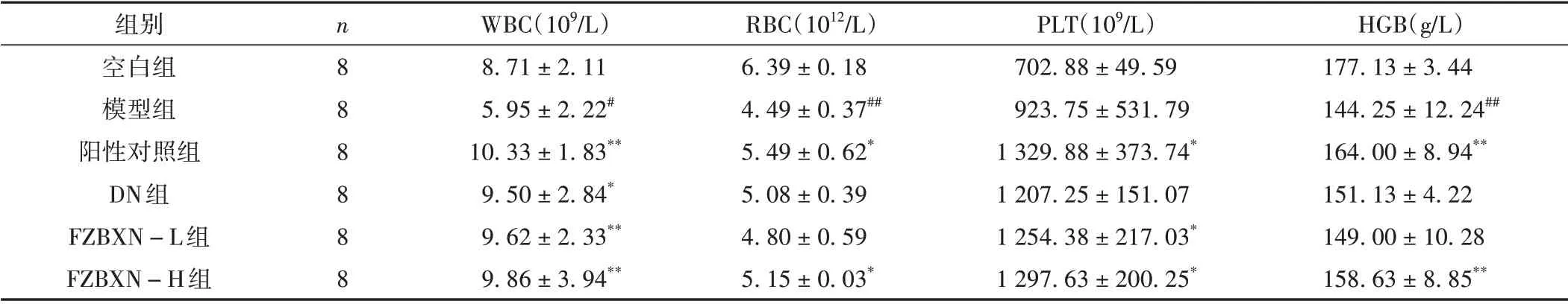
表1 各組大鼠外周血細胞計數情況比較(±s)
注:與空白組比較,#P<0.05,##P<0.01;與模型組比較,*P<0.05,**P<0.01。
HGB(g/L)177.13±3.44 144.25±12.24##164.00±8.94**151.13±4.22 149.00±10.28 158.63±8.85**組別空白組模型組陽性對照組DN組FZBXN-L組FZBXN-H組n8 8 8 8 8 8 WBC(109/L)8.71±2.11 5.95±2.22#10.33±1.83**9.50±2.84*9.62±2.33**9.86±3.94**RBC(1012/L)6.39±0.18 4.49±0.37##5.49±0.62*5.08±0.39 4.80±0.59 5.15±0.03*PLT(109/L)702.88±49.59 923.75±531.79 1 329.88±373.74*1 207.25±151.07 1 254.38±217.03*1 297.63±200.25*
2.3 各組大鼠脾結節計數、胸腺指數檢測結果比較
造模后第15 天,模型組大鼠的脾結節計數與胸腺指數顯著低于空白組(P<0.01,P<0.05)。相比模型組,陽性對照組、DN 組、FZBXN-L 組、FZBXN-H 組大鼠脾結節計數均顯著提升(P<0.01,P<0.05),并以高劑量扶正補血牛筋食療方的改善作用更為明顯。陽性對照組、FZBXN-L 組可以顯著提升大鼠胸腺指數(P<0.05),DN 組胸腺指數也有所增加,但與模型組相比差異無統計學意義(P>0.05)。見圖2。
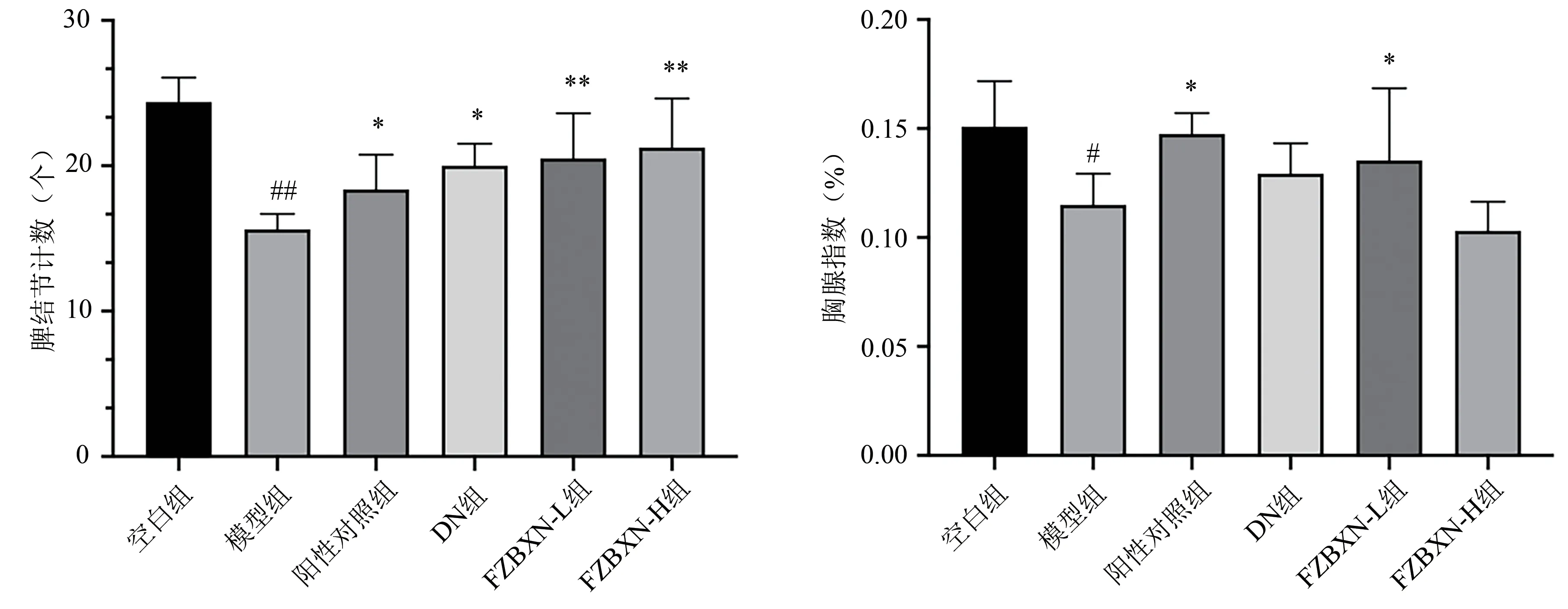
圖2 各組大鼠脾結節計數、胸腺指數的比較
2.4 各組大鼠骨髓組織形態學比較
光鏡下觀察空白組的細胞分布均勻且排列緊密,骨髓組織增生明顯活躍,造血組織占比高,脂肪組織占比少,巨核細胞清晰;模型組的骨髓組織增生減退,造血組織較空白組顯著減少,脂肪組織占比上升,巨核細胞顯著減少;陽性組的骨髓組織增生極度活躍,造血組織較模型組顯著提升,且脂肪組織占比小于10%,巨核細胞明顯增多;DN 組、FZBXN-L 組和FZBXN-H 組的骨髓組織均增生活躍,造血組織占比較模型組顯著提升,脂肪組織占比減少,巨核細胞增多。見圖3。

圖3 各組大鼠骨髓組織病理檢查結果的比較(HE染色,×200)
3 討論
作為人體主要的造血器官,骨髓為維持造血細胞行使其分裂增殖、分化造血、遷出歸巢等一系列功能提供了生態位[10-11]。有研究表明,化療藥物能通過誘導造血干細胞(HSCs)老化,抑制其自我更新與復制,引起骨髓基質細胞與相關血液循環產生過度應激反應,并損傷造血微環境,最終促使骨髓抑制的發生[12-14]。骨髓抑制是癌癥治療中最常見的并發癥之一,嚴重限制了抗腫瘤治療的耐受性。現代醫學通常采用注射粒細胞集落刺激因子(G-CSF)、促紅細胞生成刺激劑(ESA)和促血小板生成素(THPO),成分輸血、造血干細胞移植,口服升白細胞藥物(如鯊肝醇)等手段進行治療,且取得了一定的療效[15];但這些治療手段還存在藥物作用單一、具有潛在排異反應與感染風險、需反復用藥、療效欠佳、治療費用高昂等不足之處。
中醫藥方法在防治骨髓抑制方面療效顯著,且具有毒副作用小、價格相對低廉等優點,被越來越多的患者所接受[16]。骨髓抑制屬“血虛”“虛勞”“虛損”范疇,臨床治療主要以補虛、補氣、補血的中藥為主[17]。精、氣、血三者互生互化,維持機體的平衡。扶正補血牛筋食療方的組方配伍遵循中醫“精氣血互生”和藥食同源理論,由當歸補血湯加黃精與牛蹄筋配伍而成,包含當歸、黃芪、黃精和牛蹄筋。其中當歸具有補血和血之效,其主要成分可升高骨髓抑制小鼠血清中IgG、IgM含量,緩解不同程度骨髓抑制[18],拮抗骨髓間充質干細胞衰老[19];黃芪補中益氣,可以促進HSCs增殖[20]、延緩HSCs 衰老[21];黃精健脾益精,有促進外周血細胞計數恢復、改善造血器官、促進骨髓基質細胞增殖的作用[22-23];牛蹄筋既是食物也是藥材,入肝經,味甘性涼,為血肉有情之品,善補氣血,被清代《本草從新》記載具有“補肝強筋,益氣力,續絕傷”之效,有研究證明牛肉湯劑應用于腦缺血模型大鼠,可以減少腦缺血大鼠的腦梗死體積,調節外周免疫抑制,改善腦缺血大鼠受損的神經功能[24-26]。當歸、黃芪、黃精和牛蹄筋四者配伍共奏益氣養血填精、固本培元之功。
5-Fu 是目前常用的廣譜抗癌化療藥物,其治療作用機制為抑制胸苷酸合成酶,并將其代謝物摻入RNA 和DNA,破壞RNA 合成、導致DNA 片段化,從而使癌細胞凋亡或壞死[27]。5-Fu 在殺傷腫瘤細胞的同時,對造血系統有明顯的抑制作用。本實驗采用尾靜脈注射5-Fu制備大鼠骨髓抑制模型,實驗結果顯示,造模后,鼠外周血WBC、PLT、HGB 數量均呈現先下降后恢復趨勢,且在第10 天左右降至最低點,RBC 呈現持續下降趨勢。表明5-Fu 能使外周血象受到抑制,與骨髓抑制的臨床表現一致。
外周血象的改變是骨髓抑制的直接體現,本研究結果顯示,扶正補血牛筋食療方對受抑制的大鼠外周血象有明顯的改善作用,其中以高劑量組提升全血細胞效果最佳,提升效果接近或超過陽性藥物組。低劑量食療方可以顯著提升WBC、PLT 計數,單純牛筋湯可顯著提升WBC 計數,兩者對整體外周血細胞計數均存在一定改善趨勢。脾、胸腺和骨髓同屬機體的免疫器官,對建立正常免疫功能和修復受損的免疫功能起重要作用[28]。脾儲存血液,可調節循環血量和骨髓造血功能,維持血細胞動態平衡。骨髓具有特異性靶向性及放化療敏感性,通過分化干細胞參與血細胞的形成和受損造血器官的修復[29]。本研究結果顯示,扶正補血牛筋食療方與單純牛筋湯可以顯著提升脾結節計數,提示其對于受損的脾功能有改善作用,其中以高劑量食療方效果最佳;低劑量食療方表現出對胸腺指數的顯著改善作用;骨髓病理檢查結果還提示扶正補血牛筋食療方與單純牛筋湯有助于使骨髓造血面積回升、提升骨髓造血細胞數量。以上結果提示,扶正補血牛筋食療方對骨髓抑制大鼠的外周血細胞計數有直接改善作用,對重要的免疫器官、造血器官損傷有一定修復作用,且單純牛筋湯也展示出較好效果。
綜上,扶正補血牛筋食療方對大鼠骨髓抑制具有一定的治療作用,可顯著改善5-Fu誘導化療后骨髓抑制模型大鼠的骨髓造血功能。其作用機制可能與修復脾和胸腺等免疫和造血器官,改善骨髓造血微環境,并提升外周血中血細胞數量等有關。對于食療方作用靶點、分子層面的作用機制和相關通路仍需進一步探究。

