激素對H型血管的抑制作用與骨質疏松癥發病的探討
張鑫 張曉峰 徐西林 李小冬 李志剛 王政春 張寧
1.黑龍江中醫藥大學研究生院,黑龍江 哈爾濱 150040 2.黑龍江省中醫藥管理局,黑龍江 哈爾濱 150040 3.黑龍江中醫藥大學附屬第二醫院,黑龍江 哈爾濱 150040
骨質疏松癥是一種成因復雜的慢性代謝性骨病,其特征是骨組織微結構的惡化、骨量減少,導致骨的脆性增加和骨折的易感性[1]。根據國際骨質疏松基金會的最新統計[2],目前在世界范圍內骨質疏松癥的患者大約有2億多人。骨質疏松癥是一種無聲的疾病,在骨折發生前癥狀并不明顯,到骨折發生時就會導致嚴重的繼發健康問題,甚至死亡[3],給患者及其家庭乃至社會帶來巨大負擔,逐漸成為一個社會性問題。
骨質疏松癥分為原發性和繼發性骨質疏松癥,原發性骨質疏松癥多見于老年人和絕經后婦女,而繼發性骨質疏松癥最常見的病因之一則是糖皮質激素(glucocorticoid,GC)的使用[4]。使用GC治療疾病的同時其對骨骼的不良反應與骨質疏松癥的發生密切相關[5],雖然人們對糖皮質激素性骨質疏松癥(glucocorticoid induced osteoporosis,GIOP)的認識有所增加,但仍然還有很多機制尚未闡明[6]。H型血管的概念及其成骨成血管作用的提出為GIOP發病機制的研究提供了新的方向。GC通過抑制調控H型血管形成的因素[7]如血小板衍生生長因子BB (PDGF-BB)、軸突導向分子(SLIT3)、缺氧誘導因子1-α(HIF-1α)、血管內皮生長因子(VEGF)以及Notch信號通路等,抑制其成骨成血管作用而導致GIOP。故本文將GC抑制H型血管形成進而抑制其成骨成血管作用最終導致骨質疏松癥的可能機制系統綜述如下。
1 H型血管的成骨成血管偶聯作用
2014年Kusumbe等[7]提出一種新的與成骨相關的毛細血管亞型——H型血管,其主要表現為干骺端柱狀管、弓形和內膜內皮細胞CD31(也稱為PECAM1)和Emcn強陽性,因此將H型血管定義為CD31和內源性黏蛋白的高表達(CD31hiEmcnhi),其位于干骺端生長板以及骨干骨膜和骨內膜附近,被證實具有誘導骨形成的能力,在成骨和成血管偶聯過程中的作用至關重要[8]。
H型血管概念的提出將調控骨代謝的“二元”調控理論(成骨細胞和破骨細胞)發展豐富為“三元”調控理論(新生血管-成骨細胞-破骨細胞)[9]。H型血管是骨內特殊亞型,被表達轉錄因子Osterix+(一種有效的骨形成啟動子,可分化為成骨細胞和骨細胞)的骨祖細胞密集包圍。H型血管可以通過產生刺激骨髓中骨祖細胞增殖和分化的因子,積極地指導骨形成[10-11]。并且H型血管可以調節骨骼的血管密度,維持存在于骨骼血管周圍的骨祖細胞的活性,促進血管新生和骨形成。此外,H 型血管是骨再生重要的調控因素,具有調節成骨細胞分化促進骨形成的功能。骨骼特有的H 型血管將調節長骨生長、骨骼動態平衡的血管生成過程和H 型微血管內皮細胞分泌血管因子的過程聯系起來,這種骨生成和骨血管生成之間在時間與空間上的密切關系被稱為“成骨成血管偶聯”[12],是骨穩態調節的關鍵因素之一。Zhu等[13]認為H型內皮細胞支持骨成熟和再生,為接近特殊亞型血管的骨祖細胞提供營養,維持骨祖細胞的生長、增殖和骨的發育。
目前已知調控H型血管形成的因素包括[7]PDGF-BB、SLIT3、HIF-1α、VEGF、Notch信號通路以及其他潛在的因素等。正向刺激這些因素就可能促進H型血管的形成。反之,抑制這些因素就可能抑制H型血管形成,使其成骨成血管偶聯作用被限制,導致血管和骨生成減少,影響正常的骨代謝平衡而誘發骨質疏松癥。
2 GC抑制H型血管的生成
GC能夠抑制H型血管生成,抑制其成骨成血管偶聯作用。Peng等[14]發現GC處理小鼠股骨遠端時,H型血管受到顯著抑制,隨著時間的推移這種抑制作用更加明顯。GC首先損害H型血管成熟,并在長期暴露后損害血管生成。通過CD31hiEmcnhi血管長度的量化發現,H型血管在GC處理后第2、4和6周分別減少51%、21%和42%,延長GC給藥時間H型血管的生成被抑制的更為嚴重。此外,與對照組相比,GC使H型血管周圍表達轉錄因子Osterix+的骨祖細胞數量明顯減少。H型血管與Osterix+骨祖細胞的緊密結合使血管生成與骨生成緊密結合,而GC破壞了H型血管的穩定和成熟,抑制骨血管生成,導致骨形成減弱,與GIOP的發病密切相關。
至今已經確定了幾個因素可以調節H型血管的形成和成骨[14]:破骨細胞、成骨細胞、軟骨細胞和內皮細胞分泌的誘導內皮細胞增殖、血管聚集和穩定的因子,如PDGF-BB和SLIT3[9-10]等;ECs分泌的促進血管聚集、穩定和骨形成的因子,如HIF-1α、VEGF和Notch等。GC對H型血管的抑制作用已經明確,但是其具體機制尚未進行系統闡述,故本文第三部分從GC對調控H型血管形成因素的影響來闡述GC對H型血管生成的抑制作用。
3 GC對調控H型血管形成因素的影響
3.1 GC對PDGF-BB的影響
Xie等[9]發現CD31hiEmcnhi血管亞型(H型血管)的形成能夠被破骨前體細胞(POC)分泌的PDGF-BB誘導。POC是旁分泌PDGF-BB的主要來源,在骨建模和重構過程中,PDGF-BB招募內皮細胞形成H型血管,刺激1-磷酸鞘氨醇(S1P,鞘氨醇激酶1磷酸化的產物)的分泌,繼而刺激成骨細胞的分化和功能表達,促進骨形成,最終將骨膜環境中的血管生成與骨形成結合。
TRAP+細胞系中PDGF-BB的缺失會削弱其對H型血管形成的誘導作用,干擾血管生成與骨形成的耦合,減少骨髓和骨膜中的血管生成,從而減少骨形成[15]。Yang等[16]發現潑尼松龍給藥后的小鼠初級和次級松質骨內的H型內皮細胞和成骨細胞的數量均減少。Peng等[17]研究發現,GC暴露小鼠與對照組小鼠相比,PDGF-BB陽性的TRAP+細胞百分比在GC暴露2周時開始下降,在4周和6周時進一步下降。Jia等[18]認為過量的GC會抑制破骨細胞生成,不僅降低了POC的數量,而且降低了PDGF-BB的轉錄,提示GC可能通過抑制破骨-血管生成耦合因子而影響血管生成。Chung等[19]和Chow等[20]認為NF-kB信號通路與PDGF-BB的產生有關,是誘導PDGF-BB表達的必要條件。GC與胞漿中的GC受體(GR)結合,形成GC/GR復合體并轉運到細胞核調控基因轉錄。由于GC/GR的反抑制作用可由NF-kB或激活蛋白1 (AP-1)介導[21],因此,GR/NF-kB信號通路可能是GC抑制PDGF-BB的潛在機制。過量的潑尼松龍顯著降低核因子NF-kB (P65)與Pdgfb啟動子的結合和PDGF-BB的合成。POC是PDGF-BB形成內皮血管的主要來源,而PDGF-BB的合成被GR/NF-kB反抑制,則會進一步導致H型血管的形成被抑制。
近年來發現了一些化合物對PDGF-BB的合成有積極作用,進而促進H型血管的生成。這些化合物可以用來改善GC對PDGF-BB合成及H型血管生成的抑制作用,達到促進H型血管和骨生成治療GIOP的目的,但距離臨床應用還有待研究。如:核苷(Nuciferine,一種天然來源的生物活性化合物)[22]通過抑制絲裂原活化蛋白激酶保存TRAP+破骨細胞,減少多核破骨細胞的形成,使PDGF-BB 的濃度和H 型血管的數量增加。Harmine(一種β-卡波林生物堿)[23]可以增強POC分泌PDGF-BB,誘導H型血管的形成。Erk抑制劑NSC-87877[24]可以阻止POC分化為成熟的破骨細胞并增加PDGF-BB的產生,誘導H型血管的形成。此外,GIT1、卵磷脂以及駱駝蓬堿(一種β-Caroline 生物堿)都可以通過直接或間接調節破骨細胞以調控PDGF-BB的生成促進H型血管的成骨成血管偶聯作用。
3.2 GC對HIF-1α、VEGF的影響
在血管生成-成骨耦合的過程中,HIF-1α及其靶基因VEGF是關鍵的調控因子。HIF-1α受缺氧信號調控,機體缺氧時,HIF-1α表達增加,使促血管生長因子以及VEGF的表達增加,誘導血管內皮細胞增殖促進血管生成[25-27]。H型血管內皮細胞和骨祖細胞增殖與HIF-1α的表達水平呈正相關。另外,HIF-1α信號調控 Gli1+細胞也影響H型血管形成[28]。MSC亞群Gli1+細胞與H型血管形成耦合并調節H型血管生成。在骨缺損或骨折愈合早期,愈合區 Gli1+細胞明顯上調并引導H型血管形成。另一方面,VEGF作為HIF-1α的靶向基因,由HIF-1α直接調控,是最具特征的促血管生成因子,對血管生成有著不可替代的作用[29]。
HIF-1α在調節H型血管和骨形成過程中發揮關鍵作用,當HIF-1α的表達被抑制時H 型血管及骨形成同樣被抑制。Weinstein等[30]證明GC過量可抑制HIF-1α和VEGF的表達,影響血管體積和表面積。HIF-1α和VEGF的下調使特定H型血管亞型對骨細胞的營養和氧供應減少,影響其成血管成骨偶聯作用。Hata等[31]認為地塞米松對HIF-1α和HIF-1α-DNA結合活性均有明顯抑制作用,并降低低氧和TNF-α依賴性誘導的透明細胞VEGF的表達。Lim等[32]認為GC誘導亮氨酸鏈(GILZ)的表達,而GILZ抑制缺氧誘導的COX-2和HIF-1α的表達。地塞米松上調GILZ的表達不僅抑制了缺氧誘導的COX-2表達,而且抑制HIF-1α的表達阻斷了HIF-1通路。另一方面,GC抑制COX-2的表達,抑制了前列腺素E2 (PGE2)的產生。而PGE2是促進VEGF合成的關鍵物質,當PGE2的生成被抑制時VEGF的合成也被抑制[33-34]。因此,GC使HIF-1α及VEGF的表達均被抑制,阻礙了H型血管的生成,其成骨成血管偶聯的作用難以發揮而導致GIOP。
Whitaker等[35]發現甲磺酸去鐵胺(DFM)可以抑制脯氨酰-4-羥化酶對HIF-1α的降解,維持體內HIF-1α的水平,對H型血管生成有間接的促進作用。Gao等[36]通過研究發現川芎嗪局部給藥通過AMPK-mTORC-HIF-1α信號通路直接誘導衰老小鼠H型血管形成及改善骨穩態;Yang等[37]研究發現miR-497~195通過增強內皮Notch和HIF-1α活性誘導H型血管形成。Peng等[38]研究結果表明缺氧模擬劑二甲基草酰甘氨酸激活了HIF-1α信號通路,進一步激活了Wnt/β-catenin 信號通路,并增強了MSC成骨分化,促進血管生成和成骨作用。這些藥物及信號通路的發現對調控H型血管生成有重要意義,將來有可能是臨床治療GIOP新的藥物靶點。
3.3 GC對SLIT3的影響
SLIT3的主要來源仍有爭議,骨髓微環境中可能存在多種來源的SLIT3。成熟的成骨細胞和破骨細胞均可分泌SLIT3[7]。成骨細胞來源的SLIT3是誘導H型血管和骨形成強有力的調節因子,可以間接增加H型血管內皮細胞數量,是促進H型血管和骨形成的重要因素[15,39]。SLIT3基因缺失時骨骼H型血管內皮細胞減少,成骨細胞活性降低,骨形成減弱。
GC對SLIT3有無直接抑制作用繼而抑制H型血管的成骨成血管偶聯作用尚不明確。成骨細胞和破骨細胞均可分泌SLIT3,根據GC影響成骨細胞和破骨細胞分化的作用,有充分理由提出假設:GC通過抑制成骨細胞和破骨細胞的分化而抑制SLIT3的分泌,阻礙了H型血管的形成。但是該假設需要相關實驗進行驗證。GC對成骨細胞信號通路:如過氧化物酶體增殖激活受體γ2 (PPARγ2)、kruppel樣因子15 (KLF15)、CCAAT/增強子結合蛋白-α(C/EBPα)、脂肪細胞蛋白2 (aP2)和典型WNT信號通路等,有幾種直接影響[40-41]:GC上調PPARγ2、KLF15、C/EBPα和aP2導致多能前體細胞向脂肪細胞而不是成骨細胞分化,減少了成骨細胞數量。并且,高于生理劑量的GC不僅導致成骨細胞相關基因表達喪失和凋亡增加[42],也會抑制破骨細胞生成[20,43-44]。GC雖然可以提高破骨細胞的壽命,但是卻會使破骨細胞的骨架被破壞,導致破骨細胞的活性降低而影響其分泌SLIT 3。
直接注射SLIT 3的重組片段-LRRD 2,可以通過提高SLIT 3的表達進而調控H型血管的生成[7]。此外,對成骨細胞及破骨細胞的生成及活性進行靶向調控促進SLIT3的表達也有可能成為調控H型血管生成的有效途徑,但是仍需進一步研究。
3.4 GC對Notch信號通路的影響
Notch信號通路對血管發育和重構有重要的調節作用,其在成骨成血管偶聯中的重要作用也被Ramasamy等[11]證實。Notch 信號通路在體內骨骼系統成骨和血管生成過程中發揮著關鍵作用[45],也是調控MSC向成骨細胞分化的重要機制。Notch信號除了通過VEGF受體調節血管生成之外[46],還作用于H 亞型血管內皮細胞,使其增殖并分泌形態蛋白拮抗劑(Noggin)。Noggin能促進骨祖細胞的增殖、分化以及軟骨細胞的成熟、肥大。骨祖細胞和軟骨細胞均可分泌大量的VEGF誘導血管出芽,促進內皮細胞的成熟和血管形成。當Notch 信號增強時,H型血管、Runx+骨祖細胞的數量以及Noggin的分泌隨之增加。反之,在Notch 信號減弱時,H型血管、Runx+骨祖細胞的數量以及Noggin的分泌也隨之減少。因此,Notch 信號通路在連接H 型血管內皮細胞和成骨作用之間有著關鍵作用[46]。
任廣軍等[47]發現,Notch 受體和配體突變的小鼠骨內血管構建和軟骨細胞會發生異常。這些模型小鼠還會出現骨生成減少,骨小梁減少以及骨量缺失等變化。MSC的成骨分化可以被Notch 信號通絡所激活,但是細胞內成骨相關基因的表達在Notch 信號通路被阻斷后也隨之減弱[48]。徐瑩等[45]則通過實驗驗證了GC對Notch 信號通路的表達具有明顯的抑制作用。Notch 信號通路被抑制后,其連接H型血管內皮細胞和成骨分化的關鍵作用難以發揮而成為GIOP發生的潛在機制之一。
Notch信號可以被血流調節,H型血管直徑小,血流速度高,可刺激Notch信號的表達,而血流減少會降低對Notch信號的刺激使其表達降低,導致骨體積減少和血管生成缺陷[49]。以該理論作為基礎,可以通過探討GC對血流的影響從另一方面間接證明GC對notch信號的影響。GC導致骨內壓升高、脂肪栓塞、血管內皮細胞損傷、血液高凝狀態;誘導BMSC向脂肪細胞分化,導致骨內脂肪堆積,造成髓內血竇、毛細血管及靜脈受壓使血流受阻,引發微循環障礙,導致組織血流減少[50],血流速度減慢等。據此,可以科學地提出假設:GC導致血流減少和血流速度減慢等可能是導致notch信號減弱的另一原因。但該假設能否成立以及與GIOP的發病是否相關還需要進一步的研究來證實。
3.5 GC對其他影響H型血管形成潛在因素的影響
除了上述影響H型血管生成的因素外,還有一些潛在的因素對H型血管的生成有一定的影響。如糖原合成激酶3β(GSK-3β)通過其激酶活性作用,參與 Wnt信號通路,對成骨成血管進行調節[51];H型血管通過RANKL-RANK信號支持血管相關破骨細胞,而RANKL-RANK信號反過來調節H型血管的吻合[7];此外,基質金屬蛋白酶(MMPs)可調節細胞外基質,調節血管生長或退行,從H型ECs中釋放出來的MMP-9對于骨縱向生長過程中軟骨的吸收至關重要。已經可以明確的是GC可以抑制Wnt信號通路抑制GSK-3β對H型血管形成的促進作用而抑制H型血管的形成。但是,GC對上述其他可以調控H型血管形成因素的影響以及這些因素與GIOP的發病是否有關還需要進一步研究來明確。
4 GC抑制H型血管與骨質疏松癥
生理狀態下,機體內的骨形成與骨吸收處于微妙的動態平衡中,而骨質疏松癥的發生則是由于多種原因削弱了骨形成,增加了骨吸收,使骨形成與骨吸收的代謝失衡[52]。本文第一部分詳述了H型血管在血管和骨生成中的重要作用;第二部分說明了GC抑制H型血管的形成;第三部分詳述了與GC抑制H型血管形成相關的可能機制。將第一、二部分和第三部分結合起來,可以得出GC抑制H型血管形成,抑制其成骨成血管偶聯作用,使血管和骨生成減少,破壞骨代謝平衡導致骨質疏松癥發生的結論。見圖1。
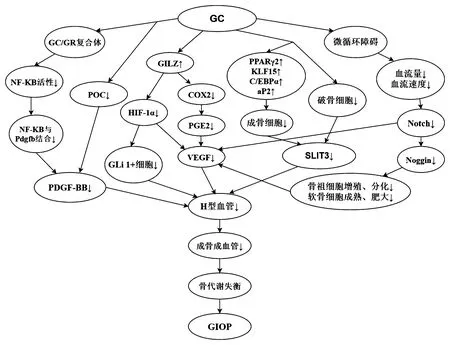
圖1 GC影響H血管導致GIOP發病的機制Fig.1 The mechanism of GC affecting H-type vessels leading to GIOP
H型血管調控的血管生成與成骨耦合對骨穩態至關重要。Nakashima等[53]認為H型內皮細胞可能有利于骨質疏松癥的治療。但是當H型內皮細胞被抑制時,其成骨成血管偶聯的作用難以發揮,隨之導致骨質疏松癥的發生。因此,GC對H型內皮細胞的抑制可能是GIOP發生的重要機制。王亮等[54]發現骨質疏松組患者的 H 型血管 CD31和 EMCN染色陽性極弱,且其H型血管分布呈點狀、竇狀,明顯較正常組稀疏、凌亂。骨質疏松組患者骨切片中H 型血管的面積與總血管面積的比值較對照組明顯降低。這些結果均能表明 H 型血管的面積與骨密度存在著密切關系,也進一步證明了 H 型血管的生成被抑制與骨質疏松癥的發病有著重要聯系。Kusumbe等[7]和Xie等[9]還發現,H 型血管與骨代謝之間存在著密切聯系,即“偶聯關系”。H 型血管減少后會使骨形成與骨吸收的代謝失衡,導致骨量下降,繼而引發骨質疏松癥,這被認為是對以往“骨量變化與成骨細胞和破骨細胞動態平衡、鈣丟失、維生素 D 減少相關”等骨質疏松發病理論的重大補充[55]。Wang等[56]報道,H型血管的豐度是老年人和骨質減少患者骨丟失的一個重要指標[13]。骨質疏松癥患者H型血管被骨祖細胞包圍,數量減少,這些發現具有直接的臨床意義。H型血管的豐度是骨丟失的早期標志,是通過誘導H型血管改善骨質量的潛在靶點。GC抑制了H型血管的形成,其成骨成血管偶聯作用被削弱,骨生成減弱,骨代謝的平衡被破壞,造成骨量丟失,最終誘發GIOP。
綜上所述,GC可以抑制破骨前體細胞釋放PDGF-BB、抑制HIF-1α、VEGF的表達以及抑制Notch信號通路等直接影響H型血管的生成。另外,通過閱讀大量文獻基于現有理論可以有根據地認為GC通過抑制成骨細胞和破骨細胞的分化抑制SLIT3的分泌,最終導致了在該通路上H型血管的生成被抑制。此外,還有一些其他影響H型血管生成的潛在因素如GSK-3β、RANKL-RANK信號、MMPs等,GC對這些影響H型血管生成潛在因素的作用以及這些因素被抑制與GIOP的發病是否相關仍需要進一步研究。
GIOP是使用GC治療疾病過程中一個棘手的并發癥,GC對H型血管生成的抑制作用,影響到其成骨成血管偶聯,導致血管生成和骨生成受到干擾,骨代謝的動態平衡被打破,是GIOP發病的重要因素。本文將GC對調控H型血管生成因素的作用進行了系統綜述,得出了GC抑制H型血管形成導致骨質疏松癥的結論。但是GIOP的機制復雜,目前還存在諸多假說,還需要進行更多的研究來明確。
目前大多數用于治療骨質疏松癥的藥物是骨吸收抑制劑和骨量穩定劑,存在著一定的局限性,難以達到理想的治療效果。因此,研究H型血管在GIOP中的作用是一個很有前途的方向。H 型血管可以促進成骨,對其成骨成血管耦聯的深入研究可以為血管-骨骼代謝相關疾病提供新的治療靶點,也為治療GIOP提供新的思路。

