早期宮頸癌(Ⅰa1~Ⅱa2)術后TLR4、HMGB1和RAGE水平對24個月腫瘤復發的預測價值
蔡玉茹 郭婧 楊紅玉 李楠 孫亞楠
宮頸癌是婦科第二大惡性腫瘤,是發展中國家女性癌癥死亡的主要原因,每年約30萬女性死于該病,且近年來發病率呈現年輕化的趨勢[1,2]。隨著女性保健意識的提高及早期篩查手段的普及,早期宮頸癌確診比例逐年上升。早期宮頸癌患者宮旁浸潤(parametrial involvement,PI)的發生率較低,以宮頸錐切術和宮頸根治術為主的綜合治療是主要針對性治療方案,其具有創傷小、恢復快且并發癥相對較少等優點[3],但術后復發仍就對患者生存率和生存質量產生重大影響。本次研究基于“腫瘤局部免疫狀態對其進展、侵襲轉移及預后均有著一定的預測診斷價值”的理論,共納入血清、腫瘤組織功能性蛋白三類,高遷移率族蛋白B1(high mobility group box ehromosomal-protein-1,HMGB1)屬于非組蛋白染色體結合蛋白,位于核小體內;現已被證實具有一定的警報素功能,即由壞死、損傷細胞釋放入細胞外,可起到內源性的危險信號活化天然免疫細胞的作用[4]。HMGB1被釋放入細胞外以后,對樹突狀細胞(dendritic cells,DC)具有一定的募集與活化作用,募集作用主要依靠晚期糖基化終末產物特異性受體(receptor for advanced glycation endproducts,RAGE),活化作用則依賴toll樣受體4(toll-like receptor-4,TLR4)介導,進而激活NF-kB通路、PI3K/AKT通路等多種途徑。本次研究由腫瘤組織及術后血清中功能性蛋白HMGB1、RAGE和TLR4水平出發,前瞻性評估研究指標對早期宮頸癌宮頸錐切術后24個月腫瘤復發的量化預測價值,分析其影響因素,為精準干預提供更多的依據。
1 資料與方法
1.1 一般資料 分析2016年3月至2019年6月于石家莊市人民醫院確診的早期宮頸癌患者175例,年齡26~56歲,平均年齡(49.26±5.75)歲;孕產數0~5胎;其中腺癌47例,鱗癌128例;樣本術后病理FIGO分期為Ⅰa期112例(Ⅰa1期33例,Ⅰa2期89例),Ⅰb期35例(Ⅰb1期18例,Ⅰb1期8例,Ⅰb2期9例),Ⅱa期28例(Ⅱa1期19例,Ⅱa2期9例);行宮頸錐切術85例(其中3例術前病理CIN3患者術后確診為Ⅰb1期,追加廣泛全子宮+盆腔淋巴結切除術),腹腔鏡輔助宮頸根治術90例。隨訪期限24月,隨訪截止期為2021年6月。
1.2 納入與排除標準
1.2.1 納入標準:①樣本均符合國際婦產科聯盟(FIGO)宮頸癌臨床分期及診斷相關標準(2018)[5];②病理確診為鱗癌、腺癌;③FIGO分期為1期④研究對象知情同意,自愿參加。
1.2.2 排除標準:①伴有其他重大器官、系統疾病的樣本;②合并宮腔疾病(宮腔或宮旁占位等)可能對本次研究結果造成影響的樣本;③排除鱗癌、腺癌、腺鱗癌以外的特殊病理類型;④凝血功能障礙;⑤非知情同意,依從性較差隨訪困難的樣本。
1.3 方法
1.3.1 宮頸錐切術:①常規消毒鋪巾,患者截石位充分暴露宮頸;②患者全身麻醉;③陰道鏡探查確定病變范圍;選擇合適規格的環形電刀(50 W);④環形電極由內向外順時針切除病變組織,切除范圍>病變范圍5 mm;⑤電極移動均勻緩慢,殘端宮頸進行1 cm預防性解除,球形電極電凝止血。
1.3.2 根治性宮頸切除術:①常規消毒鋪巾,插管全身麻醉,患者取截石位;②人工氣腹形成及穿刺管置入;③探查子宮與周圍組織毗鄰情況;連續切斷雙側卵巢盆腔漏斗韌帶(結扎法);④盆腔淋巴清掃;⑤子宮切口,膀胱反折、下推至宮頸外口下3 cm;⑤鈍性分離宮旁結締組織;⑥游離子宮動脈,結扎下行支;⑦依次打開膀胱、宮頸韌帶等,直至切開陰道壁并切下宮頸(宮頸外口下2 cm處);⑧術中冰凍活檢病理陰性患者,可于縫合前置入T型宮內節育器,陰道殘端縫合。
1.4 觀察指標 輔助檢查資料包括術后血清及腫瘤組織中HMGB1、RAGE和TLR4水平,臨床、病理資料包括:腫瘤類型、腫瘤大小、切緣情況、間質浸潤情況、淋巴轉移情況、FIGO分期。刪失數據(censoring data)生存分析研究結束期,樣本發生研究之外的其他事件或生存結局,因此無法對研究結局事件進行觀察與記錄。刪失原因包括失訪、研究對象不配合或研究對象出現研究以外因素的死亡等。診斷臨界值為曲線中約登指數最大的界點,約登指數=(靈敏度+特異度-1)。
1.4.1 儀器與試劑
1.4.1.1 儀器:①酶聯免疫分析儀(JD-SY96A,山東競道光電科技有限公司);②光學顯微鏡(CX23,奧林巴斯);③旋轉石蠟切片機(CUT4062,德國SLEE);④病理石蠟包埋冷臺機(LS-101,上海寰熙醫療器械有限公司)⑤電熱恒溫干燥箱(昆山海達精密儀器有限公司)等。
1.4.1.2 試劑:一抗兔抗人HMGB1、RAGE和TLR4多克隆抗體(美國 Abcam 公司),辣根過氧化物酶、蘇木紫染色劑、乙醇、檸檬酸緩沖液等。
1.4.2 腫瘤組織HMGB1、RAGE和TLR4水平檢測:①標本由4%甲醛液固定,常規脫水、石蠟包埋、12點連續切片(厚度4 μm);②按步驟及要求時限進行相應的脫蠟、浸洗、PBS清洗以及孵育過程,最終染色封片;③上光學顯微鏡,每張切片隨機選取15個視野取均值。④結果判定:按照染色強度及細胞陽性率,對結果進行0~6評分。陽性細胞構成比<10%、10%~40%、40%~70%以及>70%賦值0、1、2和3分;染色強度以“無染色”、“高倍鏡下陽性而低倍鏡下陰性”、“低倍鏡下陽性”和“低倍鏡下強陽”性依次賦值0、1、2和3分。以15個視野兩項評分乘積均值作為最終評估依據,<3分、4~5分、6~8分和9分依次判定為不表達、低表達、中表達和高表達[6,7]。
1.4.3 血清HMGB1、RAGE和TLR4水平檢測:取術后第2天晨起空腹靜脈血4 ml,肝素抗凝,3 000 r/min離心10 min;取上清如低溫冰箱保存(-80℃),避免樣本反復凍融。上酶聯免疫分析儀以酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)檢測樣本術后血清中TLR4、HMGB1和RAGE水平。
1.4.4 隨訪:12個月隨訪期限內每3個月行相關復查;連續復查4次皆為陰性的患者可改為6個月復查1次,隨訪截止期為2021年6月。
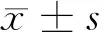
2 結果
2.1 2組術后血清HMGB1、RAGE和TLR4 水平比較 24個月隨訪時限結束,得到復發樣本37例,非復發樣本134例(失訪4例),術后樣本血清HMGB1水平為正態性計量資料(Kolmogorov-SmirnovZ=0.761,P=0.609)、RAGE(Kolmogorov-SmirnovZ=0.904,P=0.387)和TLR4(Kolmogorov-SmirnovZ=1.371,P=0.047) 水平為非正態性計量資料,以復發情況進行分組,組間術后血清功能性蛋白水平比較,得到HMGB1、RAGE和TLR4 水平差異均有統計學意義(P<0.05)。見表1。

表1 2組術后血清HMGB1、RAGE和TLR4 水平比較 n=114
2.2 ROC曲線分析
2.2.1 血清HMGB1、RAGE和TLR4曲線下面積分別為0.813、0.802和0.865,預測診斷臨界值分別為0.822、0.751和0.861。見表2,圖1。

表2 術后血清多種功能蛋白水平對宮頸癌術后24個月復發情況量化性預測價值的ROC曲線分析

圖1 術后血清HMGB1、RAGE和TLR4 水平對24個月期宮頸癌復發的量化預測診斷價值
2.2.2 進一步計算預測診斷臨界值,血清HMGB1、RAGE和TLR4診斷臨界值分別為0.73 ng/ml、188 pg/ml和24.88 pg/ml。其中血清RAGE診斷臨界值的特異度偏低(49.50)。見表3。

表3 血清HMGB1、RAGE和TLR4診斷臨界值
2.2.3 因曲線個別部位存在交叉,進一步兩兩比較得到,血清RAGE和TLR4的ROC曲線診斷價值存在差異(P<0.05)。見表4。

表4 血清HMGB1、RAGE和TLR4曲線診斷價值比較
2.3 生存分析
2.3.1 結合前瞻性隨訪復查評估腫瘤組織功能性蛋白表達對早期宮頸癌(Ⅰa1~Ⅱa2)術后“非復發狀態”時間分布的擬合能力:按照術后組織相關研究功能蛋白細胞表達水平,將樣本分成2組,無表達與低表達樣本合并組成“陰性組”,中表達與高表達樣本合并組成“陽性組”。見表5。

表5 樣本研究時限內宮頸癌復發、刪失率 n=175,例(%)
2.3.2 Kaplan-Meier生存分析法評估體重控制對妊娠期糖尿病干預效果的分析:Kaplan-Meier生存分析,以Log Rank test得到,以不同組織功能性蛋白分組后,陰性組“非復發狀態”持續的時間均長于陽性組,差異有統計學意義(P<0.05)。由于樣本宮頸癌復發率低于50%,故研究結果不涉及生存表中位數分析。見表6,圖2~4。

表6 Kaplan-Meier生存分析法評估體重控制對妊娠期糖尿病干預效果的分析

圖2 Kaplan-Meier生存分析法評估腫瘤組織HMGB1水平對宮頸癌復發的時間分布擬合效能 圖3 Kaplan-Meier生存分析法評估腫瘤組織RAGE水平對宮頸癌復發的時間分布擬合效能 圖4 Kaplan-Meier生存分析法評估腫瘤組織TLR4水平對宮頸癌復發的時間分布擬合效能
2.4 早期宮頸癌術后復發的多因素Cox風險比例回歸模型分析
2.4.1 模型變量賦值:根據單因素KM分析結果,將上述3種組織功能性蛋白均帶入多因素COX分析中,參考相關文獻[8,9],另外加入腫瘤類型、腫瘤大小、FIGO分期、淋巴結轉移和深層間質浸潤、切緣狀態6項,共9項協變量進入 Cox風險比例回歸模型。見表7、8。

表7 COX風險比例模型因素分類變量賦值(1)

表8 COX風險比例模型因素賦值(2)
2.4.2 Cox風險比例回歸模型分析:協變量分別為TLR4、術后FIGO病理分期、切緣狀態、淋巴轉移以及深層間質浸潤,偏回歸系數(β)分別為1.812、2.982、1.963、1.919、1.209。見表9,圖5。

表9 早期宮頸癌術后復發的多因素Cox風險比例回歸模型分析

圖5 協變量均值處的“非復發”生存函數
3 討論
HMGB1作為重要的晚期炎性因子,對炎癥的維持與放大具有重要作用[10-13]。RAGE屬于多配體的跨膜信號轉導受體,相關研究顯示,其與炎性反應、腫瘤侵襲力、神經血管再生等均存在關聯[14,15]。TLR4屬于TLRs家族跨膜非催化性蛋白質,參與非特異性免疫,于髓源性細胞上表達,可識別革蘭氏陰性菌脂多糖(LPS)、宿主壞死細胞釋放產生的休克蛋白等,還可被局部內源性酶級聯活化反應等激活[16]。TLR4過表達,可激活形成TLR4-MD2-LPS二聚體復合物,啟動相關的促炎性細胞因子、趨化因子和miRNA的下游信號途徑。因此,越來越多的研究顯示,TLR4的炎性表達,對調節腫瘤周圍的炎性環境和腫瘤進展有著不可忽視的作用[17,18]。本次研究選取宮頸癌早期(Ⅰa1~Ⅱa2)患者為研究樣本,樣本均行宮頸錐切術或根治術治療,以血清及腫瘤組織中HMGB1、RAGE和TLR4為主要評估指標;根據以往文獻研究結果得到,宮頸癌高復發期為1~2年[19],故本次研究跟蹤隨訪期定為24個月。ROC曲線分析結果顯示,術后血清中HMGB和TLR4對24個月期宮頸癌復發具有一定的量化預測診斷價值,曲線下面積分別達到0.824和0.860;RAGE的ROC曲線較TLR4診斷價值偏低。血清HMGB和TLR4診斷臨界值分別為0.73 ng/ml和24.88 pg/ml,且靈敏度、特異度均達到70%以上,其中TLR4診斷臨界值靈敏度為86.49%,對早期篩查意義較高;而RAGE診斷臨界值為188 pg/ml,靈敏度為91.89%,雖然特異度僅為49.50%,但對于早期篩查對于敏感性的較高要求,其血清水平仍舊具有一定的意義。可結合相應的預測診斷臨界值,進行早期重點干預。
Cox風險比例回歸模型屬于半參數回歸模型,用以描述不隨時間變化的多個因素對某一時間某事件發生率的影響[20]。本次研究將腫瘤組織HMGB1、RAGE和TLR4的表達水平連同其他熱點研究因素共9項,作為協變量進入Cox風險比例回歸模型進行分析,結合時間因素,得到影響宮頸癌復發的協變量分別為TLR4、術后FIGO病理分期、切緣狀態、淋巴轉移以及深層間質浸潤。HMGB1和RAGE由于與TLR4激活炎性反應通路作用上具有交互性,在多因素分析中并沒有表現出差異有統計學意義;另外FIGO病理分期較高、切緣陽性、存在淋巴轉移及深層間質浸潤的患者,其復發風險更高。
因此可得,早期宮頸癌(Ⅰa1~Ⅱa2)患者術后血清及腫瘤組織中HMGB1、RAGE和TLR4水平對腫瘤復發、復發時限等均具有一定的定性及定量診斷價值,可結合臨床、病理表現,對高風險樣本進行重點檢測干預;對宮頸癌宮頸錐切術及根治術術后判斷預后,具有一定的意義。

