LncRNA CYTOR靶向Wnt/β-catenin通路促進口腔鱗狀細胞癌生長的機制研究
米 磊, 苗 輝, 徐 揚, 王永華, 慕彩琴, 徐建華
(陜西省榆林市第一醫院口腔科, 陜西 榆林 719000)
口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)作為頭頸部鱗狀細胞癌(head and neck squamous cell carcinoma,HNSCC)的主要侵襲形式,其發病率和死亡率已居世界第六位[1]。手術切除和放療是目前治療OSCC最有效的兩種方法,但治療效果仍不理想[2]。據癌癥數據統計顯示,晚期OSCC患者的五年生存率不到50%,而腫瘤的頻繁復發和遠處轉移是導致OSCC相關死亡的主要原因[3]。因此尋找有效的OSCC早期診斷因子,甚至尋找新的治療靶點來對抗OSCC發展都將具有重要的臨床意義。長鏈非編碼RNA(long non-coding RNA,lncRNA)是一類轉錄長度超過200 nt的且不具備蛋白編碼功能的RNA分子[4]。在OSCC中,lncRNAs可作為抑癌基因或促癌基因參與調控OSCC細胞的生長,提示了其在OSCC中異常表達的lncRNAs可能成為診斷和治療該疾病的重要靶標[5,6]。LncRNA CYTOR已被證實在包括胃癌和膽囊癌在內的多種癌癥類型中表達異常,且可以通過調控細胞增殖、遷移和侵襲發揮促癌作用[7]。此外lncRNA CYTOR還可通過海綿miR-3148參與FOX1介導的OSCC化療耐藥。然而,lncRNA CYTOR在OSCC中的表達及具體作用仍需進一步研究。本研究以OSCC細胞為研究對象,通過觀察lncRNA CYTOR對OSCC細胞增殖,遷移和侵襲的影響及潛在調控通路,旨在揭示lncRNA CYTOR在OSCC發展過程中的具體作用,以及為OSCC的靶向治療提供新的思路。
1 材料與方法
1.1材料:人正常口腔角質形成細胞株(NHOK)和OSCC細胞株(Tca8113、CAL27、SCC9和SCC25)購買自美國ATCC;DMEM/F12細胞培養基、10%胎牛血清、1%青霉素-鏈霉素、0.25%胰蛋白酶、RIPA細胞裂解液和TRIzol試劑購買自美國Gibco公司;Transwell小室(8μm)和Matrigel基質膠購買自美國BD Falcon公司;CCK-8細胞活性檢測試劑盒、EdU細胞增殖檢測試劑盒和BCA蛋白定量試劑盒購買自上海碧云天生物科技有限公司;cDNA反轉錄試劑盒Prism ScriptTMRT Reagent kit和PCR熒光定量試劑盒SYBR Green qPCR Master Mix購買自日本Toyobo公司;siRNA-lncRNA CYTOR及其陰性對照siRNA-NC質粒合成自上海漢恒生物公司;一抗PCNA、Ki-67、c-myc、cyclin D1、β-catenin和GAPDH購買自美國Abcam公司;辣根過氧化酶標記的二抗購買自北京中山生物技術公司;PCR引物合成自上海生工有限公司合成;其他常見分子生物學相關試劑與耗材購買自美國Thermo Fisher Scientific公司。
1.2方 法
1.2.1細胞培養:正常口腔細胞(NHOK)和口腔鱗狀細胞癌細胞(Tca8113、CAL27、SCC9和SCC25)均用含10%胎牛血清、100U/mL青霉素和100mg/mL鏈霉素的DMEM/F12細胞培養基進行培養。加濕培養箱條件為95%相對濕度,5%CO2和37℃。對數期生長的細胞被收集起來用于后續實驗研究。后續細胞相關實驗重復3次,統計結果取平均值。
1.2.2細胞轉染:將CYTOR表達水平最高的CAL27細胞作為轉染對象。對數期CAL27細胞按照4×105個/孔的密度接種在6孔板中,并隨機分為Control組、si-CYTOR組和si-NC組。當CAL27細胞融合度達到80%以上時,利用脂質體3000轉染試劑將si-CYTOR和si-NC質粒分別轉染到si-CYTOR組細胞和si-NC組細胞,Control組細胞不做任何處理。轉染48h后,RT-qPCR用于檢測CYTOR表達以驗證細胞轉染效率。
1.2.3RT-qPCR實驗檢測細胞lncRNA CYTOR mRNA表達:通過使用TRIzol試劑從轉染后的CAL27細胞中提取總RNA。經純化后,利用cDNA反轉錄試劑盒Prism ScriptTMRT Reagent kit將純化的RNA逆轉錄為cDNA。隨后,嚴格按照PCR熒光定量試劑盒SYBR Green qPCR Master Mix操作說明,在ABI 7300實時PCR檢測系統上實施PCR反應。以GAPDH作為內參基因,通過2-△△Ct方法對lncRNA CYTOR基因的相對表達進行統計分析。引物序列如下所示:lncRNA CYTOR引物序列,F:5′-AGAATGAAGGCTGAGGTGTG-3′和R:5′-CAGCGACCATCCAGTCATTTA-5′;GAPDH引物序列,F:5′-GAAGGTGAAGGTCGGAGTC-3′和R:5′-GAAGATGGTGATGGGATTTC-3′。
1.2.4CCK-8、克隆形成和EdU染色實驗檢測細胞增殖:CCK-8法:將轉染后的CAL27細胞按照2×103個/孔的密度接種于96孔板中。在常規培養0、24、48和72和96h加入10μL的CCK-8溶液繼續培養2h。用自動酶標儀檢測各孔在450nm處的光密度(OD)以表示細胞存活率。克隆形成:將轉染后的CAL27細胞按照1×103個/孔的密度接種到6孔板中常規培養2周。培養結束后先用4%甲醇固定細胞,隨后用0.1%結晶紫對細胞形成的菌落進行染色。用光學顯微鏡觀察并計數直徑大于100μm的細胞集落數。EdU染色:將轉染后的CAL27細胞按照2×104個/孔的密度接種在96孔板中常規培養24h。將100μL EdU溶液加入96孔板中與細胞共孵育2h,然后加入固定液繼續孵育15min。細胞經PBS洗滌后,加入熒光標記的EdU反應混合物孵育30min。孵育完成后,用激光共聚焦熒光顯微鏡對染色細胞進行拍照觀察。EdU陽性細胞比例(%)=陽性細胞數/總細胞數×100%。
1.2.5Transwell實驗檢測細胞遷移和侵襲:細胞通過孔徑為8μm的Transwell小室進行侵襲。將轉染后的CAL27細胞制成1×105個/mL的懸液并將200μL不含胎牛血清的細胞懸液填充在鋪滿Matrigel基質膠的上室中。下室填充600μL的含10%胎牛血清的細胞懸液。常規孵育24h后,用PBS洗滌細胞3次后,在室溫下用4%冷甲醇固定細胞30min,然后用0.1%結晶紫對細胞進行染色處理15min。染色后的細胞在光學顯微鏡下拍照觀察。在細胞遷移試驗中,Transwell上室中沒有Matrigel涂層,其他步驟與侵襲步驟保持一致。
1.2.6Western blot實驗檢測PCNA、Ki-67、c-myc、cyclin D1和β-catenin蛋白表達:通過RIPA裂解緩沖液裂解轉染后的CAL27細胞后,用BCA蛋白定量分析試劑盒檢測CAL27細胞提取蛋白的濃度。隨后,蛋白樣品經10% SDS-PAGE分離后轉移到PVDF膜上。用10%的脫脂奶粉對膜蛋白進行封閉操作1.5h后,與相應的一抗PCNA(1∶2,000;ab18197;Abcam)、Ki-67(1∶1,000;ab15580;Abcam)、c-myc(1∶5,000;ab39688;Abcam)、cyclinD1(1∶5,000;ab15196;Abcam)、β-catenin(1∶5000;ab32572;Abcam)和GAPDH(1∶1,000;ab14247;Abcam)在4℃下過夜孵育,隨后再與相應的二抗(1∶2,000;ab6877;Abcam)共孵育4h。用ECL化學發光檢測試劑盒檢測蛋白條帶。收集的蛋白條帶用Image J軟件進行歸一化和量化處理。
1.3統計學分析:采用SPSS22.0軟件分析數據。采用t檢驗或單因素方差(one-way ANOVA)分析結果。P<0.05被認為差異具有統計學意義。
2 結 果
2.1LncRNA CYTOR在正常NHOK細胞和OSCC細胞中的表達:如圖1A所示,相比較正常NHOK細胞,CYTOR在OSCC細胞(Tca8113、CAL27、SCC9和SCC25)中的表達顯著升高(P<0.01)。其中,CAL27細胞中的CYTOR表達最高,因此CAL27細胞被篩選用于后續實驗研究。同時,利用特異性siRNA下調CYTOR的表達。如圖1B所示,相比較si-NC組,CYTOR在si-CYTOR組細胞中的表達顯著降低(P<0.01),提示了細胞轉染成功。上述結果表明CYTOR在OSCC細胞中的異常表達可能對OSCC發生發展產生重要調控作用。
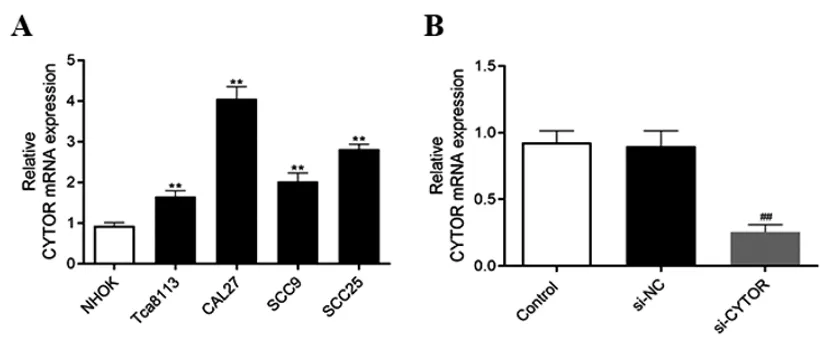
圖1 LncRNA CYTOR在正常NHOK細胞和OSCC細胞中的表達
2.2下調lncRNA CYTOR表達對CAL27細胞增殖能力的影響:如圖2A所示,相比較si-NC組,si-CYTOR組細胞的細胞活性明顯下降。在72h時,si-CYTOR組細胞的活性相比較si-NC組細胞具有顯著性差異(P<0.01)。如圖2B所示,相比較si-NC組,si-CYTOR組細胞形成的集落數目顯著減少(P<0.01)。如圖2C所示,相比較si-NC組,si-CYTOR組EdU陽性細胞比例顯著減少(P<0.01)。最后,如圖2D所示,相比較si-NC組,增殖相關蛋白(PCNA和Ki-67)在si-CYTOR組細胞中的表達顯著降低(P<0.01)。上述結果表明抑制CYTOR表達后,CAL27細胞的增殖能力受到明顯抑制。
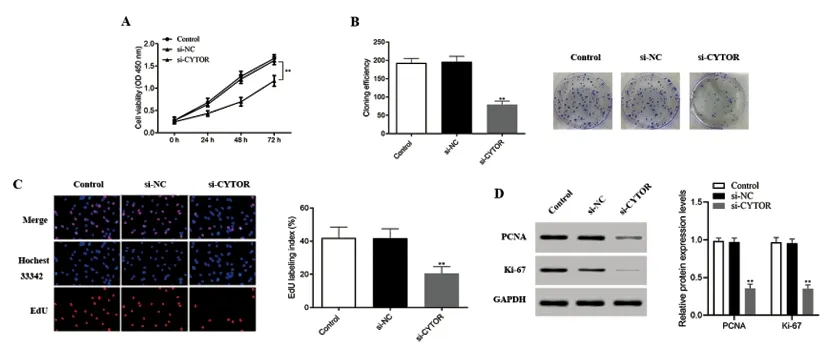
圖2 下調lncRNA CYTOR表達對CAL27細胞增殖能力的影響
2.3下調lncRNA CYTOR表達對CAL27細胞遷移和侵襲能力的影響:如圖3A所示,相比較si-NC組,si-CYTOR組細胞的遷移能力明顯減弱(P<0.01)。同時,如圖3B所示,相比較si-NC組,si-CYTOR組細胞的侵襲能力也明顯減弱(P<0.01)。上述結果表明,抑制CYTOR表達后,CAL27細胞的遷移和侵襲能力明顯下降。
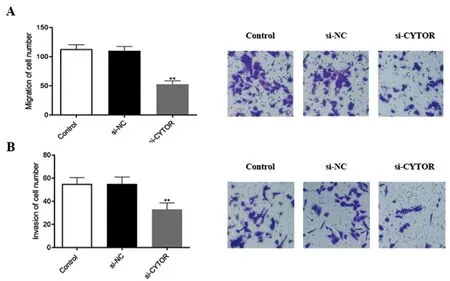
圖3 下調lncRNA CYTOR表達對CAL27細胞遷移和侵襲能力的影響
2.4下調lncRNA CYTOR表達對Wnt/β-catenin通路蛋白的影響:如圖4所示,相比較si-NC組,si-CYTOR組細胞中的c-myc、cyclin D1和β-catenin蛋白表達顯著下降(P<0.01)。綜合以上實驗結果表明,抑制CYTOR的表達能有效抑制OSCC細胞生長,其機制可能與Wnt/β-catenin通路的阻斷有關。
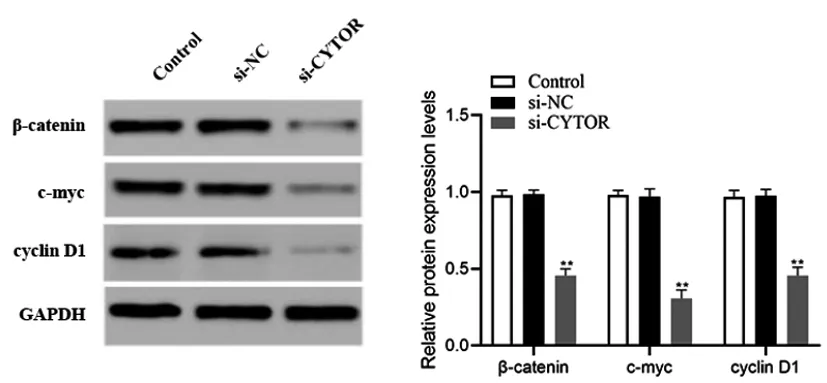
圖4 下調lncRNA CYTOR表達對CAL27細胞Wnt/β-catenin通路相關蛋白的影響
3 討 論
LncRNAs在蛋白編碼基因調控中的重要性,尤其是在轉錄和轉錄后水平上對腫瘤進展的調控作用已眾所周知。在OSCC中,大量的lncRNAs被檢測出異常表達,這些差異表達的lncRNAs通常與腫瘤的發生、轉移、預后或診斷密切相關,可作為癌基因或抑癌基因存在[8]。因此,不斷發現和探討新的lncRNAs在OSCC中的作用和調控機制對OSCC的診斷和治療具有重要意義。
本研究首先通過PCR檢測了4種OSCC細胞相比較正常口腔細胞內lncRNA CYTOR表達的差異性,結果表明lncRNA CYTOR在OSCC細胞中的表達明顯升高,提示了lncRNA CYTOR可能作為原癌基因參與OSCC的發生發展。據報道,lncRNA CYTOR作為一種腫瘤相關的非編碼RNA,可以調節各類癌癥的病理過程。例如,Wang等[9]研究發現lncRNA CYTOR可以通過與核仁素和KH結合域相互作用,在結直腸癌的發生發展過程中發揮癌基因作用進而促進腫瘤細胞的遷移和侵襲。截至目前,國內尚無研究證明lncRNA CYTOR在OSCC中的作用。因此,為了探究lncRNA CYTOR在OSCC中的具體作用,在實驗中選擇了表達差異性最大的CAL27細胞用于后續體外細胞研究,同時siRNA用于下調CAL27細胞內的lncRNA CYTOR表達。細胞體外表型功能實驗結果表明OSCC細胞的增殖,遷移和侵襲能力在lncRNA CYTOR基因敲除后明顯受到抑制。與上述研究結果一致,本研究結果肯定了lncRNA CYTOR在OSCC進展中的促癌作用。lncRNA CYTOR在OSCC中的下游調控通路在本研究中也做了初步探索。在確定lncRNA CYTOR在OSCC中的促癌作用后,進一步檢測了Wnt/β-catenin信號通路相關蛋白的表達情況。研究表明抑制lncRNA CYTOR表達能有效下調c-myc、cyclin D1和β-catenin蛋白表達。Wnt/β-catenin信號通路是細胞信號轉導過程中的經典途徑之一,而β-catenin的磷酸化在這一信號轉導過程中起著關鍵作用。研究表明Wnt蛋白與細胞膜受體的相互作用可以抑制β-catenin的磷酸化,進而導致β-catenin在細胞質中積聚。過度積聚的β-catenin會進入細胞核與TCF/LEF轉錄因子相互作用,進而激活下游靶基因例如原癌基因c-myc和周期蛋白Cyclin D1等的表達,最終促進腫瘤細胞的惡性轉移和過度增殖。目前已有大量研究證實Wnt/β-catenin信號通路的激活與OSCC的發生發展密切相關。綜上所述,lncRNA CYTOR能通過激活Wnt/β-catenin信號通路促進OSCC細胞的增殖,遷移和侵襲。
結果表明了lncRNA CYTOR在OSCC發生發展過程中的促癌作用。然而,lncRNA CYTOR在OSCC中發揮作用的下游調控基因還有待進一步研究。

