基于數字化實驗進行Fe3+ 催化H2 O2分解機理探究
陳林 袁君亞

摘要:圍繞Fe3+催化H2O:分解反應機理的探索,設計3個學習任務。首先,實驗取證Fe3+/Fe2+與H2O2循環反應的宏觀事實:其次,理論分析Fe“催化H2O2分解的微觀機制;最后,通過降解生物染料龍膽紫的實驗,感受芬頓技術在降解有機廢水中的應用價值。通過問題解決,增進對催化機理的理解和跨學科知識的融合,提升科學探究能力,培養綠色化學觀念。
關鍵詞:催化機理:實驗探究:芬頓反應;綠色化學;跨學科
文章編號:1008-0546(2022)12x-0012-05
中圖分類號:G632.41
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.003
2019年版新教材選擇性必修1《化學反應原理》(人教版)探究欄目中,以鐵離子催化過氧化氫分解作為研究對象分析影響化學反應速率的因素;…當過氧化氫溶液中滴人少許FeCl溶液后,除氣泡顯著加快以外,還發現體系顏色由黃色很快變成紅棕色,最后又變成黃色。這一異常現象引人思考:催化劑與反應物之間到底發生什么變化,Fe3+催化H2O2分解的反應機理是什么?
一、催化機理文獻綜述
一般認為,Fe3+、Fe2+能加快H2O2分解反應是基于產生活潑性很強的游離基所致。其中Fe3+與H2O2反應產生強氧化性的羥基自由基(.OH)的過程被稱為類一Fenton反應。[2,3]
1.類-Fenton反應
類-Fenton反應的機理分為3個階段:首先,Fe3+發生水解;其次,Fe“及其水解產物與H2O2形成過渡絡合物Fem(HO2)2+和Fem(OH) (HO2)+,過渡絡合物再分解產生Fe2+和HO2.;最后,Fe2+與H2O2反應產生.OH,發生典型的Fenton反應階段。
2.Fenton反應
1893年,化學家Fenton(中文譯為芬頓)發現H2O2與Fe2+的混合溶液具有強氧化性,可以將當時很多已知的有機化合物氧化為無機態,氧化效果十分顯著。[4]進入20世紀70年代,芬頓試劑被廣泛應用于去除廢水中難降解的有機污染物;近年來,芬頓技術還被應用于微量藥物類污染物的深度處理以及病原微生物殺滅等研究。[5]研究表明,Fenton反應中存在大量復雜的中間反應,其中最被廣泛接受的為Fe2++H2O2→Fe3++ OH+.OH,即Fe2+與H202反應生成羥基自由基(.OH),羥基自由基具有強氧化能力和高電負性,除經多步基元反應產生O2外,還可以將大多數有機污染物快速且無差別地氧化為二氧化碳和水。[5]
二、教學分析
1.課程目標分析
課程標準對選擇性必修有關催化劑對化學反應速率影響機理的內容要求:結合具體實例使學生“知道化學反應是有歷程的,認識基元反應、活化能對化學反應速率的影響”“知道催化劑可以改變反應歷程,對調控化學反應速率具有重要意義”;并提出情境素材建議“催化劑研究與諾貝爾獎,溫度改變和活化能改變對化學反應速率的影響數據”。[6]但教材中關于基元反應、活化能、催化機理與反應速率之間的關系除去理論描述外,缺乏具體例子或數據的支撐,造成學習如同囫圇吞棗,理解起來相當費力。
2.學生情況分析
初中時,學生知道了使用MnO2催化過氧化氫分解來制取O2,由于過度強調催化劑的組成、化學性質和質量在反應前后不發生變化,導致學生認為催化劑并沒有參與反應。《化學反應原理》指出,催化劑能加快化學反應速率的機制,在于能改變反應歷程,降低活化能,[1]但這種理論論述因缺乏例子的支撐,顯得空洞乏力,并不能起到糾正學生原有錯誤概念的作用。當學生捕捉到過氧化氫溶液中滴入FeCl3溶液后、體系顏色發生異常變化時,筆者以為正是開展催化機理教學的切入口。
3.教學價值分析
以Fe3+催化H2O2分解的反應機理作為課題實施教學,一方面能深化學生對催化機理的認識、拓展科學視野;另一方面,中學實驗中存在直接排放有機污染物的普遍現象,特別是以苯、硝基苯等為代表的芳香族化合物(含生物學常用染色劑苯酚品紅、龍膽紫等),高毒、難降解,易造成水體嚴重污染,指導學生運用芬頓技術降解實驗中產生的有機廢液,彰顯化學的實用價值。
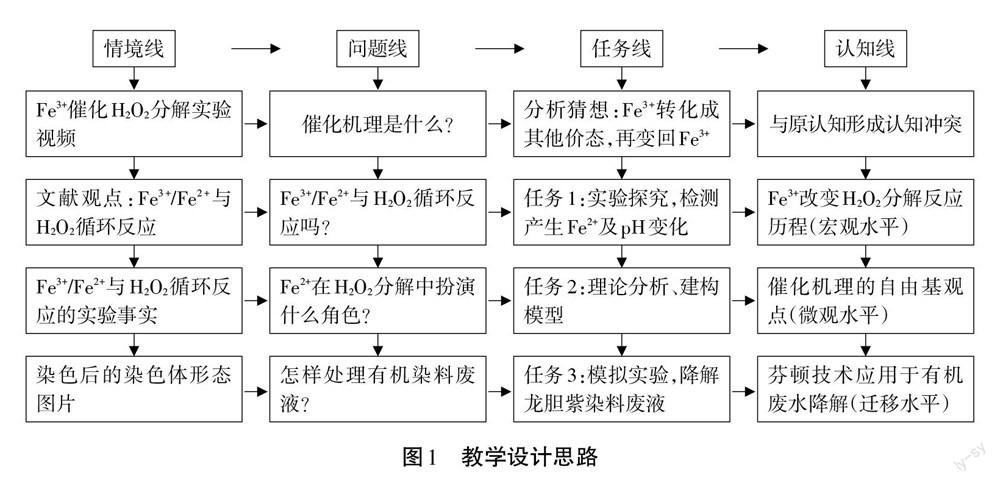
三、教學設計思路
Fe3+催化H2O2分解反應機理的復雜性和學生錯誤前概念并存,雙重挑戰使得教學設計困難重重。將文獻中反應機理直接“科普”給學生,并不能有效糾正學生原有的錯誤認知。所以需要對收集到的文獻資料、情景素材進行深度加工,一方面保留材料的基本觀點與主要成果;另一方面,按照學科核心素養的要求和學生的認知情況及規律去組織課堂教學活動。關于催化機理的主要觀點是Fe3+/Fe2+與H2O2循環反應[5]及產生活潑性很強的自由基,[2]據此設計3個學習任務開展實驗與理論探究,見圖1:
四、教學目標
1.通過實驗探究,了解Fe3+ /Fe2+與H2O2循環反應從而催化H2O2分解的事實,豐富催化劑通過改變反應歷程、降低活化能來加快反應速率的認識。
2.通過分析“Fe2+在催化H2O2分解反應中扮演的角色”,運用物質結構的理論知識,解釋反應的微觀機制,促進學科知識的結構化。
3.通過生物學染料龍膽紫的模擬降解實驗,促進跨學科知識的融合;了解芬頓技術在降解工業有機廢水中的廣泛應用,培養綠色化學觀念。
五、教學實錄
[創設情境、提出問題]播放Fe3+催化H:O:分解的實驗視頻,分析現象。加入FeCl3溶液后溶液變黃,后顏色逐漸加深,最后變回黃色。提問:Fe3+催化H2O2分解的反應機理是什么?
[學生猜想] Fe3+與H2O2反應轉化成其他價態,再變回Fe3+。
任務一:實驗探究——收集Fe3+ /Fe2+與H2O2循環反應的事實證據
[文獻資料]展示有關Fe3+催化H202分解的反應機制的主要觀點如下:
2Fe3++H2O2→2Fe2++O2 ↑+2H+[7]
2Fe2++ H2O2+ 2H+→ 2Fe3++ 2H2O
[問題]這種觀點可靠嗎?
[師生討論]檢測指標:體系中是否生成Fe2+及pH變化。
[資料卡]鐵氰化鉀,化學式K3[Fe(CN)6],紅色晶體,水溶液呈黃色,遇亞鐵鹽則生成深藍色沉淀(滕氏藍)。
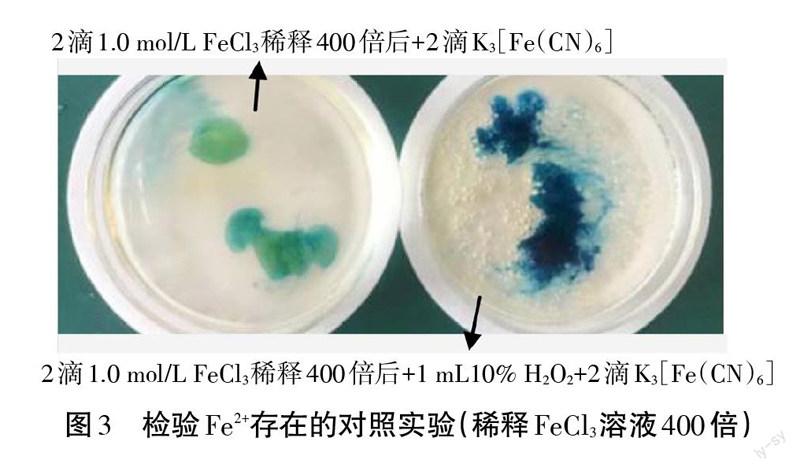
[學生設計方案1]在點滴板孔穴內滴人1-2滴H2O2溶液,然后滴人1滴FeCl,溶液,再滴人1滴K3[Fe(CN)6]溶液,觀察是否有深藍色沉淀;另一學生補充方案:需要用K3[Fe(CN)6]檢驗原FeCl3溶液中本身不攜帶Fe2+,作為對照,見圖2(上)。
[學生實施實驗,得出結論]FeCl,溶液、Fe3+/H2O2混合體系分別滴人K3[Fe(CN)6]均有深藍色沉淀。
[教師]由于原FeCL溶液本身攜帶Fe2+,干擾實驗的驗證;老師將原溶液稀釋400倍,再進行對照實驗,實驗現象見圖3,根據藍色顯著加深證明Fe3+與H2O2反應生成了Fe2+。
[設計方案2]在三頸燒瓶中加入60 mL 15%H2O2,在磁力攪拌器攪拌下,滴人1滴管1 mol/L FeCl3溶液,用pH傳感器測量體系pH變化。實驗裝置及數據結果見圖4。
[學生觀察演示實驗視頻、分析數據]解釋pH傳感器測得的pH-時間圖像中各段pH變化的原因。
[學生1]前20 s溶液pH值保持2.47,表明原過氧化氫溶液呈弱酸性;20-23 s,pH直線下降是因為加入FeCl3溶液,因為Fe3+水解呈弱酸性,且配制FeCl,溶液時會加入少許鹽酸抑制其水解。
[學生2]從23 s往后,pH先減小后緩慢增大,證明體系中先生成氫離子,后又被消耗了。
[結論]實驗證明:Fe3+催化H2O2分解過程中,Fe3+/Fe2+與H207的循環反應,改變了反應歷程。
設計意圖:通過實驗探究Fe3+/H2O2體系中Fe2+的存在和pH變化,獲取Fe3+/Fe2+與H2O2的循環反應的事實證據,同時提高學生對照實驗方案設計、數據分析、合作實驗等科學探究能力。
任務二:證據推理——分析Fe3+催化H2O2分解的微觀機制
[問題1]H2O2分解在常溫常壓下能自發進行嗎?
[教師]研究反應進行的方向,分析過氧化氫分解反應的焓變和熵變。
[學生]△HO。故而△G
[問題2]常溫常壓下,H2O2分解為什么速率緩慢呢?
[教師]H202分解活化能約為220 kj/mol[2],較高。活化能的大小與反應物分子結構相關。
[學生]完成以下任務:(1)寫出過氧化氫分子的電子式、結構式,分析空間構型;(2)分析鍵能數據O-H 464 kj/mol,0-0 146 kj/mol,思考過氧化氫發生氧化還原反應,可能優先斷裂哪根鍵。
[教師]從鍵能來看,較容易斷裂的是O-O鍵;而兩側的原子團對O-O鍵中共用電子對的作用一模一樣,斷鍵不容易;好比拔河,如果兩隊力量均衡,要分出勝負總是困難的。
[問題3] Fe2+在H2O2分解反應歷程中扮演了什么角色?
[任務]寫出Fe2+、Fe3+的外圍電子排布式,根據洪特規則判斷其性質。(Fe2+:3d6、Fe3+: 3d5半充滿,Fe2+易失去1個電子,具有很強的還原性,轉化為較穩定的Fe3+)
[教師]Fe“失去的一個電子怎樣與H2O2作用呢?
[播放動畫]通過電子式來模擬Fe2+失去的一個電子與H2O2作用的過程。
[結論]推理可知:Fe2++ H2O2→Fe3++ OH-+.OH
[問題4]從結構角度分析,羥基自由基(-OH)可能具有什么性質?
[學生]羥基自由基有一個未成對電子,極易得到一個電子,可能具有強氧化性。
[教師]研究表明,羥基自由基在溶液中氧化性極強,其氧化性僅次于氟。[7]羥基自由基在鐵催化過氧化氫分解過程中發揮著重要作用。
[科技前沿1]中國科學院研究員謝銀德等(2000)研究發現[8]:H202和Fe2+氧化還原中間步驟涉及自由基參加反應,其反應歷程由多步基元反應構成,主要如下:
[教師]其中式①反應是基元反應鏈的引發,在反應歷程中起到關鍵作用;.OH具有很高的活性,壽命短,存在時間僅10-6秒,難以被檢測,但已被科學家們證實存在。
[科技前沿2]中國科學院研究員馬會民等(2018)通過改造花菁分子合成出熒光探針,可以高效檢測H202和Fe2+反應產生的羥基自由基。[9]原理見圖5。
[問題5]Fe“最初是如何轉化為Fe2+的呢?
[教師]一般認為,金屬離子(Fe3+、Fe2+等)能加快H2O2分解反應是基于產生活潑性很強的游離基所致。其中Fe3+與H2O2反應產生強氧化性的羥基自由基(.OH)的過程被稱為類- Fenton反應。反應由3個階段構成,‘31見圖6。
[模型建構] Fe3+催化H2O2分解的微觀機制是非常復雜的,但是可以形成以下基本觀點:1.Fe3+/Fe2+與H2O2循環反應;2.Fe2+與H2O2反應產生的強氧化性羥基自由基(-OH)起到了關鍵作用,見圖7。
[教師] Fe2+與H2O2的反應稱為Fenton反應,產生強氧化性羥基自由基(-OH),[8]被廣泛應用于去除廢水中難降解的有機污染物。
設計意圖:通過設計5個子問題,層層深入地引導學生建立化學反應速率一活化能一反應物分子結構之間的關聯,從微觀結構角度理解催化劑與反應物分子之間的相互作用;結合最新的科技文獻資料,建構模型,幫助學生形成Fe3+、Fe2+能加快H2O2分解是基于產生活潑性很強的游離基所致的觀點。
任務三:遷移應用——使用芬頓技術降解有機廢水的模擬實驗
[情境問題]投影顯微鏡下觀察到的染色體形態照片,分別使用龍膽紫、苯酚品紅染料染色。實驗中產生的染料廢液你是怎么處理的?
[教師]閱讀資料卡,思考:龍膽紫染料廢液能否直接排放?為什么?若不能,什么試劑可以降解龍膽紫呢?
[學生討論并匯報]因龍膽紫有毒、結構穩定、難以降解,所以不能直接排放;向龍膽紫中滴人H2O2溶液和Fe2+溶液,觀察是否褪色。
[教師]很好,同時我們向龍膽紫溶液中滴入等量的過氧化氫溶液,進行比較。
[學生實施實驗、匯報現象和結論]當龍膽紫中只滴入H2O2溶液時未褪色,滴人H2O2和FeS04溶液時很快褪色,見圖2(下),證明芬頓試劑的氧化性要強于過氧化氫。
[文獻]研究表明,羥基自由基具有強氧化性,酸性條件下,可以將常見的有機物無區別地氧化為二氧化碳和水。[5]
[演示實驗方案]向圓底燒瓶內依次加入20 mL龍膽紫溶液和5 mL 10%H2O2溶液,塞上瓶塞;在不斷攪拌下,用注射器逐滴加入少許0.4 mol/L FeSO4溶液,同時用CO2傳感器檢驗產生氣體的成分,圖9。
[實驗現象與結論]當滴人FeSO4溶液后,CO2傳感器測得CO2濃度逐漸增大,證明羥基自由基可將龍膽紫氧化生成二氧化碳。
[科學·技術·應用]簡述芬頓反應的科學發現、機理研究和芬頓技術應用的百年歷程。
[教師寄語]芬頓技術在環境化學中有著廣泛的應用,今天我們學習了如何處理實驗中產生的有機廢水,保護我們身邊的水資源是我們共同的責任,期待從你我做起。
設計意圖:通過芬頓反應降解生物學染料龍膽紫的模擬實驗,感受羥基自由基的強氧化性,體驗芬頓技術在有機廢水降解中的應用價值,促進知識的跨學科融合,培養綜合素養和綠色觀念。
六、教學反思
通過查閱文獻,筆者發現Fe3+催化H2O2分解的反應機理較為復雜,怎樣才能將蘊含催化機理的眾多真實情境素材轉化為一節扎扎實實的“化學課”呢?
1.去粗取精——聚焦真實情境素材的核心主題
筆者采取主題式學習模式,圍繞Fe3+催化H2O2分解反應機理的探索,從學生的認知情況和學科素養要求出發,認真剖析真實情境素材(文獻、實驗、圖表、圖片等),梳理文獻有關催化機理的基本觀點,發現其包涵2個要點:一是Fe3+/Fe2+與H2O2循環反應;二是產生的活潑性很強的自由基加快了H2O2分解,因而探究過程的設計圍繞這2個要點而展開。
2.由表及里——基于學科思維關聯學習大任務
與催化機理的2個要點相對應,學生認知存在2種水平:認識Fe2+為中間產物的宏觀水平及自由基觀點的微觀水平,據此設置3個學習任務:實驗探究收集Fe3+/Fe2+與H2O2循環反應的宏觀事實;理論分析Fe3+、Fe2+與H2O2作用形成羥基自由基的微觀過程;最后使用芬頓試劑模擬降解生物學染色劑的實驗,間接驗證自由基的存在。通過對反應機理由表及里的深入剖析,不僅促進了學科知識的內部關聯;而且促進了知識的跨學科融合,認識科學發展、技術進步與環境保護之間的密切聯系。
3.問題驅動——細化真實問題為有序的問題鏈
本節課圍繞“Fe3+催化H2O2分解的反應機理是什么”和“怎樣處理生物學染料廢液”2個真實問題,依托化學物質結構理論、化學反應原理的知識,設計層層深入的問題鏈,引發基于學科思維的深度思考,提升學生對催化機理的認識水平,促進學生高階思維和綜合實踐能力的發展。
參考文獻
[1]人民教育出版社,課程教材研究所,化學課程教材研究開發中心.普通高中教科書(化學選擇性必修1)[M].北京:人民教育出版社,2019:24-27.
[2] 于客峻.Fe3+催化H:0:分解的實驗探究[J]化學教學,2014(10):53-55.
[3]王春.借助手持技術探究外界條件對三價鐵離子催化過氧化氫分解的影響[J].化學教育(中英文),2022,43(9):86-89.
[4]趙啟文,劉巖.芬頓(Fenton)試劑的歷史與應用[J].化學世界,2005(5):319-320.
[5] 陳撰,嵇家輝,冉茂希,邢明陽,無機助催化(類)芬頓反應降解有機污染物的研究進展[J].環境科學研究,2021,34(12):2787-2797.
[6] 中華人民共和國教育部.普通高中化學課程標準(2017年版)[M].北京:人民教育出版社,2017:90-92.
[7] 陳凱,趙鈞若,陳昌云.芬頓反應的原理和微型實驗[J].中學化學教學參考,2010,(10):40-41.
[8]謝銀德,陳鋒,何建軍,趙進才.Photo-Fenton反應研究進展[J].感光科學與光化學,2000,18 (4):357-365.
[9] 雨回.Angew:熒光探針檢測鐵自氧化產生的羥基自由基[EB/OL],2018(09):07.

