基于能斯特方程探究可逆氧化還原反應模型
田一鳴 廖志剛

摘要:氧化還原與化學平衡均為高中化學的核心概念,將氧化還原與化學平衡的相關知識進行整合,會展示出豐富的化學信息。能斯特方程作為氧化還原反應的基本原理,構(gòu)成了實現(xiàn)學生“微粒觀”與“變化觀”協(xié)同建構(gòu)和多向整合的中介橋梁,使學生思維產(chǎn)生連鎖化效應,可以深度激發(fā)化學認知,有效發(fā)展學生的化學核心素養(yǎng)。
關鍵詞:氧化還原;化學平衡;能斯特方程;核心素養(yǎng)
文章編號:1008-0546( 2022)12x-0050-04
中圖分類號:C632.41
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.012
一、問題的提出
“氧化還原”是高中化學學習的基礎核心概念,貫穿了整個高中化學學習過程,亦是化學“微粒觀”建構(gòu)的核心支點。“化學平衡”主要研究的對象為化學反應的限度以及影響化學平衡的因素,在化學基礎理論中同樣占據(jù)極其重要的地位,…是化學“變化觀”建構(gòu)的主要途徑。兩者均居于學生認知結(jié)構(gòu)體系的中心位置,是知識、素養(yǎng)建構(gòu)的主要基點。
將兩個核心理論進行融合即對氧化還原反應可逆性的探討是近年高考命題的熱點。該類題目綜合性強,在文獻和歷年真題中均有涉及,例如在2015年北京卷中,題目考查了離子在不同濃度下氧化性以及還原性的強弱,再如在2019年北交大附中期中測試中,相關題目考查了在NaClO2與HCl反應中酸度越大,生成物含量越大的原因。因此,正確理解影響物質(zhì)氧化性、還原性的因素是突破該類問題的重點。而深刻剖析物質(zhì)在不同外界條件下氧化性以及還原性的強弱問題則需引入能斯特方程作為理論支撐,該原理雖然在高中階段并未涉及,但是卻是支撐命題人實驗設計和設問的理論依據(jù)。[2]
在能斯特方程中,通過濃度這一宏觀變量構(gòu)建出既滿足平衡轉(zhuǎn)化又體現(xiàn)微粒轉(zhuǎn)移的可逆氧化還原反應的體系模型,實現(xiàn)對“微粒觀”和“變化觀”的整體表征,通過對模型的探究,進一步深化氧化還原反應在教學中的實際應用,體現(xiàn)了化學學科理解中本原性、結(jié)構(gòu)化的認識價值。[3]
二、實驗方案的設計與實施
1.實驗原理
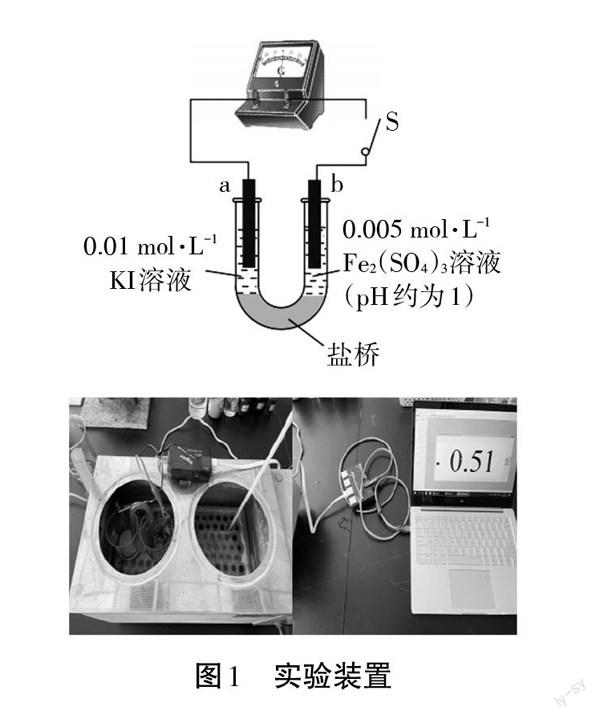
本文以2Fe3++21==2Fe2++I2作為探究對象,建構(gòu)基于濃度改變量的可逆氧化還原反應的模型。實驗使用石墨電極,正極電解液為Fe2(SO4)3,負極電解液為KI,連接鹽橋以及導線構(gòu)成閉合回路,形成原電池(實驗裝置如圖1所示),用控制變量的方法使外界條件如溫度、壓強保持不變。由于礦(Fe3+/Fe2+)和φ(I2/I一)為標準狀態(tài)下的電極電勢,故本實驗在恒溫水浴的環(huán)境下進行,使溫度控制在25℃左右。通過加入其他溶液,改變反應物或生成物離子濃度,進而改變化學平衡的移動方向,并使用電流傳感器來表征反應的進行情況。
2.實驗過程
(1)藥品的配制
使用分析天平稱取0.4150 G KI固體,使用250 mL容量瓶配制0.01 mol/L KI溶液,并將溶液轉(zhuǎn)移至棕色試劑瓶中備用。再使用分析天平稱取0.5000 G Fe2(SO4)3固體置于100 mL燒杯內(nèi),加入適量稀硫酸溶解,并將溶液pH調(diào)至約為1;再使用250 mL容量瓶將其配制成0.005 mol/L的Fe2(S04)3溶液,將溶液轉(zhuǎn)移至棕色試劑瓶中備用。
使用分析天平稱取8.4936 G AgNO,固體,使用50 mL容量瓶配制1 mol/L AgNO3溶液。并以此類推,分另0制得0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/LAgNO,溶液。
再使用分析天平稱取27.8020 9 FeSO4.7H2O固體置于100 mL燒杯中,加入足量稀硫酸與適量蒸餾水,二者體積之和需小于100 mL。將該燒杯置于磁力攪拌器上進行攪拌至固體溶解。待完全溶解后轉(zhuǎn)移至100 mL容量瓶中,加入蒸餾水至刻度線定容、搖勻,制得1 mol/L FeS04溶液。以此類推,分別制得0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/L的FeS04溶液。此時濃度變量溶液已經(jīng)制備完畢。
用電子天平稱取3.0 g瓊脂固體于250 mL燒杯中加入97 mL的飽和KCl溶液后,置于電爐上加熱,用玻璃棒不斷攪拌至瓊脂完全融化,趁熱將瓊脂一飽和KCl溶液轉(zhuǎn)移至U型管中,待其冷卻至室溫浸泡于飽和KCl溶液中備用,此時鹽橋制備完畢。
(2)原電池的組裝
分別取20 mL 0.01 mol/L的KI溶液和0.005 mol/L的FeZ(S04)3溶液置于兩個100 mL燒杯中,將燒杯放置于恒溫水浴鍋中,并在恒溫水浴鍋中加入足量的水及至水線沒過兩燒杯內(nèi)溶液液面高度,再取一支量程為50℃的溫度計置于燒杯中,打開恒溫水浴鍋的開關,將旋鈕旋至加熱,注意觀察溫度計示數(shù),至22℃時立刻將按鈕旋至恒溫,利用余熱將溫度可控在25℃,按照實驗裝置將預備好的鹽橋放置在兩燒杯間,底端沒人燒杯液面以下,將碳棒分別插入燒杯,連接電流傳感器,形成閉合回路,構(gòu)成原電池。
(3)改變原電池中反應物及生成物濃度對平衡影響的探究
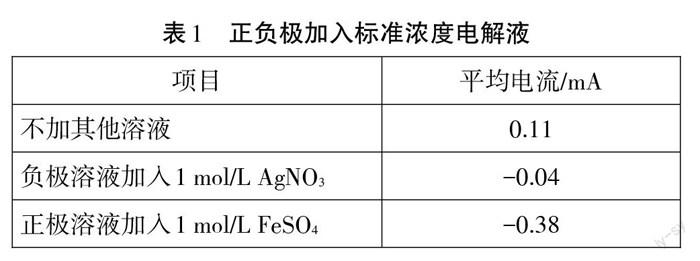
安裝好裝置后,打開DISLab7.2軟件,點擊儀表按鈕,開始實驗。用電流傳感器采集數(shù)據(jù)并觀察圖像,待圖像變動幅度趨于穩(wěn)定時,向KI溶液中加入1mol/L AgNO3溶液,觀察圖像變化,待其再次趨于穩(wěn)定后向Fe2(SO4)3溶液中加入1 mol/L FeS04溶液,繼續(xù)觀察圖像變化,數(shù)據(jù)圖像如圖2所示,實驗數(shù)據(jù)見表1。
控制右側(cè)加入FeS04溶液濃度保持1 mol/L,采取濃度梯度方式,分四次向左側(cè)溶液中加入0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/L AgNO,溶液,觀察圖像趨勢,待平穩(wěn)后完成第二次實驗,收集到的實驗數(shù)據(jù)見表2。
控制左側(cè)加入AgNO3溶液濃度保持1 mol/L,同理加入相同濃度梯度的FeSO4溶液,觀察圖像,待平穩(wěn)后完成第三次實驗。收集到的實驗數(shù)據(jù)見表3,整理實驗數(shù)據(jù),實驗儀器及藥品。
將表2、表3數(shù)據(jù)以濃度為X軸,平均電流為Y軸,繪制成圖像,如圖3所示。
三、實驗數(shù)據(jù)分析
1.利用能斯特方程對圖像進行定量探究
選擇-20 mA-20 mA量程的電流傳感器,測量出300 s內(nèi)2Fe3++21-==2Fe2++I2該反應在正常反應過程中加入1 mol/L AgNO,以及1 mol/L的FeSO4后的電流變化。
分析得知,在相同條件下,基于該氧化還原反應的原電池產(chǎn)生的平均電流值僅有0.11 mA,該反應過程中電流先增大后降低逐漸平穩(wěn),這是由于反應開始時只有部分溶液參與反應,為反應的起始點,到達最高點時全部溶液參與反應,電流達到峰值,隨著反應的繼續(xù)進行,逐漸達到平衡點電流下降最后趨于不變。該反應Fe3+為正極溶液,I一為負極溶液,根據(jù)氧化還原反應電位,礦(Fe3+/Fe2+)為0.77 V,礦(12/I)為0.54V,在非標準狀態(tài)下電池電動勢E=O.II V,電流為正向電流,在圖像x軸上方。
又由于AGe=_nEeF=_RlrlnKe,nEe=0.059 lgKa,該反應的Ko-1 07'8。可知該反應在標準狀態(tài)下反應很徹底,故要想使反應方向發(fā)生逆轉(zhuǎn),需要在非標準狀態(tài)下進行反應,即控制外界因素不變,改變反應離子濃度,進而改變反應的電流方向及大小。在加入1 mol/L AgNO,后.電流值恰好發(fā)生了突躍,由正向平衡電流突躍至負向電流,電流大小由0.11 mA變至-0.04 mA,反應趨勢與第一段趨勢相似,逐漸平衡,電流趨近于0,但此段圖像與理論不符。分析原因如下:由于Ag++l-=Agl l,反應生成沉淀,根據(jù)能斯特方程妒(I2/I一)=(9(I:/I一)-0.059 lgc(l-),在加入1 mol/L AgNO,后c(r)=Kspe( Agl) =9.3xl0。7 mol/L,帶人能斯特方程可知妒(L/I-)=1.54 V,此時妒(I2/I一)>妒0(Fe3+/Fe2+),正負極對調(diào),E=cp (12/I-) -礦(Fe3+/Fe2+) =1.54 V-0.77 V=0.77 V>O.11 V,產(chǎn)生的負向電流絕對值應大于O.llmA,故理論電流值應如圖4中所示的黑色(稍粗)曲線。而實際圖像中為對應時間內(nèi)的紅色(稍細)曲線,由于產(chǎn)生的Agl為穩(wěn)定黃色沉淀,K。9很小,使得溶液中剩余的c(I-)僅有9.3xl0。17 mol/L,溶液的電導率需要以離子濃度作為支撐,對于幾乎不存在I一的情況下,電池內(nèi)阻較大,產(chǎn)生的電流非常小,在加入Imol/L的FeSO。后,由能斯特方程,妒(Fe3+/Fe2+)=曠(Fe3+/Fe“)+0.059 lg[c(Fe“)/c(Fe“)],此時非標準狀態(tài)c(Fe3+/Fe2+)=0.63V,正極仍為I一,負極為Fe3+,該反應的非標準態(tài)電動勢E=cp(12/I')-妒(Fe3+/Fe2+) =1.54 V-0.63 V=0.91 V,圖像再次突躍且為三段電流中電動勢最大的一段,而此反應中由于加入溶液FeS04,溶液中離子濃度大,故電阻較小,產(chǎn)生的電流值也較大,平均電流-0.38 mA,故形成了有兩段突躍值的電流曲線,如圖4所示。
2.利用化學平衡原理對圖像進行定性解釋
在2Fe3++2I==2Fe2++12反應中,由上述定量分析可知,該反應的Ke很大,故反應很徹底,幾乎不存在可逆性,F(xiàn)e3+為正極,I一為負極,產(chǎn)生的電流恒為正向電流。但在減少反應物濃度以及增加生成物濃度后,該反應存在可逆傾向,即在加入AgNO。后,使得Ag+與I一結(jié)合成Agl沉淀,溶液中的反應物c(I-)急劇減小,使得化學平衡向左移動,反應逆向進行,I一為正極,F(xiàn)e3+為負極,則會產(chǎn)生負向電流,待該反應再次達到平衡,加入FeSO4后,溶液中的生成物c(Fe2+)增大,化學平衡再次向左移動,I一為正極,F(xiàn)e3+為負極,繼續(xù)產(chǎn)生負向電流,最終第三次達到化學平衡。
四、實驗結(jié)論與應用
1.實驗結(jié)論
根據(jù)能斯特方程,可通過改變氧化型或還原型的濃度,改變電極電勢大小,進而實現(xiàn)氧化還原反應中反應物與生成物的轉(zhuǎn)化。 2.實驗應用 在實驗設備方面,采取數(shù)字化實驗的科學方法,利用微型傳感器精確研究濃度微小變化帶來的影響,引入電流傳感器,通過物理中電流電阻的動態(tài)表征對實驗結(jié)論進行全局性判斷,[4]賦予化學實驗新思維,新感知。數(shù)字化實驗的應用也更為廣泛,數(shù)字化實驗在中學化學教學的價值將逐漸被體現(xiàn)出來。[5]
在中學教學方面,探究化學平衡載體下的氧化還原反應是利用能斯特方程作為銜接橋梁,以氧化型或還原型的濃度作為宏觀變量,揭示了氧化還原反應在熱力學判據(jù)中的實質(zhì),即電極電勢的差值。該原理雖然在高中階段并未涉及,但是卻是支撐命題人實驗設計和設問的理論依據(jù)。
同時,氧化還原與化學平衡的聯(lián)系是很廣泛的,如在制備氯氣中選擇濃鹽酸作為強氧化劑與二氧化錳進行反應,在日常生活中手機鋰離子電池充放電原理的應用問題等,解答此類綜合性問題需要學生綜合運用氧化還原和化學平衡知識。將氧化還原反應的熱力學判據(jù)即電極電勢與影響化學平衡移動的外界因素即離子濃度進行結(jié)合,有利于實現(xiàn)化學學科中“微粒觀”與“變化觀”的協(xié)同建構(gòu)與多項整合,進而完成對學生的多維度考查,還可以豐富學生對于氧化還原反應的認知,對發(fā)展學生的化學學科核心素養(yǎng)大有裨益。
參考文獻
[1]岳可芬,王小芳.外界條件對化學平衡的影響在物理化學中的內(nèi)容[A].中國化學會化學熱力學和熱分析專業(yè)委員會.中國化學會第十五屆全國化學熱力學和熱分析學術(shù)會議論文摘要[C].中國化學會化學熱力學和熱分析專業(yè)委員會:中國化學會,2010:2.
[2]楊曉琳,高修庫,趙瀏.運用能斯特方程定量分析影響物質(zhì)氧化性與還原性的因素[J].高中數(shù)理化,2020(22):123-126.
[3] 鄭長龍.化學學科理解與“素養(yǎng)為本”的化學課堂教學[J].課程·教材·教法,2019,39(09):120-125.
[4]周薇,王兆龍.特殊電化學現(xiàn)象的熱力學分析[J].中學化學,2020(07):39-40.
[5]裴傳友,馬善恒,楊芹.中學化學數(shù)字化實驗的發(fā)展與應用[J].化學教學,2020(02):56-60.

