基于項目化學習的化學計算教學探索
李芳芳 沈坤華

摘要:以“配制84消毒液”為項目主題,開展與物質的量有關的各種化學計算教學,學生通過“計算制取氯氣時各種反應物的需求量、生成物的產量、電子的轉移量“制取84消毒液時氫氧化鈉的需求量…‘構建氧化還原類型計算模型”三個項目任務,將各種物理量的計算結構化,可視化。
關鍵詞:項目化;化學計算:物質的量;84消毒液
文章編號:1008-0546( 2022 )llx-0019-04
中圖分類號:G632.41
文獻標識碼:B
doi: 10.3969/j .issn.1008-0546.2022.llx.005
一、問題提出及研究現狀
《高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課標》)中提出了項目化學習的概念。[1]項目式學習(Problem based learning或Project basedleaming,簡稱PBL)是一種創造性解決實際問題的學習方式,注重幫助學生解決真實世界中復雜、非常規具有挑戰性的問題,是以小組合作的形式,培養學習者溝通合作、批判創新的高階認知能力和工作方式。
PBL要與《課標》對應,一旦兩者對應起來,就能確保這份學習經歷是值得投入時間,學術的嚴謹性就建立起來了。《課標》要求能運用定量計算說明物質的組成與變化;能從質量守恒分析化學變化,用化學計量單位定量分析化學反應及其伴隨的能量轉化;能從定性和定量結合上收集證據,通過定性分析和定量計算推出合理結論;能用數據、圖表、符號等處理實驗信息。化學計算是中學化學中一個重要的組成部分,也是學生在化學學習中的一個難點,學起來枯燥乏味,在評價測試中又不易得分。怎樣調動學生學習化學計算的積極性,選用最合適的方法準確而快速地解決計算問題,對于學生提高學習效率有著重要的意義。在實際的教學過程中要貼近生活、社會實際,重視化學與其他學科的聯系,充分認識化學實驗的獨特價值,精心設計實驗探究活動,創設真實且富有價值的問題情境,促進學生化學計算學習方式轉變,實施“教、學、評”一體化。[2]本設計以“配制84消毒液”為項目主題,適合在學業水平測試復習或選考科目一輪復習中化學計算模塊展開教學。
二、設計思路
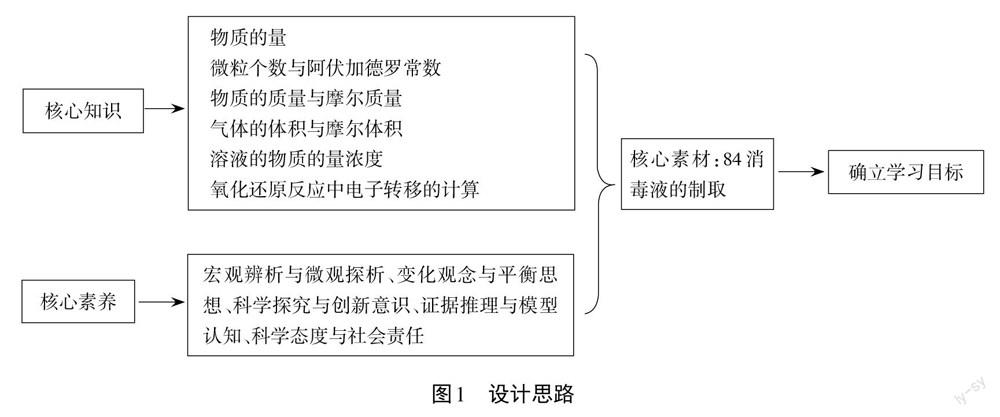
項目化學習的本質特征有“四真”:真實目標、真實情境、真實學習、真實評價。確定真實目標,根據課程主題和核心內容選擇真實情境并形成課堂目標,課堂目標指向解決更高水平的真實問題,在問題的解決中落實核心知識、素養、方法、思維。圖1是本課的設計思路。
1.選擇真實的情境
真實的情境貼近生活實際,讓學生在不知不覺中進入學習的狀態,本節課主要是化學計算的復習,若是按部就班地給出一些計算題目讓學生做后再講,會使課堂過于沉悶,學生興趣不高,效率低下。
將核心素養更好地落實到核心知識中來,打破計算知識的零碎化,利用疫情期間一瓶難求的84消毒液作為本節課的核心素材,借用制取消毒液這個真實情境來制定學習目標,安排教學任務。
學習目標如下:
(1)通過制取84消毒液,回顧無機物轉化的一般方法,提高實驗設計和分析的能力,強化變化觀念與平衡思想。
(2)通過定量的計算,找到制備過程中最合適的藥品取用量,培養問題分析和問題解決能力。
(3)掌握氧化還原反應電子轉移量的計算。
(4)通過實驗的改進,藥品無污染化處理,增強學生的科學態度與社會責任感。
2.設計有效的情境問題
化學源于生活,寓于生活,用于生活,在教學過程中如果從學生熟悉的生活場景來設問引入,可以引導學生一步步地走向學習的目標。在本節課的開頭,從新冠肺炎疫情出發,消毒液一瓶難求,你有好辦法嗎?提問式引入,引導學生回憶消毒液的成分和如何制取。緊接著拋出另一個問題:實驗室如何制氯氣?引導學生回顧實驗室制取氯氣的方法.引出化學方程式:2KMnO4+ 16HCl - 2MnCl2+2KCl+SCl2↑ +8H2O,進入正題,進行與物質的量有關的一系列計算。
三、教學實錄
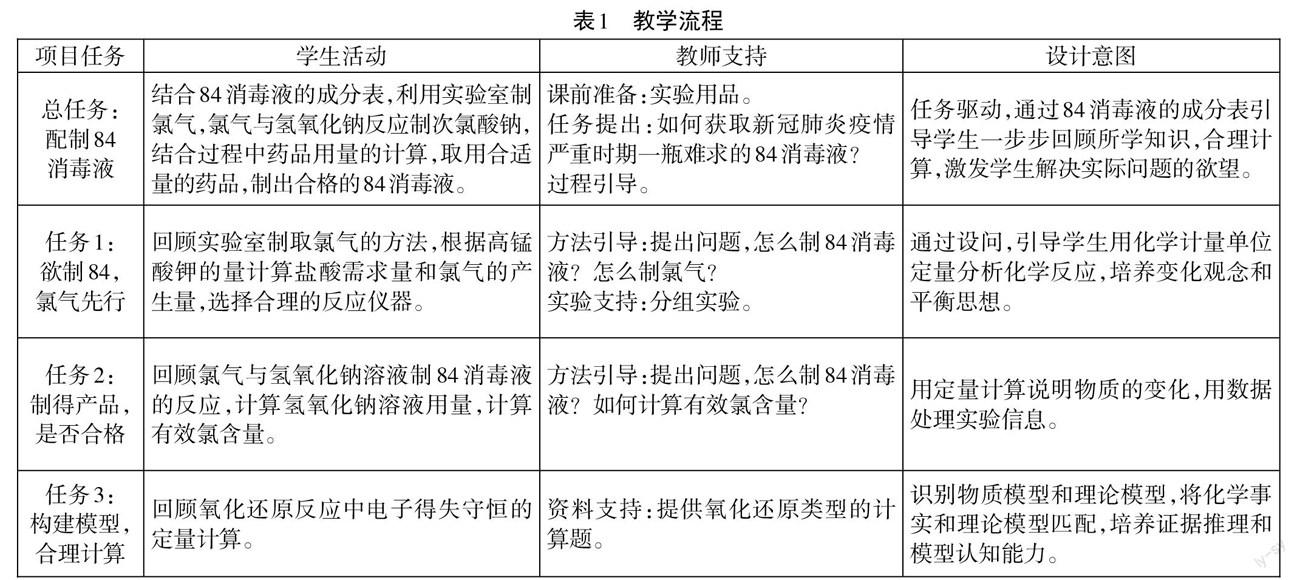
本設計以“配制84消毒液”為項目主題,教學流程如表1。
1.創設情境
[引入情境]這段時間,新冠病毒又有抬頭,想當初,84消毒液一瓶難求,如果這個難題擺在你面前,你有什么好辦法嗎?
[展示]一瓶84消毒液,有效成分:次氯酸鈉。
[生]自己制。
[問題驅動1]我們怎么制氯氣呢?
[生]學生各種回答:可以用二氧化錳和濃鹽酸加熱,高錳酸鉀和鹽酸,電解飽和食鹽水……
[師]實驗室常用二氧化錳和濃鹽酸加熱制氯氣,也可用高錳酸鉀和鹽酸,請大家寫出二氧化錳和高錳酸鉀分別和鹽酸反應的方程式。
[學生]書寫反應方程式。
2.欲制84,氯氣先行
[問題驅動2]現在有藥品:KMnO4固體和10 mol/L的鹽酸,儀器:大針筒若干。老師在大針筒中加入了0.316 g KMnO4固體(M=158 g/mol),請問:①為了不浪費藥品,吸人多少毫升鹽酸比較合適?②考慮氣體的產量,應選用什么規格的大針筒來收集氣體?(可供選擇的針筒有50 mL、100 mL、200 mL;常溫常壓下,氣體的摩爾體積約為24.5 Umol)
[生]列方程式進行計算,教師投影展示。
[師]通過計算,制取氯氣的時候需選用200 mL的針筒,現在每個小組桌上,藥品有KMnO4固體、濃鹽酸、氫氧化鈉溶液;儀器有大針筒若干,三通閥。先拔出200 mL針筒的活塞,往針筒內加入電子天平稱出的0.316 g KMnO4固體,裝上活塞,推到最里面,連接到三通閥的一端,再用另一個較小的針筒吸取稍大于1.6 mL的濃鹽酸(為了使KMn0。反應更充分),接到三通閥另一接口,調節閥門使兩針筒相通,將濃鹽酸推入裝KMnO4固體的大針筒,觀察反應進行。如圖2,圖3所示。
[學生分組實驗]觀察現象,針筒中產生黃綠色氣體。
[追問]假設剛才我們的實驗過程中KMnO4(0.316 g)全部消耗完,反應過程中轉移了多少個電子?
[生]計算,教師展示學生書寫的計算過程。
求得電子轉移量為0.01 NA。
[問題驅動3]如何利用剛才得到的氯氣來制取84消毒液?
[生]用氫氧化鈉溶液吸收。
[師]我們來計算一下,要把0.005 mol的氯氣全部制成84消毒液,理論上需要2.0 mol/LNaOH溶液多少mL?
[學生分組實驗]用針筒吸取25 mL NaOH溶液,接上三通管后,聯通裝氯氣的針筒,觀察針筒內氣體體積的變化。
[追問]我們來算一下,這樣制出來的84消毒液中有效氯的理論含量有多少?能不能和市面上出售的84消毒液媲美。一般市面上的84消毒液的有效氯含量在4%-7%左右。(84消毒液有效氯指含氯化合物中氧化能力相當的氯氣量。算法:次氯酸鈉的物質的量×2×35.5÷消毒液質量,0.4 mol/LNaOH溶液密度近似等于1.1g/mL)
[生]計算得[0.005×2×35.5÷(0.005×2×35.5+5×1.1)]×100%-6%,合格。
[師]剛才我們計算并實踐了氯氣與氫氧化鈉溶液反應制84消毒液的過程。Cl:與冷的NaOH溶液反應:Cl2+2NaOH=NaCl+ NaClO+H2O,產物就是84消毒液的主要成分。但是實際上這個反應是放熱的,隨著反應溫度升高還會有副反應,Cl:與熱的NaOH溶液反應:3Cl2+6NaOH=△=5NaCl+ NaClO3+ 3H2O。
[真題展示]Cl:與NaOH溶液反應可生成NaCl、NaCIO和NaCl03,c(CI-)和c(ClO-)的比值與反應溫度有關。用24 g NaOH配成的250 mL溶液,與Cl2恰好完全反應(忽略Cl2與水的反應及溶液體積變化)。求:(I)NaOH溶液的物質的量濃度____mol/L。
(2)某溫度下,反應后溶液中c(Cl-)= 6c(ClO-),則溶液中c(CIO-)=____mol/L。
[模型構建]
氧化還原型的計算關鍵是找到電子得失守恒和原子個數守恒,再列出相應的方程式進行解答。
本試題要求學生能運用化學符號和定量計算等手段說明物質的組成及其變化,能從質量守恒的觀點看待和分析化學變化,能運用化學計量單位定量分析化學變化。
四、教學反思
項目化學習要求在課前有明確的項目主目標(制取一瓶84消毒液);在教學實施過程中對項目進行拆解,制定具體的項目規劃(次目標有:如何制取氯氣?有了氯氣怎么制84消毒液?);引導學生自主學習,合作探究(通過計算如何選擇合適的藥品量,儀器規格),項目終端要有產品展示(得到84消毒液),評價交流(有效氯含量如何?)。
1.有效情境,環環相扣
真實的情境素材能喚醒學習意愿,鏈接舊有知識,引起情感共鳴,讓學生從中發現與學習有關的問題,構建概念、提煉觀點、訓練思維、情感共鳴……情境素材越是貼近生活,越能驅動學生積極參與。本節課將枯燥的化學計算寄托在物質制取的真實情境下,讓學生帶著明確的目的去計算,為后續的84消毒液的制取打下理論基礎。如在用針筒制取氯氣的時候學生會想,要是計算不準確的話選錯了針筒,容積不夠,氯氣泄漏出來后果就不堪設想!
2.減少污染,注重環保
用針筒來制取氯氣的裝置密封性非常好,現場幾乎聞不到刺激性氣味,包括氯氣的處理全部在針筒內完成,在教室內做這個實驗完全沒有污染。
3.課后延伸,深度學習
課后學生圍著實驗儀器很感興趣,有位同學發現原來無色的濃鹽酸有點發黃,順著這個疑惑,讓學生去找原因,引導幾個比較感興趣的同學形成了一個研究小組。他們重復課堂上制取氯氣的實驗,反復研究后得出一條大家都覺得可行的結論:實驗過程中,從鹽酸的試劑瓶里吸取液體時用到了不銹鋼制取的針頭,查閱資料發現,常用的不銹鋼針頭為鐵素體不銹鋼,除了主體元素為鐵元素以外還含11%-30%的鉻元素,以及少量的鉬、鈦、鈮等元素。當針頭進入鹽酸溶液吸取液體時,與鹽酸反應形成二價鐵,二價鐵在空氣中慢慢被氧化成三價鐵之后顏色就出現黃色了。當學生得出這一結論后,再引導學生試著用實驗驗證。研究小組的同學將針頭取下后浸泡在鹽酸里,24小時后鹽酸的顏色變成了綠色。用硫氰化鉀檢驗有血紅色產生,說明的確有三價鐵離子生成,但是為什么顏色那么綠呢?聯想到三價鉻離子的顏色也是亮綠色的,應該是鉻也與鹽酸反應出現了三價鉻離子,由于條件有限,未能后續驗證。通過這次研究小組的學習,將課堂上發現的問題進行自主研究,不僅解了疑惑,還對合金、鐵及其化合物的知識有了更深刻的認識。將短短40分鐘的課堂學習延伸到課堂之外,拓展了學習場域,實現了深度學習。
參考文獻
[1] 中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[s].北京:人民教育出版社,2020.
[2] 王磊.基于學生核心素養的化學學科能力研究[Ml.北京:北京師范大學出版集團,2017.

