對弱電解質電離平衡的再認識
潘紅梅


摘? ?要:弱電解質的電離平衡是化學平衡知識的再延續。“多角度證明電離平衡的存在及全面認識電離常數”是本節教學的重、難點。本文結合教學實踐,利用定量的證據,重新認識弱電解質的電離平衡。
關鍵詞:多角度;電離平衡;存在;認識;電離常數
“弱電解質的電離平衡”是《化學反應原理》模塊專題3—“溶液中離子反應”的重要內容之一,本節內容的難點是“證明電離平衡存在”,重點“電離平衡的應用”。由于這部分內容比較抽象、理論性太強,教學中發現學生存在以下兩點問題:不能“多角度地論證電離平衡的存在”;不會“應用電離常數理解離子反應的發生”,尤其容易“割裂離子反應與電離平衡的關聯”。為了使學生理解電離平衡的實質和電離常數的意義,本文從定量的角度來突破對弱電解質電離平衡的認識。
1? 多角度證明平衡存在
1.1? 醋酸分子的電離
確定醋酸分子可電離,通常采用如下幾種定量化的對比實驗:測同濃度的鹽酸、醋酸的pH(或電導率);比較與具有相同表面積鎂條反應時,產生的氫氣體積變化;測濃度、溫度變化時醋酸的pH。下面就來呈現各組實驗數據及結果。
實驗試劑:0.1mol·L-1鹽酸、0.1mol·L-1醋酸、鎂條、0.01 mol·L-1醋酸,實驗結果見表1,表2,圖1和圖2。
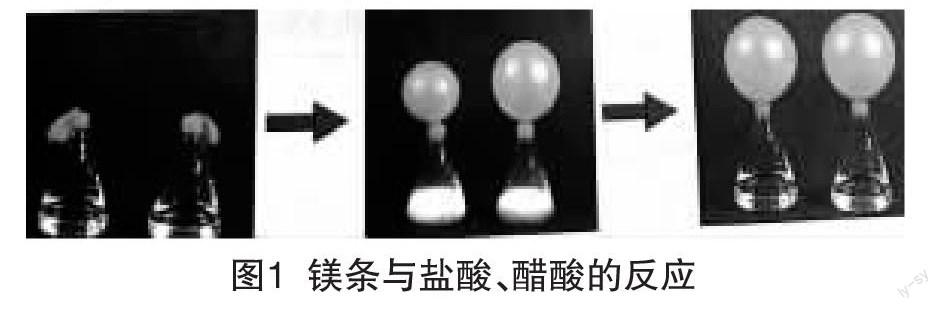
足量的具有相同表面積的鎂條投入同體積、同濃度(均為0.1mol·L-1)的鹽酸和醋酸中,剛開始,盛裝鹽酸的氣球大,反應結束后氣球一樣大,氣球大小的變化過程可用圖1表示[ 1 ]:
V(H2)-t圖像可用圖2表示:
利用醋酸、鹽酸pH大小,知道不同的酸電離程度不同,比較“強、弱酸的電離程度”,依據所測的pH值,得出“弱酸的電離程度很微弱的”特征,從而解釋了反應開始時相同濃度的醋酸與鎂條產氣慢的原因。反應結束后相同濃度的醋酸、鹽酸產氣量相等,推斷醋酸分子可以進行“分步式”電離,即鎂促進了醋酸的電離。當然,濃度、溫度也能改變醋酸的電離程度,這些現象都說明了醋酸中存在電離平衡。初步形成電離平衡和化學平衡有相似之處的意識,為后續學習電離平衡的相關知識奠定基礎。
1.2? 離子結合成分子
根據“強制弱”的反應規律,H+能與CH3COO-結合成CH3COOH分子。在尋找定量的依據、設計實驗方案的過程中,絕大多數學生都不約而同地選擇熟悉的CH3COONa作為CH3COO-的來源,殊不知,CH3COONa溶液顯堿性,會影響pH值的測定,最終選擇中性的CH3COONH4作為CH3COO-的來源,具體的實驗數據見表3。
通過測pH值,倒推溶液中c(H+)減少的原因就是與所加試劑中的CH3COO-發生了離子反應,這就要求所選試劑不能影響pH值的測定。在討論過程中,很多學生都會選擇醋酸鈉,一方面由于醋酸鈉是比較熟悉的鈉鹽,另一方面不熟悉醋酸鈉溶液的酸堿性。最終實驗方案選擇了中性醋酸銨,一來它不影響pH的測量結果,二來固態醋酸銨無需做對照實驗。
2? 全面認識電離常數
2.1? 理解“反應”“平衡”
電離常數是定量判斷水溶液酸、堿相對強弱的重要依據:電離常數越大,酸性越強。若從離子反應的角度看,酸性越弱,酸根離子結合H+能力越強。如醋酸的電離方程式:CH3COOH?CH3COO-+H+,電離常數Ka =1.76×10-5 [ 1 ]。若鹽酸與醋酸鈉溶液混合時,則發生的化學反應為:HCl(aq)+CH3COONa(aq)=CH3COOH(aq)+NaCl(aq),其平衡常數K=,學生很容易判斷該混合溶液以“離子反應”為主。
2.2? 判斷“水解”“分解”
若加熱飽和NaHCO3溶液,則產生CO2氣體。CO2是水解產物還是分解產物?可以利用電離常數進行解釋:NaHCO3溶液中存在三個平衡關系:HCO+H2O?H2CO3+OH-(K=)、HCO+H2O?CO+H3O+(Ka2)、 OH-+H3O+?2H2O。根據“當一種離子同時參與多個平衡時,其濃度皆相同”的多重平衡規則。因此,上述三個平衡相加得:2HCO?H2CO3+CO,K=,K1 2.3? 解釋“水解”“電離” 飽和NaHCO3溶液中加入CaCl2溶液時產生白色沉淀CaCO3,從微觀角度定量分析如下:隨著CaCl2溶液的加入,Ca與CO結合生成CaCO,使NaHCO溶液中HCO的電離程度大于其水解程度。即HCO?CO+H是體系中的主要平衡,HCO結合電離出的H形成HCO ,反應方程式為:Ca+2HCO =CaCO↓+HO+CO↑。設此反應的平衡常數為K,則 K= = ===4.76×10 從平衡常數K=4.76×10,可以判斷上述反應比較完全,剛好定量解釋了不用CaCl2溶液鑒別Na2CO3、NaHCO3的原因。 若向NaHCO3溶液中加入Al2(SO4)3溶液時,先產生白色沉淀Al(OH)3隨后有氣體CO2生成。從宏觀現象分析,產生CO2氣體的原因是碳酸濃度升高的結果,需要HCO水解平衡正向移動并作為復雜體系的主平衡。即體系中HCO的水解程度大于其電離程度。總而言之,HCO究竟是“水解”為主還是“電離”為主,取決于體系中微粒間能否再發生相互作用。 2.4? 計算電離常數 “H2CO3、HCO、CO”是水溶液中常見的三種含碳元素的微粒,習題中我們會遇見它們在水溶液中的分布圖(見圖4),圖像的橫坐標為溶液的pH,縱坐標是微粒的量分數,并會出現交點。結合圖像及電離常數的表達式,可計算出交點處的pH數值就是對應酸的電離常數pK。由于碳酸是二元弱酸,其微粒組分的分布圖像就有兩個交點,pK對應第一個交點(A)處的pH值,pK對應第二個交點(B)的pH值。當然,除此之外,還能判斷微粒所處溶液的酸堿性:H2CO3溶液的pH在5左右,NaHCO3溶液的pH約為8-9。 5 分析反應產物 少量CO2通入NaClO(或苯酚鈉)溶液時,為什么生成NaHCO3而不是Na2CO3?根據電離常數定性地判斷:CO2溶于水形成H2CO3,由于H2CO3的酸性大于HClO(或苯酚)的酸性,溶液中:H2CO3 ?H++HCO,ClO- +H+ =HClO。但HClO(或苯酚)的酸性大于HCO的酸性,故HCO不會繼續電離。亦可用電離常數,定量地解釋少量CO2通入NaClO(或苯酚鈉)溶液生成NaHCO3的原因,具體的過程如下: 設NaClO+H2O+CO2=NaHCO3+HClO平衡常數為K則 K= = = == 14.58 設2NaClO+H2O+CO2=Na2CO3+2HClO平衡常數為K2則 K2= = == 2.77×10-2 由兩個化學反應的平衡常數可以斷定:向次氯鈉溶液中通入CO2,無論CO2的量如何,次氯酸鈉溶液與二氧化碳的反應都生成碳酸氫鈉。 3? 小結 弱電解質電離平衡的教學關鍵點是幫助學生多角度建立電離平衡的存在:有的基于實驗現象與實驗數據,有的則需要推理論證進而設計方案。理解了弱電解質的電離存在平衡,接下來就要整明白電離平衡的意義所在,這樣的教學規律,符合學生的認識發展過程,能不斷提高學生的科學探究能力,從而落實學生學科核心素養的達成。 參考文獻: [1] 王祖浩.化學反應原理(選擇性必修一)[M].南京:鳳凰教育出版社,2021:81.

