天麻通過腦腸軸對腦出血大鼠的保護機制
朱世杰 寇云芳 吳云 田維毅 周凌云 羅亞非 唐中生 陳萬浩 段學清


摘要 目的:探究黔產天麻通過調節腦-腸軸對蛛網膜下腔出血(SAH)大鼠的保護作用及機制。方法:選取成年雄性大鼠60只,采用血管內刺破法建立SAH模型,并隨機分為假手術組、模型組、天麻低、中、高濃度組,5組分別給予相應處理1周后進行造模,24 h后取材,利用HE染色觀察病理學變化,免疫組織化學染色、蛋白免疫印跡檢測神經遞質5-羥色胺轉運體基因連鎖多態區(5-HTTLPR)、降鈣素基因相關肽(CGRP)、白細胞介素-4(IL-4)表達情況。結果:與模型組比較,天麻低、中、高濃度組大鼠腦和空腸的病理學變化較輕,但存在神經細胞不同程度的核固縮、變性的情況,空腸絨毛存在脫落、上皮下間隙擴大、毛細血管擴張等病理學變化;與模型組比較,假手術組、天麻中濃度組和高濃度組大鼠海馬和空腸中5-HTTLPR、CGRP的表達顯著性提高,IL-4表達降低顯著,差異有統計學意義(均 P <0.01),與假手術組比較,天麻高、中濃度組大鼠海馬和空腸中5-HTTLPR、CGRP的表達提高及IL-4表達降低顯著(均 P <0.01)。結論:天麻通過腦-腸軸調節5-HTTLPR、CGRP、IL-4因子的表達,發揮對腦出血大鼠腦和腸道的保護作用,尤以天麻高濃度溶液的效果更為顯著。
關鍵詞 腦-腸軸;腦出血;天麻;中藥;炎癥;機制;損傷;大鼠
Mechanism of Gastrodiae Rhizoma in Protecting Rats with Cerebral Hemorrhage through Brain-Gut Axis
ZHU Shijie1,KOU Yunfang1,WU Yun2,TIAN Weiyi1,ZHOU Lingyun3,LUO Yafei1,TANG Zhongsheng1,CHEN Wanhao1,DUAN Xueqing1
(1 Guizhou University of Traditional Chinese Medicine,Guiyang 550025,China; 2 Zunyi Hospital of Traditional Chinese Medicine,Zunyi 563000,China; 3 The Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine,Guiyang 550002,China)
AbstractObjective: To explore the efficacy and mechanism of Gastrodiae Rhizoma produced in Guizhou Province in protecting the rats with cerebral hemorrhage by regulating brain-gut axis. Methods: Sixty adult male rats were randomly assigned into a sham operation group,a model group,and low-,medium-,and high-dose Gastrodiae Rhizoma groups.After corresponding treatments for a week,the model was established.After 24 h,the samples were collected for observation of the pathological changes by hematoxylin-eosin(HE) staining.Immunohistochemistry and Western blotting were employed to determine the expression of the neurotransmitters serotonin-transporter-linked promoter region(5-HTTLPR),calcitonin gene-related peptide(CGRP),and interleukin-4(IL-4). Results: Compared with the model group,the Gastrodiae Rhizoma groups showed slight pathological changes of brain and jejunum,karyopyknosis and degeneration of nerve cells,and shedding,subepithelial space enlargement,and capillary dilatation of jejunal villi.Compared with the model group,the medium-and higher-dose Gastrodiae Rhizoma groups and sham operation group presented up-regulated expression of 5-HTTLPR and CGRP and down-regulated expression of IL-4 in hippocampus and jejunum( P <0.01).Furthermore,the medium-and higher-dose Gastrodiae Rhizoma groups showed higher expression of 5-HTTLPR and CGRP and lower expression of IL-4 in hippocampus and jejunum than the sham operation group( P <0.01). Conclusion: Gastrodiae Rhizoma can regulate the expression of 5-HTTLPR,CGRP,and IL-4 through brain-gut axis to protect rats from cerebral hemorrhage.In particular,high-dose Gastrodiae Rhizoma demonstrated remarkable effect.60B3D286-45BD-45E0-A708-8AFC591F72C3
Keywords Brain-gut axis; Cerebral hemorrhage; Gastrodiae Rhizoma; Chinese herb medicine; Inflammation; Mechanism; Injury; Rat
中圖分類號:R282;R743 文獻標識碼:A ?doi: 10.3969/j.issn.1673-7202.2022.09.017
蛛網膜下腔出血(Subarachnoid Hemorrhage,SAH)是出血性腦血管疾病的一種,約占急性腦卒中的10%,具有發病迅速、病死率高、病情嚴重的特點[1]。該病不僅可以引起腦部損傷,還可以通過腦-腸軸引起胃腸道病變,如胃腸道炎癥、出血、腸梗阻等癥狀,嚴重影響后期的愈后康復,也給患者帶來巨大的經濟及心理壓力[2]。
天麻是中醫用于防治腦血管疾病常用的植物藥材之一,也是我國生活中常用的食材,具有息風止痙、平抑肝陽、祛風通絡等功效[3-4], 其主要化學成分有天麻素、多糖類、腺苷類等,具有多靶點作用[5-6]。有實驗研究表明,天麻可以通過調節多個信號通路中關鍵因子,改善腦出血后對腦和腸道的損傷,但機制尚待進一步研究。本團隊對大鼠以不同濃度天麻溶液灌胃,探究天麻溶液對SAH大鼠的保護作用機制。
1材料與方法
1.1材料
1.1.1動物選用成年SD大鼠60只,雄性,體質量280~300 g,購于長沙市天勤生物技術有限公司,合格證號:【SCXK】2019-0014,無特定病原體(Specific Pathogen Free,SPF)級,經學校實驗動物管理委員會批準,飼養于基礎醫學院課題組動物房,其溫度在20~24 ℃,相對濕度35% ~40%,噪聲控制80分貝以下,保持持續通風換氣,定期投喂水和飼料。
1.1.2藥物黔產天麻購于貴州中醫藥大學第一附屬醫院,用時將天麻流水洗凈,干燥粉碎后加大于天麻重量10倍的純水,煎煮1 h/次,煎煮3次,總時間不超過3 h,過濾,濃縮至約原藥材1 g/mL,稀釋成所需要濃度存放于4 ℃冰箱保存備用。
1.1.3試劑5-羥色胺轉運體基因連鎖多態區(5-hydroxytryptamine Transporter Gene-linked Polymorphic Region,5-HTTLPR)(BOSTER,批號:BA3707-1),降鈣素基因相關肽(Calcitonin Gene-related Peptide,CGRP)(碧云天,批號:AF6495),白細胞介素-4(Interleukin-4,IL-4)(BOSTER,批號:BA0980-1)。
1.2方法
1.2.1分組與動物模型制作將動物隨機分為5組,每組12只,即假手術(A)組、模型(B)組、天麻低濃度(C)組(50 mg/kg)、天麻中濃度(D)組(100 mg/kg)、天麻高濃度(E)組(150 mg/kg)[7]。采取頸內動脈穿刺法建立SAH模型。應用戊巴比妥鈉,濃度1%,劑量35 mg/kg,經腹腔注射麻醉后,把SD大鼠仰臥固定,頸正中切口,逐層鈍性分離出右側頸總動脈、頸外動脈。在近心端電凝切斷頸外動脈,分離并夾閉頸內動脈和頸總動脈,避免夾持迷走神經,游離并電凝頸內動脈的側支小動脈,在頸外動脈剪V形切口,將修制的4號尼龍線從切口導入,至出現落空感后,迅速抽出并結扎頸外動脈。松開頸總動脈上的動脈夾恢復血流,逐層縫合并消毒。整個手術過程用電熱毯將大鼠體溫保持為(37±1)℃。假手術組在線栓遇到阻力后停止插入。
1.2.2動物給藥給藥各組大鼠在造模前1周,分別進行天麻低、中、高濃度提取液灌胃,2次/d,3 mL/次,假手術組和模型組給予等量的0.9%生理鹽水。
1.2.3HE染色各組大鼠麻醉后,將0.9%生理鹽水約400 mL,用灌注針經升主動脈注入,沖洗至心臟溢出的液體為清澈,然后將4%多聚甲醛約300 mL/只,用灌注針經升主動脈注入,滴注時間約15 min/只,待標本固定后,快速斷取腦和空腸,放入4%多聚甲醛中后固定過夜。常規石蠟包埋切片,按照HE染色的步驟進行梯度染色,其中蘇木精染色時間為5 min,伊紅染色時間為1 min。
1.2.4免疫組織化學法將各組大鼠腦和空腸的石蠟切片梯度脫蠟后,0.3% H2O2室溫孵15 min,5%牛血清白蛋白(Bovine Serum Albumin,BSA)室溫孵育1 h;分別依次滴加5-HTTLPR、CGRP、IL-4抗體(1∶ 200),4 ℃過夜;次日滴加二抗工作液,37 ℃孵育1 h;二氨基聯苯胺(3,3′-diaminobenzidine,DAB)顯色3 s,蘇木精復染,梯度乙醇脫水,二甲苯透明后中性樹脂封片。每步驟間均用0.01 mol/mL磷酸鹽緩沖溶液(Phosphate Buffered Saline,PBS)洗滌5 min×3。最后,每張切片在顯微鏡下隨機觀察3個視野,采用Image-Pro Plus 10.0軟件統計每張圖片的陽性細胞數。
1.2.5蛋白免疫印跡法各組取海馬和空腸組織加入適量RIPA(細胞裂解液)提取液提取蛋白離心,收集上清液,再按細胞蛋白提取試劑盒說明進行蛋白提取,檢測蛋白濃度。將制備好的蛋白樣品加入凝膠中電泳,轉膜,取膜。5%BSA室溫封閉1 h,5-HTTLPR、CGRP、IL-4抗體(1∶ 300)和小鼠抗大鼠肌動蛋白多克隆抗體(1∶ 3 000)過夜。復溫1 h后滴加相應二抗,辣根過氧化物酶(Horseradish Peroxidase,HRP)標記山羊抗兔抗體(1∶ 1 000),室溫孵育2 h。 洗滌后,在聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)膜上滴加ECL發光液,放于凝膠成像儀中,開始曝光,用發光凝膠成像系統軟件進行圖像分析。60B3D286-45BD-45E0-A708-8AFC591F72C3
1.3統計學方法采用Sigma Plot 18.0統計軟件進行實驗數據的統計分析,數據以均值±標準差( ?±s )表示。應用單因素方差分析(ANOVA)對免疫蛋白印跡檢測的條帶灰度值進行組間比較,以 P <0.05為差異有統計學意義。
2結果
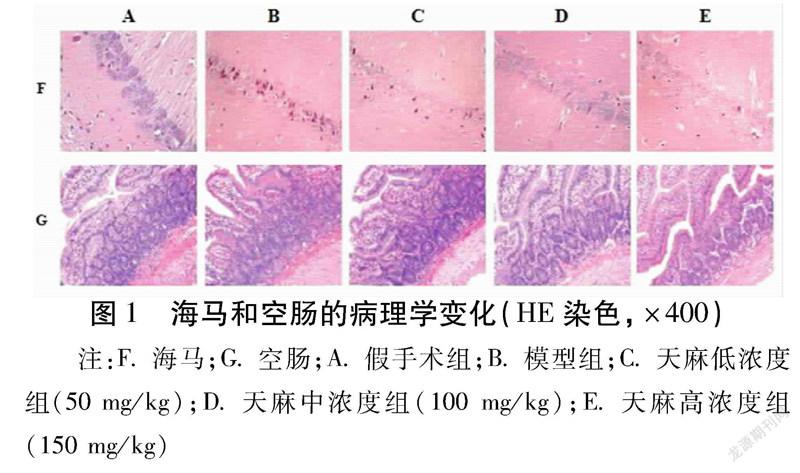
2.1海馬和空腸組織病理學變化
假手術組大鼠海馬和空腸組織細胞排列基本均勻規則,胞核呈圓形或橢圓形,核仁明顯,染色均勻,正常細胞較多;模型組大鼠海馬和空腸組織細胞排列雜亂松散,細胞腫脹、細胞空泡化較多,核固縮而核周體消失嚴重,空腸黏膜上皮下間隙擴大,腸絨毛脫落,腸組織結構破壞較重;天麻溶液不同濃度灌胃的大鼠海馬區正常細胞胞核圓形或橢圓形,核仁清晰,染色質豐富,排列較密,存在相對少量因核固縮、胞質空泡化而發生變性的神經細胞,空腸黏膜上皮下間隙擴大、毛細血管擴張不明顯。見圖1。
2.25-HTTLPR在腦和空腸的表達情況
與模型組比較,其余4組大鼠海馬和空腸中5-HTTLPR表達顯著提高( P <0.01);與假手術組比較,天麻中、高劑量組大鼠海馬和空腸中5-HTTLPR表達顯著,差異有統計學意義(均 P <0.01);天麻低濃度組5-HTTLPR表達量雖有提高,但差異沒有統計學意義( P >0.05),與天麻中劑量組比較,天麻高劑量組更能提高大鼠海馬和空腸中5-HTTLPR表達( P <0.01)。見圖2~3。2.3CGRP在腦和空腸的表達情況
與模型組比較,其余4組大鼠海馬和空腸中CGRP表達水平顯著提高,差異有統計學意義(均 P <0.01);與假手術組比較,天麻中、高劑量組大鼠海馬和空腸中CGRP表達水平上調顯著,且差異有統計學意義(均 P <0.01);天麻低濃度組CGRP表達水平有上升,但差 異有統計學意義( P >0.05),與天麻中劑量組比較,天麻高劑量組更能提高CGRP在大鼠海馬和空腸中的表達水平( P <0.01)。見圖4~5。
2.4IL-4在腦和空腸的表達情況與假手術組比較,其余4組大鼠海馬和空腸中IL-4表達明顯上升,差異有統計學意義(均 P <0.01);與模型組比較,IL-4在天麻中、高劑量組大鼠海馬和空腸中表達水平下降明顯,差異有統計學意義(均 P <0.01);天麻低濃度組海馬和空腸中IL-4表達水平雖然有所下降,但差異沒有統計學意義( P >0.05),與天麻中劑量組比較,天麻高劑量組大鼠海馬和空腸中IL-4表達水平下調更為顯著( P <0.01)。見圖6~7。
3討論
蛛網膜下腔出血是由分布于腦的血管破裂引起的一種常見急性腦損傷疾病,分為自發和繼發2種類型。研究證明,蛛網膜下腔出血后的主要病理學變化以炎癥、血管痙攣、水腫、細胞凋亡等為主[8-12],病理學變化之間相互交織影響發展,最終導致腦實質性損傷引起死亡或伴發其他臟器的損傷如胃腸道出血、便秘等,在此過程中,炎癥起重要作用[12]。
蛛網膜下腔出血既可以引起腦損傷,還能通過腦-腸軸引起胃腸道諸多的病理學變化,目前多認為是通過神經系統、免疫系統、內分泌系統等途徑[13],借助溝通腦腸信息的腦腸肽來進行。而腦腸肽是分布于胃腸和神經系統的肽類物質,如5-HT、CGRP等[14-15],具有連接和調控腦和腸道信息介質交換通暢的功能。其中5-HT是腦腸通路中重要的單胺類遞質,受其編碼的轉運體基因啟動因子5-HTTLPR和調控[16],大部分由腸道的嗜鉻細胞合成,其受體多存在于嗜酸性粒細胞、嗜堿性粒細胞、肥大細胞等免疫細胞上,具有調節炎癥介質表達、影響中樞神經系統對胃腸道的調節作用,如調節其他神經遞質在胃腸組織的水平及腸道絨毛、隱窩的變化等作用[17-18]。CGRP是利用基因重組技術發現的由氨基酸組成的多肽物質,廣泛存在于腦和腸道組織中,可以通過舒張其組織中的血管及直接作用于巨噬細胞和樹突狀細胞,抑制上述細胞產生炎癥介質[19-20]。IL-4可由樹突狀細胞、肥大細胞、T/B細胞等多種免疫細胞分泌,是多功能細胞因子,在腦和胃腸道的炎癥反應、免疫反應中起重要作用[21-22]。
天麻是一種產于貴州、云南、四川等地的藥食兩用植物,具有息風止痙,平抑肝陽,祛風通絡的功效,現代藥理證明其化學成分為天麻苷、多糖、維生素A、氨基酸等[23],具有鎮痛抗炎、抗氧化及改善缺血等作用[24-26],有較高的臨床應用價值,但具體作用機制尚未完全闡明。本實驗采用不同濃度的天麻液灌胃大鼠1周,觀察其對SAH大鼠引起的腦損傷和腸損傷的保護效果及其作用機制,實驗結果顯示,與模型組比較,給予7 d天麻中、高濃度溶液灌胃后,能顯著提高5-HTTLPR、CGRP在SAH大鼠海馬和空腸部位的表達,下調炎癥介質IL-4的表達水平;而與假手術組比較,天麻低濃度溶液對5-HTTLPR、CGRP表達的影響差異無統計學意義,說明給予天麻中、高濃度溶液能明顯提高腦和空腸組織中提高5-HTTLPR、CGRP的表達,下調IL-4表達水平,起對SAH大鼠海馬和空腸組織的保護作用,降低SAH引起的大鼠腦和腸道的損傷。但該實驗對SAH大鼠海馬和空腸中5-HTTLPR、CGRP、IL-4指標的觀察時間較短,對于長期的影響效果有待進一步研究。
總之,天麻能通過腦-腸軸抑制蛛網膜網下腔出血引起的大鼠腦和腸道的損傷,其中以天麻高濃度溶液灌胃的效果最好,作用機制可能與提高5-HTTLPR、CGRP的表達下調IL-4表達水平有關。
參考文獻
[1]趙忠惠,郝廣志,鄒正,等.Claudin-1在蛛網膜下腔出血小鼠早期腦損傷過程中的變化[J].神經解剖學雜志,2020,36(5):507-511.
[2]梁恩,麥樹榮,何嘉偉,等.綠茶多酚通過抑制TLR4通路減輕蛛網膜下腔出血大鼠早期腦損傷[J].免疫學雜志,2021,37(2):122-127.60B3D286-45BD-45E0-A708-8AFC591F72C3
[3]柳威,鄧林華,祁東利,等.天麻及其有效成分的藥理作用概述[J].中藥藥理與臨床,2021,37(4):240-244,12.
[4]李平,許金國,季德,等.天麻飲片傳統性狀與內在品質相關性研究[J].中國中藥雜志,2019,44(20):4460-4466.
[5]郜玉鋼,顧沛沛,臧埔,等.HPLC法同時檢測人參、天麻及其復方中21種活性成分[J].中華中醫藥學刊,2021,39(12):1-5.
[6]楊沙,段燦燦,張建永.基于ADME及網絡藥理學的天麻治療原發性頭痛的作用機制研究[J].中藥材,2018,41(8):1963-1969.
[7]周建,陶陶,徐堅,等.天麻對缺氧引起大鼠大腦皮質神經元細胞凋亡的保護作用[J].中華中醫藥雜志,2013,28(3):640-644.
[8]Rumalla K,Smith KA,Arnold PM,et al.Subarachnoid Hemorrhage and Readmissions:National Rates,Causes,Risk Factors,and Outcomes in 16,001 Hospitalized Patients[J].World Neurosurg,2018,110:e100-e111.
[9]Zuo G,Zhang T,Huang L,et al.Activation of TGR5 with INT-777 attenuates oxidative stress and neuronal apoptosis via cAMP/PKCε/ALDH2 pathway after subarachnoid hemorrhage in rats[J].Free Radic Biol Med,2019,143:441-453.
[10] Wang M,Cheng L,Chen ZL,et al.Hyperbaric oxygen preconditioning attenuates brain injury after intracerebral hemorrhage by regulating microglia polarization in rats[J].CNS Neurosci Ther,2019,25(10):1126-1133.
[11]Rass V,Ianosi BA,Wegmann A,et al.Delayed Resolution of Cerebral Edema Is Associated With Poor Outcome After Nontraumatic Subarachnoid Hemorrhage[J].Stroke,2019,50(4):828-836.
[12]Coulibaly AP,Provencio JJ.Aneurysmal Subarachnoid Hemorrhage:an Overview of Inflammation-Induced Cellular Changes[J].Neurotherapeutics,2020,17(2):436-445.
[13]Cryan JF,O′Riordan KJ,Cowan,CSM,et al.The Microbiota-Gut-Brain Axis[J].Physiol Rev,2019,99(4):1877-2013.
[14]Chung JY,Jeong JH,Song J.Resveratrol Modulates the Gut-Brain Axis:Focus on Glucagon-Like Peptide-1,5-HT,and Gut Microbiota[J].Front Aging Neurosci,2020,12:588044.
[15]Pendharkar SA,Walia M,Drury M,et al.Calcitonin gene-related peptide:neuroendocrine communication between the pancreas,gut,and brain in regulation of blood glucose[J].Ann Transl Med,2017,5(21):419.
[16]Chan F,Lanctt KL,Feinstein A,et al.The serotonin transporter polymorphisms and major depression following traumatic brain injury[J].Brain Inj,2008,22(6):471-479.
[17]Martins-Perles J,Zignani I,Souza S,et al.QUERCETIN SUPPLEMENTATION PREVENTS CHANGES IN THE SEROTONIN AND CASPASE-3 IMMUNOREACTIVE CELLS OF THE JEJUNUM OF DIABETIC RATS[J].Arq Gastroenterol,2019,56(4):405-411.
[18]Hao MM,Fung C,Boesmans W,et al.Development of the intrinsic innervation of the small bowel mucosa and villi[J].Am J Physiol Gastrointest Liver Physiol,2020,318(1):G53-G65.
[19]Theoharides TC,Tsilioni I,Bawazeer M.Mast Cells,Neuroinflammation and Pain in Fibromyalgia Syndrome[J].Front Cell Neurosci,2019,13:353.60B3D286-45BD-45E0-A708-8AFC591F72C3
[20]Sheng Y,Zhu L.The crosstalk between autonomic nervous system and blood vessels[J].Int J Physiol Pathophysiol Pharmacol,2018,10(1):17-28.
[21]d′Avila JC,Siqueira LD,Mazeraud A,et al.Age-related cognitive impairment is associated with long-term neuroinflammation and oxidative stress in a mouse model of episodic systemic inflammation[J].J Neuroinflammation,2018,15(1):28.
[22]Leyva-Castillo JM,Galand C,Kam C,et al.Mechanical Skin Injury Promotes Food Anaphylaxis by Driving Intestinal Mast Cell Expansion[J].Immunity,2019,50(5):1262-1275.e4.
[23]張志龍,郜玉鋼,臧埔,等.天麻素、對羥基苯甲醇對中樞神經系統作用機制研究進展[J].中國中藥雜志,2020,45(2):312-320.
[24]雷娜,柳麗松,韓春妮,等.云南昭通三種天麻鎮痛抗炎作用的比較研究[J].時珍國醫國藥,2015,26(1):13-15.
[25]高玉梅,王曉玲,鄧于新,等.天麻粉預防癡呆小鼠模型發病及其對抗氧化作用的影響[J].中國實驗方劑學雜志,2020,26(2):52-58.
[26]蔣清偉,王威,劉姝暢,等.柱前衍生化HPLC法測定天麻提取物中18種氨基酸含量[J].中國新藥雜志,2020,29(15):1785-1790.
(2021-04-11收稿本文編輯:楊覺雄)
基金項目:貴州省中醫藥管理局中醫藥、民族醫藥科學技術研究課題(QZYY2018112);貴州省科技廳科技合作項目(黔科合LH[2016]7121號);貴州中醫藥大學校內課題(貴中醫科院內[2018]52號;貴州省科技創新人才團隊(黔科合平臺人才[2020]5010);貴州省發改委工程研究中心建設項目(黔發改高技[2020]896號)作者簡介:朱世杰(1986.05—),男,碩士,講師,研究方向:中藥對腦血管及免疫系統的影響,E-mail:zhu3514@163.com通信作者:羅亞非(1965.07—),男,碩士,教授,碩士研究生導師,研究方向:腦血管疾病的形態學研究,E-mail:944943527@qq.com60B3D286-45BD-45E0-A708-8AFC591F72C3

