外源激素對灰霉菌脅迫下月季花器官生理生化指標的影響
高鵬華,王其剛,晏慧君,蹇洪英,周寧寧,鄢 波,唐開學,邱顯欽,2
(1. 園林園藝學院,西南林業大學/國家林業局西南風景園林工程技術研究中心/云南省功能性花卉資源及產業化技術工程研究中心,昆明 650024;2. 云南省農業科學院花卉研究所,昆明 650205;3. 國家觀賞園藝工程技術研究中心,昆明 650205)
【研究意義】月季是世界第一大切花,具有重要的觀賞價值和經濟價值[1-2]。灰霉病是月季采后運輸過程中第一大真菌病害[3]。月季灰霉病是由灰葡萄孢菌(Botrytiscinerea)引起的,通常在月季發育早期附著在月季花器官表面,在采后運輸過程中爆發,每年約15%~40%的切花月季由于采后腐敗給切花月季市場造成巨大的經濟損失[4-5]。目前,生產中主要通過噴施化學藥劑進行防治,這不僅增加了生產成本還對環境造成了污染和破壞。因此,尋求更加有效的方法增強切花月季對灰霉菌的抗性對切花月季產業發展具有非常重要的意義。【前人研究進展】病原菌侵染過程中會導致植物體內發生一系列生理生化的變化,如活性氧、酶活性以及光合作用和呼吸作用等,以減輕植物受病原菌傷害的程度[6]。植物內源激素如水楊酸、乙烯、茉莉酸等能夠通過誘導抗病相關基因的表達參與對病蟲害的防御[7-8]。有研究表明,在番茄(Lycopersiconesculentum)中噴施水楊酸可顯著提高水楊酸合成途徑中PRs類基因的表達,增強其對灰霉病的抗性[9-10]。在蘋果(Malusdomestica)中,水楊酸通過誘導其防御酶活性,提高抗病相關蛋白活性,降低膜脂的過氧化程度,增強蘋果對灰霉病的抗性[11]。然而,在擬南芥(Arabidopsisthaliana)中,水楊酸(Salicylic acid, SA)含量的增加對擬南芥灰霉病抗性沒影響或只在原發感染部位產生抗性[12]。還有研究表明,月季[13-14]、葡萄(Vitisvinifera)[15]在油菜素內酯(Brassinolide, BR)處理后增強了對灰霉菌的抗性。外源茉莉酸(Jasmonic acid, JA)、1-氨基環丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid, ACC)和乙烯(Ethylene, ET)氣體處理增強了月季花瓣對灰霉菌的抗性[16]。【本研究切入點】近年來,對月季灰霉病的研究主要集中在病原菌分離鑒定、抗性評價、灰霉病相關抗病基因的研究[16-20]。對于不同激素處理后,切花月季灰霉病抗性影響及生理生化的變化還未見報道。【擬解決的關鍵問題】因此本研究以月季模式品種‘月月粉’(Rosachinensis‘Pallida’)為材料,對其在不同激素處理后的生理生化指標變化情況進行測定,探索不同激素對月季灰霉病的抗性誘導機制,以期為月季采后灰霉病的防治提供一定的理論參考。
1 材料與方法
1.1 試驗材料
選用云南省農業科學院月季種植基地保存的古老月季品種‘月月粉’(Rosachinensis‘Pallida’)為供試材料。
1.2 試驗方法
試驗于2020年7—10月在云南省國家工程花卉中心實驗室內進行。
灰霉菌采用本課題組前期鑒別出的月季灰霉病菌生理小種A型、B型和C型混合種。
‘月月粉’正常生長3個月后開始進行處理。參考Cao等[16]的方法,分別將處于開花第二期的‘月月粉’瓶插入水(對照,CK)及JA(50 μmol),SA(100 μmol),ACC(100 μmol),ABA(100 μmol)和BR(5 μmol)溶液24 h,每處理重復12支花。
處理后的月季花瓣用打孔器打成9 mm的花瓣圓盤,將花瓣圓盤置于水瓊脂培養基(0.4%)中,每個花瓣圓盤中央滴加2 μL灰霉菌懸浮液(105conidia/mL),分別培養0、36、60、72 h后對其生理指標進行測定,每個處理重復3次。
1.3 測定指標及方法
超氧化物歧化酶(Superoxide dismutase, SOD)活性,過氧化物酶(Peroxidase, POD)活性,幾丁質酶(Chitinase, CHT)活性,多酚氧化酶(polyphenol oxidase, PPO)活性和β-1,3葡聚糖酶(β-1,3-glucanase, β-1,3-GA)活性測定采用酶聯免疫試劑盒測定,具體測定方法參照Gao等[19]。
1.4 數據統計與分析
試驗數據運用軟件Excel 2016進行作圖分析,并結合軟件SPSS 19.0進行方差分析、Pearson相關性分析和檢驗的差異分析。
2 結果與分析
2.1 灰霉菌對月季防御酶活性及合成相關基因的表達分析
受到病原菌侵染后植物會產生一系列的防御反應,因此在0、36、60和72 h時分別對接種灰霉菌的月季花器官的防御酶PPO、CHT、POD、SOD和GLU的酶活性進行測定。結果發現,PPO、GLU和POD活性在病原菌侵染過程中持續顯著升高,在36、60和72 h 時PPO活性分別提升了5.72%,41.87%,59.66%;GLU活性分別提升78.65%,86.86%,88.92%;POD活性分別提升了26.13%,51.35%,55.86%;CHT活性在月季感染灰霉菌60 h后顯著升高,在60和72 h分別提升了17.9%和24.65%;SOD活性呈現持續顯著下降的趨勢,在36、60和72 h分別下降了37.18%,39.64%,56.65%(圖1)。
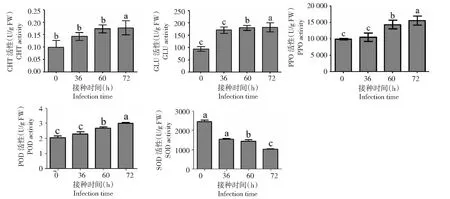
所有統計分析均采用Studen’s t-檢驗,同一小幅圖中不同小寫字母表示處理間差異顯著(P<0.05),下同
為了闡明月季抗灰霉菌的分子基礎,對感染灰霉菌的月季花器官PPO、POD和GLU合成相關基因RcPPO,RcPOD和RcBGLU的表達量進行了分析(圖2),結果RcPPO,RcPOD和RcBGLU基因的表達量均顯著增高,表明灰霉菌的侵染激活了月季體內抗性相關酶合成基因的表達。
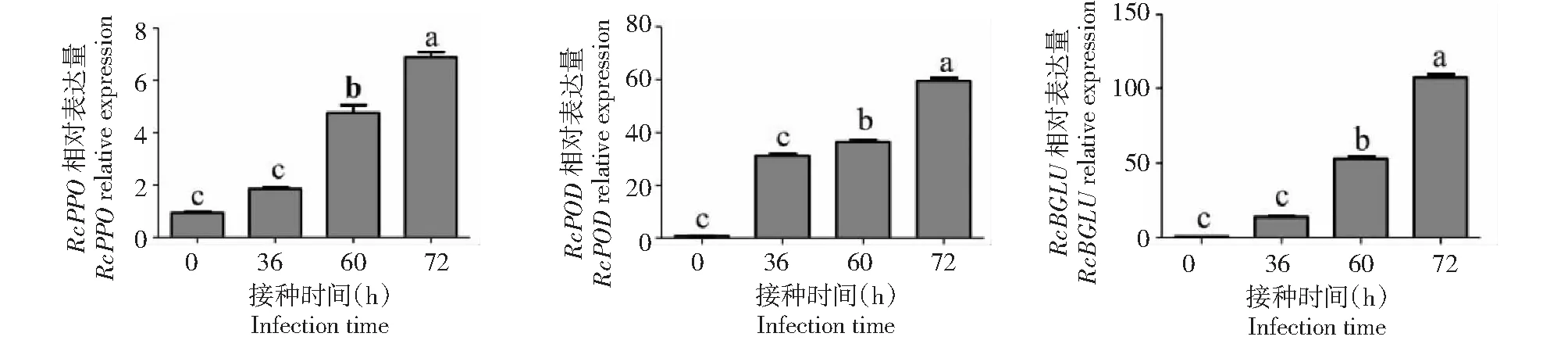
圖2 灰霉菌脅迫下月季花器官RcPPO,RcPOD和RcBGLU基因表達量分析
2.2 外源激素對灰霉菌侵染的月季花器官酶活性的影響
為了進一步探究月季對灰霉菌的抗病機制,利用外源JA、SA、ABA、ET和BR作為誘導劑對月季感染灰霉病不同時間點的防御酶活性進行測定。
SOD活性:與對照比較,SA和ACC處理后月季花器官SOD活性顯著升高,隨著接種灰霉菌時間延長,SA和ABA處理SOD活性在36、60和72 h時均顯著低于對照;ACC處理的花器官在接種灰霉菌36、60和72 h時其SOD活性在無顯著差異;JA處理的花器官,在接種灰霉菌72 h時其SOD活性顯著升高;BR處理的花器官,其SOD活性隨著灰霉菌侵染時間的延長在36、60和72 h時均顯著高于對照;處理兩兩比較發現,JA處理和BR處理后,隨著灰霉菌侵染時間的延長花器官SOD活性在36、60和72 h時均顯著高于其他處理(圖3)。由此可知,外施JA和BR可顯著提高灰霉菌脅迫下月季花器官的SOD活性。
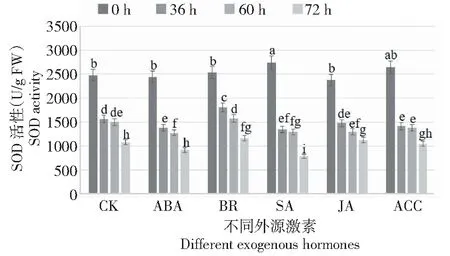
圖3 灰霉菌脅迫下外源激素處理月季花器官SOD酶活性變化
GLU活性:ABA處理后月季花器官在灰霉菌侵染36 h的GLU活性最高,顯著高于對照,灰霉菌侵染72 h 的GLU活性顯著低于對照,表明在灰霉菌脅迫下ABA處理只能在一段時間內提高月季花器官的GLU活性,隨著侵染時間的延長GLU活性逐漸降低;JA和ACC處理的花器官GLU活性在灰霉菌脅迫0、36、60和72 h持續顯著升高,且均顯著高于對照;SA處理的花器官在灰霉菌脅迫過程中均顯著高于對照,在60 h其GLU活性最高;BR處理的花器官在灰霉菌脅迫60和72 h時,其GLU活性均顯著高于對照;處理組兩兩比較發現,BR、SA、JA和ACC處理的花器官在灰霉菌脅迫下GLU活性均顯著提高(圖4)。由此可知,外源BR、SA、JA和ACC處理能夠顯著提高月季花器官在灰霉菌脅迫下的GLU活性。
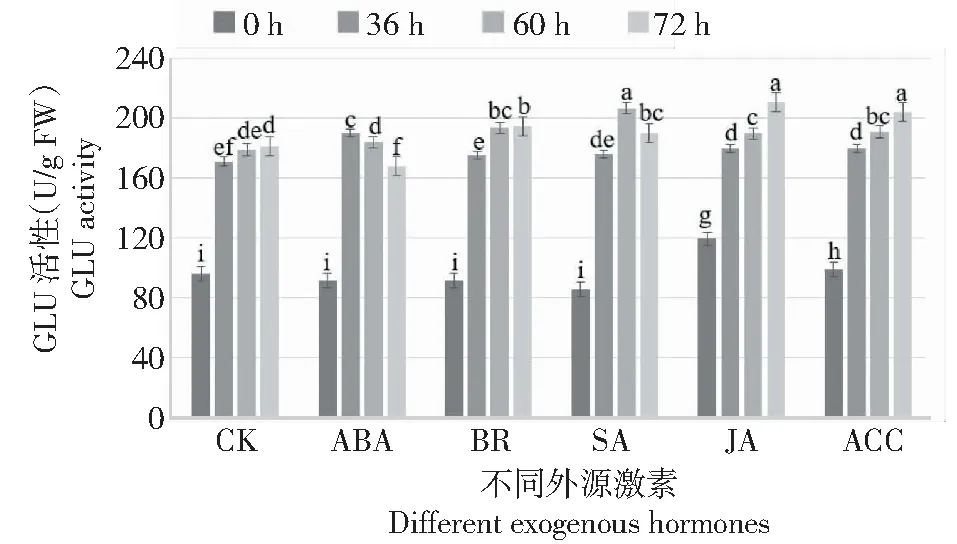
圖4 灰霉菌脅迫下外源激素處理月季花器官GLU酶活性變化
PPO活性:ABA處理的花器官在灰霉菌脅迫36和60 h時其PPO活性顯著高于對照,灰霉菌脅迫72 h 時其PPO活性下降顯著低于對照組,呈先上升后下降的趨勢;BR、SA、JA和ACC處理的花器官在灰霉菌脅迫36、60和72 h時的PPO活性均顯著高于對照;處理兩兩比較發現,灰霉菌脅迫60 h時,BR處理的花器官的PPO活性顯著高于其他處理的PPO活性,隨著灰霉菌脅迫時間的延長,JA處理的花器官的PPO活性顯著高于其他處理組,表明在灰霉菌脅迫下,外源BR和JA能夠持續提高月季花器官的PPO活性(圖5)。推斷外源BR、SA、JA和ACC能在一定程度上通過提高月季PPO活性增強其對灰霉菌的抗性,BR和JA處理的效果要優于另外3種激素處理。
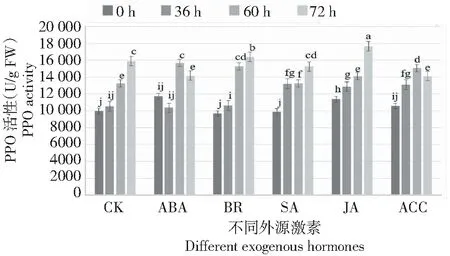
圖5 灰霉菌脅迫下外源激素處理月季花器官PPO酶活性變化
POD活性:ABA處理的花器官在灰霉菌侵染36、60和72 h其POD活性均顯著高于對照,且POD活性變化趨勢與對照一致均呈持續顯著增高的趨勢;JA處理后POD活性與對照無顯著差異;BR、SA和ACC處理的花器官在灰霉菌脅迫下,POD活性呈先上升后下降的趨勢,BR和ACC處理的花器官的POD活性在60 h最高與對照無顯著差異,灰霉菌侵染72 h時其POD活性均顯著低于對照,表明外源BR和ACC處理不能影響花器官在灰霉菌脅迫下的POD活性;SA處理的花器官在灰霉菌脅迫36 h時POD活性最高,并顯著高于對照,灰霉菌侵染60 h與對照無顯著差異,灰霉菌侵染72 h其POD活性顯著低于對照組,因此推斷外源SA處理在短時間內提高花器官在灰霉菌脅迫下的POD活性具有一定的效果,但隨著時間的延長效果并不顯著;處理兩兩比較,ABA處理的花器官在灰霉菌脅迫下其POD活性顯著高于其他外源激素處理(圖6),表明外源ABA處理能夠持續增強月季對灰霉菌防御過程中POD活性。
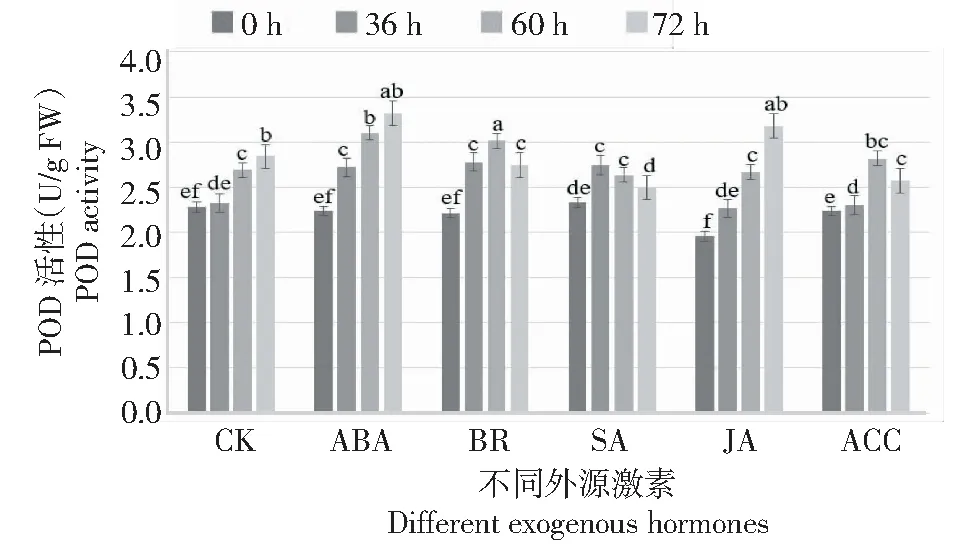
圖6 灰霉菌脅迫下外源激素處理月季花器官POD變化
CHT活性:ABA處理的花器官在接種0和36 h時的CHT活性顯著提高;BR處理的花器官在灰霉菌脅迫60 h時的CHT活性顯著高于對照;SA處理的花器官在灰霉菌脅迫36 h時的CHT活性達到最高,隨后CHT活性下降,在72 h顯著低于對照;JA處理的花器官在灰霉菌脅迫過程中其CHT活性與對照組無顯著差異;ACC處理的花器官在灰霉菌脅迫過程中其CHT活性均顯著高于對照;處理兩兩比較,ACC處理的花器官在灰霉菌脅迫過程中CHT活性顯著高于其他處理(圖7),表明外源ACC處理能夠提高月季在灰霉菌侵染過程中的CHT活性,推斷外施ACC能夠在一定程度上提高月季對灰霉菌的抗性。
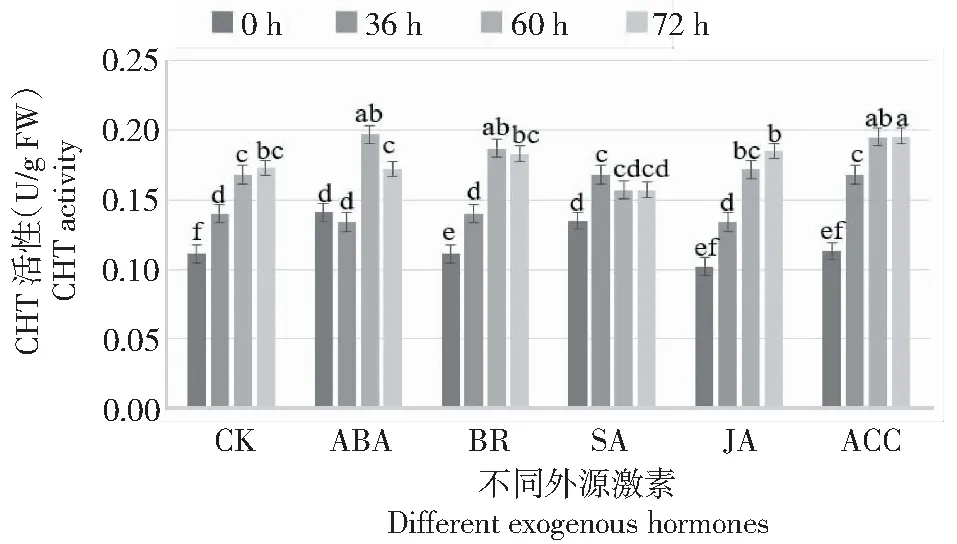
圖7 灰霉菌脅迫下外源激素處理月季花器官CHT變化
2.3 生理生化指標間方差分析和相關性分析
利用Pearson相關系數法分析月季花器官不同生理生化指標間的相關性,如表1所示。本研究中月季花器官氧化酶SOD和POD呈負相關,即SOD活性下降,POD活性上升,表明在灰霉菌脅迫下,其SOD抗氧化系統可能被破壞,POD活性上升以降低灰霉菌對月季花器官的傷害。GLU和CHT能夠降解病原菌的細胞壁和抑制其繁殖能力降低其對植物器官的侵害,PPO通過催化木質素和醌類化合物的合成增強植物對病菌的防御能力。在本研究中,3種抗病酶PPO、GLU和CHT呈正相關,通過共同作用增強了月季花器官對灰霉菌的抵抗能力。

表1 酶活性相關性分析
3 討 論
植物在受到病原菌侵染后,會誘導體內一系列防御酶活性的變化,PPO、POD、SOD、GLU和CHT在植物抵抗病原菌侵染過程中具有重要的作用,其活性變化可以作為植物防御能力的指標之一。SOD和POD共同作用能夠清除細胞內自由基活性氧,將有毒的自由基氧化還原成H2O2和O2。PPO通過催化植物中木質素合成,構成保護性屏障而使細胞免受病原菌的侵害,也可通過形成醌類化合物直接發揮抗病作用。GLU和CHT通過破壞并抑制真菌的致病力和孢子萌發提高植物的抗菌能力[21-22]。單羽等研究表明,水稻幼苗受到堿蓬內生菌侵染后會導致其POD活性增強[23]。田麗波等[24]研究表明,不同苦瓜品系在受到白粉病菌侵染后其防御酶(PPO、SOD和POD)活性被誘導大幅提升。歐秀玲等[25]研究表明,棉花在受到黃萎病病原菌侵染后,其體內CHT和GLU活性會發生變化。本研究發現,月季花器官感染灰霉菌后其PPO、POD、GLU、CHT活性呈持續升高的趨勢,SOD酶活性呈持續顯著下降的趨勢,推斷灰霉菌的侵染可能使月季花器官SOD抗氧化系統被破壞。SOD活性下降與百合對灰霉菌的響應呈相反的趨勢[26]。以上結果表明,灰霉菌誘導了月季體內抗病酶活性,其抗氧化相關酶POD持續上升以平衡其氧化和抗氧化系統。
植物激素廣泛調節植物對病蟲害的抗性反應。通常當植物遭受逆境脅迫時體內活性氧自由基積累,細胞內一些保護酶系統活性增強,以清除過多的活性氧自由基,從而增強植物的抗逆性[27]。蘇岳峰等[28]研究發現,利用外源JA和SA處理胡椒能夠增強在感染辣椒疫霉菌后POD和SOD活性進而增強對辣椒疫霉菌的抗性。左豫虎等[29]研究表明大豆CHT和GLU活性的增強與其對大豆疫霉菌的抗性呈正相關。根據本研究結果推斷,ABA和SA可能參與月季在灰霉菌脅迫下的氧化與抗氧化平衡的過程。JA、BR和ACC則通過直接誘導其抗病酶活性減緩灰霉菌孢子的繁殖和提高其體內抗菌物質和自身的物理屏障增強月季對灰霉菌的抗性。以上可知,外施JA,BR和ACC能夠更好的增強月季對灰霉菌的抗性。
4 結 論
通過對感染灰霉菌后月季花器官的生理變化測定表明灰霉菌誘導了月季花器官內PPO、GLU、CHT和POD 4種酶活性的提升,SOD活性的下降,且誘導了RcPPO,RcPOD和RcBGLU3個抗病酶相關基因的表達量顯著升高。外源ABA和SA與月季花器官內抗氧化相關酶活性息息相關,外源ACC、JA和BR則通過直接誘導月季花器官內抗病相關酶活性提升增強對病原菌的抗性。本研究為今后研究月季花器官對灰霉菌的抗性機制和防治方法提供了理論基礎。

