LncRNA SNHG1對軟骨細胞損傷的保護作用及調節機制
劉 浪,蔡 風,彭源祥,余 波,黎 騰,黃加裕,陳欽燦,萬文兵,廖 琦
(南昌市第一醫院骨科,南昌 330008)
骨關節炎(OA)是全世界中老年人最常見的關節疾病,其特征是局部炎癥、關節軟骨損傷和軟骨退化[1]。軟骨細胞是關節軟骨組織中唯一的細胞,分布在軟骨基質中,在維持關節軟骨的結構和功能完整性方面發揮著重要作用[2],是OA發病的主要促成因素之一[3],調節軟骨細胞增殖、凋亡、分化等生理功能是防治OA的關鍵[4]。當前OA的治療策略主要是控制癥狀,缺乏有效的治療手段[5]。因此,有必要開發新的有效治療方法來預防OA的發生。長鏈非編碼RNA(lncRNAs)是一類長度超過200個核苷酸的非編碼RNA分子,不僅與腫瘤的生長、耐藥和轉移有關,而且還參與細胞增殖、分化、凋亡和炎癥反應[6-9]。目前,隨著對OA發病機制研究的深入,lncRNAs對OA發生發展的調控作用不斷被發現[10-11]。小核仁RNA宿主基因1(SNHG1)是一種新型lncRNA,位于染色體11q12.3。越來越多的證據[12-13]表明,SNHG1的功能障礙與骨肉瘤、結直腸癌、肝癌等人類疾病的發生發展有關。此外,近期研究[14]還發現lncRNA SNHG1可能參與了OA的發生發展。然而,SNHG1在OA發展過程中的生物學作用需進一步研究,基于此,本研究旨在探討SNHG1在OA發展過程中對軟骨細胞的保護作用及其潛在機制,為OA治療提供理論基礎與新的視角。
1 材料與方法
1.1 軟骨樣本
人軟骨標本來源于南昌市第一醫院2019年12月31日至2020年12月31日收治的12例膝骨關節炎行關節置換患者(年齡57~71歲,平均64.5歲),按照軟骨損傷Outerbridge分級對切取的軟骨標本進行分級,其中Ⅰ級定義為相對正常軟骨組織,Ⅲ級為骨關節炎軟骨組織。
1.2 軟骨細胞培養
軟骨細胞系ATDC5來自吉妮歐生物科技公司,細胞在含10% FBS(Gibco)的DMEM(Gibco)中重懸,并置于無菌濕潤的培養箱中培養(37 ℃和5%CO2)。
1.3 構建OA軟骨細胞模型
使用10 ng·mL-1IL-1β(上海生工生物工程有限公司)誘導ATDC5軟骨細胞24 h,建立OA軟骨細胞模型。
1.4 qRT-PCR檢測
使用Trizol試劑(美國Invitrogen公司)從OA軟骨組織或軟骨細胞中提取總RNA。將提取的總RNA逆轉錄為cDNA。接下來,使用SYBR Green PCR Kit(日本Takara公司)對引物片段進行實時PCR擴增。GAPDH作為mRNA和lncRNA的內參,U6作為miRNA的內參。各基因的相對表達量采用2-△△Ct法計算。
SNHG1正向(F):5′-CCGCTCGAGCTCATT-TTTCCTTGTTCG-3′,反向(R):5′-CGCGGATC-CGCAAAGAATTATTTCATC-3′;miR-186-5p(F):5′-AAGAATTCTCCTTTTGGGCT-3′,(R):5′-GT-GCGTGTCGTGGAGTCG-3′;Runx2(F):5′-AACGATCTGAGATTTGTGGGC-3′,(R):5′-CCTGC-GTGGGATTTCTTGGTT-3′;PCNA(F):5′-AACCAGGAGAAAGTTTCAG-3′,(R):5′-GCACAGGAAATTACAACAG-3′。
1.5 細胞轉染
使用Lipofectamine 2000試劑(美國Life Technologies公司)進行轉染(詳細步驟參考Lipofectamine 2000 reagent說明書)將寡核苷酸或重組質粒轉染到OA軟骨細胞模型中。SNHG1質粒、miR-186-5p模擬物、si-SNHG1及其相應的陰性對照(蘇州Genepharma公司)。
1.6 MTT法檢測
采用MTT法檢測OA軟骨細胞的增殖活性,具體步驟嚴格按照試劑盒說明書進行。將轉染的軟骨細胞接種在96孔培養板中,培養結束時,按培養基1/5體積加入MTT工作液繼續孵4 h,離心機離心后棄上清。加入DMSO 100 μL·孔-1,待結晶完全溶解,用酶標儀測定450 nm處的吸光度值。
1.7 細胞凋亡率檢測
使用膜聯蛋白V-FITC凋亡檢測試劑盒(美國Invitrogen公司)檢測細胞凋亡率。軟骨細胞被胰蛋白酶消化并重新懸浮在培養基中,在避光暗盒中使用V-FITC和PI染色后通過流式細胞儀測量細胞凋亡的百分比。
1.8 雙熒光素酶報告基因檢測
使用Lipofectamine 2000試劑將miR-186-5p模擬物或miR-NC轉入含有突變型SNHG1(SNHG1- MUT)或野生型SNHG1(SNHG1-WT)質粒載體的OA軟骨細胞模型中。轉染48 h后,使用試劑盒(美國Promega公司)測定軟骨細胞中的熒光素酶活性。
1.9 蛋白質免疫印跡法
使用RIPA(萬特生物工程有限公司)裂解液和提取細胞中的總蛋白質,并使用BCA(萬特生物)蛋白質濃縮試劑盒進行定量。定量總蛋白通過10% SDS-PAGE凝膠分離并轉移到PVDF膜上,然后,用5%的脫脂牛奶封閉膜2 h,接著分別用抗PCDA、抗Runx2一抗(美國Proteintech Group公司)將膜在4 ℃下孵育過夜,然后用二抗(美國Proteintech Group公司)在室溫下孵育1 h。使用增強化學發光(ECL)試劑(上海碧云天生物技術有限公司)對蛋白質條帶進行著色,并以GAPDH作為蛋白質的內參。
1.10 統計學方法
2 結果
2.1 SNHG1在OA軟骨組織與細胞中的表達
與正常軟骨組織相比,SNHG1在OA軟骨組織中的表達水平明顯降低(P<0.01);同時,與正常軟骨細胞相比,SNHG1在OA軟骨細胞中的表達水平顯著下調(P<0.01)。此外,將si-SNHG1或SNHG1轉染OA軟骨細胞后,SNHG1過表達質粒轉染明顯上調SNHG1表達(P<0.01),而si-SNHG1轉染明顯下調SNHG1表達(P<0.01)。見圖1。
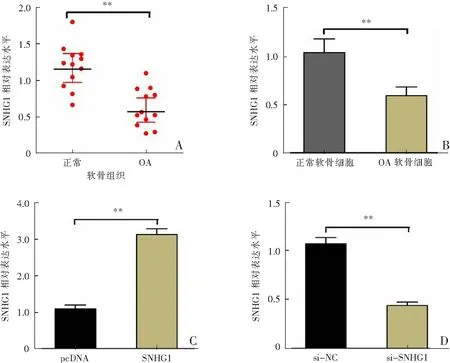
A:SNHG1在OA軟骨組織與正常軟骨組織中的表達;B:SNHG1在OA軟骨細胞與正常軟骨細胞中的表達;C:SNHG1過表達質粒轉染OA軟骨細胞后SNHG1的表達;D:si-SNHG1轉染OA軟骨細胞后SNHG1的表達;**P<0.01。
2.2 SNHG1對OA軟骨細胞增殖、凋亡、分化的影響
si-SNHG1轉染后OA軟骨細胞凋亡率顯著增加(P<0.01),增殖活力顯著降低(P<0.05),分化相關分子Runx2(runt相關轉錄因子2)mRNA蛋白表達水平顯著升高(P<0.01),增殖相關分子PCNA(增殖細胞核抗原)表達水平顯著降低(P<0.01);而SNHG1過表達質粒轉染后OA軟骨細胞凋亡率顯著降低(P<0.05),增殖活力顯著升高(P<0.01),Runx2 mRNA蛋白表達水平顯著降低(P<0.01),PCNA表達水平顯著增加(P<0.01),見圖2。結果表明,過表達的SNHG1可以增強OA軟骨細胞活力,抑制OA軟骨細胞凋亡及分化,對OA軟骨細胞發揮保護作用。
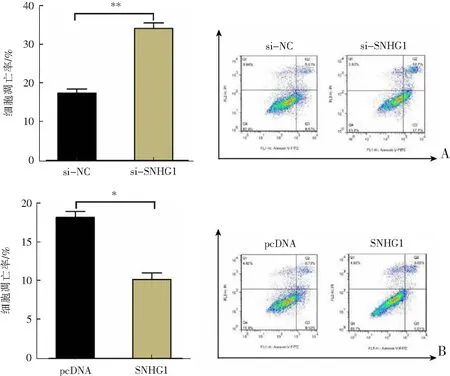
A、B:流式細胞術檢測過表達SNHG1質粒、si-SNHG1轉染后OA軟骨細胞凋亡率;C、D:MTT法檢測過表達SNHG1質粒、si-SNHG1轉染后OA軟骨細胞增殖活力;E—H:蛋白質免疫印跡法檢測過表達SNHG1質粒、si-SNHG1轉染后OA軟骨細胞中PCNA和Runx2 mRNA的表達;*P<0.05,**P<0.01。
2.3 miR-186-5p作為lncRNA-SNHG1的靶基因鑒定
本研究利用Starbase預測SNHG1在miR-186-5p中可能存在靶向結合位點(圖3A)。將SNHG1-MUT(突變型)或SNHG1-WT(野生型)載體與miR-186-5p mimics(模擬物)或miR-NC共轉染到OA軟骨細胞中,以確定SNHG1和miR-186-5p間的相互作用,結果顯示,在與miR-186-5p模擬物共轉染后,SNHG1-WT組細胞的熒光素酶活性顯著低于SNHG1-MUT組(P<0.01,圖3B)。此外,qRT-PCR檢測結果顯示,過表達SNHG1轉染顯著降低miR-186-5p的表達(P<0.05),而si-SNHG1轉染顯著增加miR-186-5p的表達(P<0.01,圖3C);且miR-186-5p與OA軟骨組織中SNHG1基因表達呈顯著負相關(圖3D)。以上結果證實miR-186-5p是SNHG1在OA軟骨細胞中的直接靶基因。
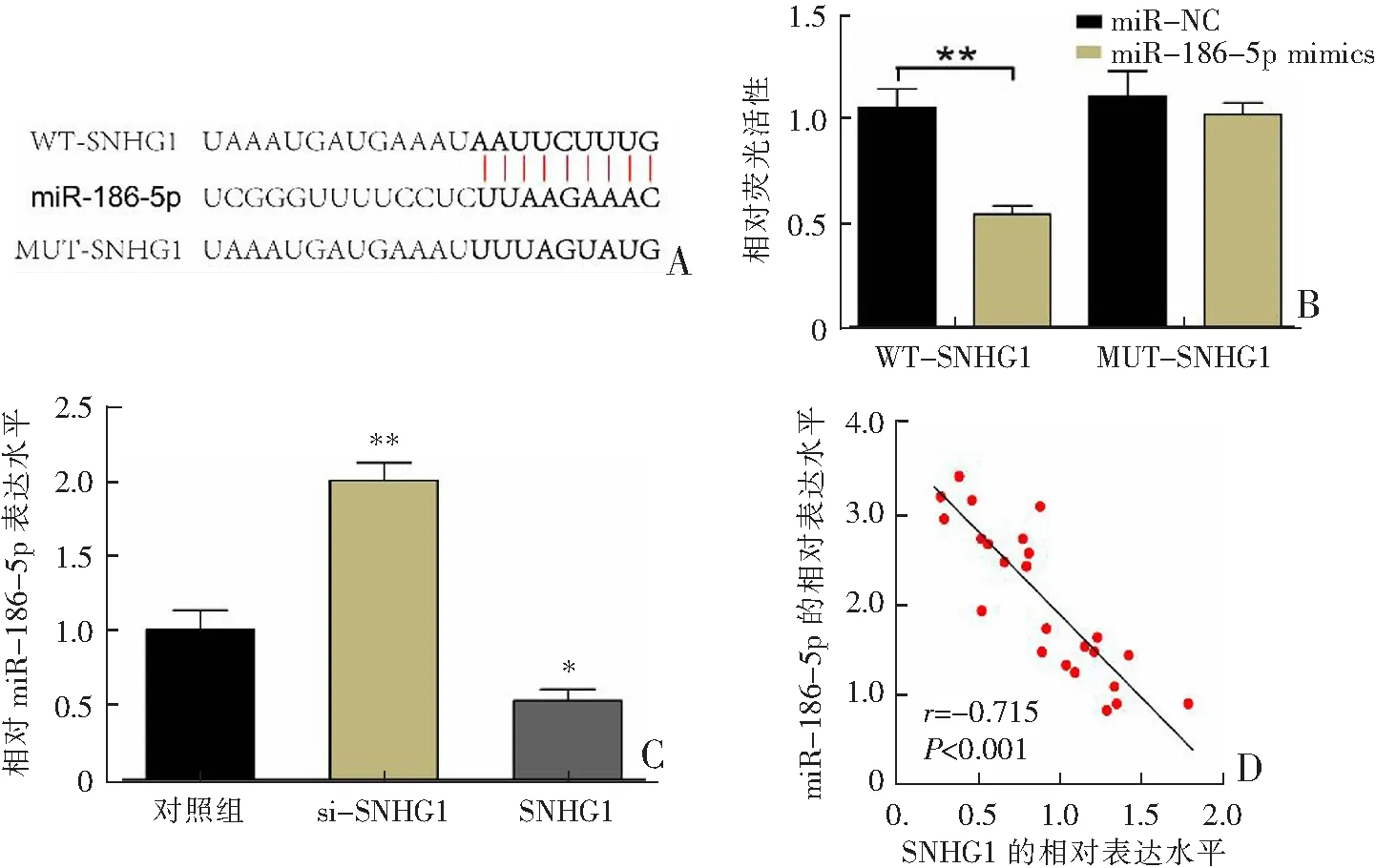
A:SNHG1與miR-186-5p的結合位點;B:雙熒光素酶基因檢測報告;C:qRT-PCR檢測結果;D:OA軟骨組織中miR-186-5p與SNHG1基因表達的相關性;*P<0.05,**P<0.01。
2.4 SNHG1通過靶向抑制miR-186-5p調控OA軟骨細胞的增殖、凋亡和分化
與SNHG1單獨轉染相比,miR-186-5p模擬物和SNHG1共轉染的OA軟骨細胞凋亡率顯著增加(P<0.01,圖4A—B);細胞增殖活力顯著降低(P<0.01,圖4C);PCNA表達水平顯著降低,Runx2表達水平顯著增加(P<0.01,圖4D—E)。結果表明,SNHG1可以與OA軟骨細胞中的miR-186-5p競爭性結合,從而改善軟骨細胞的增殖、分化并抑制細胞凋亡。

3 討論
OA是最常見的關節疾病之一,正在成為世界范圍內的公共衛生問題[15]。OA的發病機制尚未完全闡明,軟骨細胞增殖和凋亡失衡是導致OA的主要因素之一,而lncRNA與軟骨細胞關系密切[8,16]。本研究結果顯示,SNHG1在OA軟骨細胞中表達上調,這與LEI等[14]的研究一致。最近的一項研究[17]發現SNHG1通過與多吡啶束結合蛋白1(PTBP1)相互作用調節類風濕關節炎滑膜細胞侵襲和增殖。本研究發現SNHG1可以改善IL-1β誘導的軟骨細胞細胞凋亡、增殖并降低細胞分化因子runx2的表達。這些結果表明SNHG1抑制了OA的發生和發展。
有研究[18]表明SNHG1有成為癌癥診斷、預后和治療的腫瘤生物標志物的可能,SNHG1通過激活不同的信號通路參與了人類癌癥的發生[19-21]。LI等[22]研究表明LncRNA SNHG1通過與DNMT1(DNA甲基轉移酶1)結合抑制p53表達促進肝癌發展;JI等[23]研究表明lncRNA SNHG1通過miR-195/NEK2軸促進宮頸癌的進展。此外,miR-577作為骨肉瘤細胞中SNHG1的ceRNA通過激活骨肉瘤細胞中的Wnt/β-catenin通路發揮致癌作用[24]。然而,SNHG1和OA之間的關系仍有待闡明。根據生物學軟件Starbase預測miR-186-5p可能是SNHG1的直接靶標。因此,筆者推測SNHG1可能通過miR-186-5p在OA中發揮保護作用。本研究通過實時熒光定量PCR檢測miR-186-5p在敲低或過表達SNHG1的軟骨細胞中的相對表達,發現miR-186-5p的表達量與SNHG1呈負相關。此外,雙熒光素酶報告基因結果證實miR-186-5p是OA軟骨細胞模型中SNHG1的直接靶基因。本研究進一步實驗驗證了miR-186-5p對SNHG1介導的OA軟骨細胞增殖、分化和凋亡的影響。結果表明,miR-186-5p mimic能夠部分逆轉了pc-SNHG1對關節炎軟骨細胞增殖、分化和凋亡的影響。這進一步說明SNHG1通過靶向調控miR-186-5p調節骨關節炎的進展。有研究[25]表明敲低lncRNA MFI2-AS1通過增加miR-130a-3p/TCF4軸保護脂多糖(LPS)處理的軟骨細胞的細胞活力,但抑制細胞凋亡、炎癥反應和細胞外基質降解。還有研究[26]表明lncRNA-TUG1通過lncRNA-TUG1/miR-195/MMP-13軸調控骨關節炎細胞外基質的降解。這可能意味著lncRNAs的失調在各種尚未相關的慢性炎癥疾病的發病機制中具有深遠的影響。因此,接下來miR-186-5p的下游靶標及調控的信號通路將是本課題組的研究重點。
綜上所述,SNHG1通過靶向調控miR-186-5p減輕軟骨細胞炎癥損傷,調節細胞增殖、凋亡和分化,為OA的治療提供理論參考。

