不同時機亞低溫結合高壓氧治療重型顱腦損傷的遠期療效及對氧化應激反應的影響
馬晶,王曉慧,崔大勇
(吉林大學白求恩第一醫院神經創傷外科,吉林 長春 130021)
顱腦損傷是臨床常見的主要由外界暴力直接引起的神經外科疾病,我國每年大約有60萬人發生顱腦損傷,死亡約10萬人,因其具有較高的危險性,已引起外醫學界的廣泛關注[1-2]。引起顱腦損傷的原因多種多樣,交通事故傷為首要致病原因[3]。臨床上根據顱腦損傷的嚴重程度分為輕、中、重、特重四種類型,其中重型顱腦損傷的主要特征為廣泛顱骨骨折、腦干損傷及顱內血腫等。當腦組織發生重大損傷后,腦部血液循環不暢,加之腦細胞損傷容易誘發腦組織缺氧,短時間機體缺氧是造成致命性損傷的重要原因[4]。隨著醫療技術和醫療器械的不斷發展,重型顱腦損傷的死亡率明顯降低,但仍需進一步提高診療效果,改善預后。高壓氧治療可有效提高氧分壓、降低顱內壓,改善腦組織供氧,促進損傷神經恢復,在臨床廣泛應用于顱腦損傷患者[5]。早在九十年代,亞低溫治療顱腦損傷就已得到了國內外醫師的重視,將患者保持低體溫可有效維持其基本生命體征,減緩病情發展[6]。目前重型顱腦損傷患者術后應用亞低溫結合高壓氧治療是常見的措施,但對于治療時機的選擇臨床仍存在一定的爭議。本研究旨在探討不同時機亞低溫結合高壓氧治療重型顱腦損傷的遠期療效及對氧化應激反應的影響。
1 資料與方法
1.1 一般資料
選取2018年1月至2020年1月吉林大學白求恩第一醫院收治的93例重型顱腦損傷患者為研究對象,根據治療方式不同分為早期組(n=45)和常規組(n=48)。早期組中,男性29例,女性16例;年齡24~57歲,平均(37.49±8.54)歲;GCS評分3~8分,平均(6.48±0.81)分;致傷原因:交通事故傷24例,砸傷12例,高空墜傷8例,其他1例。 常規組中,男性30例,女性18例;年齡22~58歲,平均(38.46±9.13)歲;GCS評分3~8分,平均(6.19±0.93)分;致傷原因:交通事故傷26例,砸傷11例,高空墜傷9例,其他2例。本研究經本院醫學倫理委員會審核通過。兩組患者一般資料比較,差異無統計學意義(P>0.05)。納入標準:(1)影像學檢查提示廣泛顱骨骨折、腦干損傷及顱內血腫等,明確診斷為重型顱腦損傷;(2)傷后呈昏迷狀態,格拉斯哥昏迷量表評分(GCS)[7]為3~8分;(3)入院后24 h內行開顱去骨瓣減壓手術者;(4)術后生命體征平穩、顱內無活動性出血者;(5)臨床資料完整者。排除標準:(1)既往存在腦出血、腦外傷等腦部損傷者;(2)合并糖尿病、高血壓等基礎疾病者;(3)合并急性感染者;(4)合并器官損傷危及生命者;(5)入院時體溫低于30 ℃者。
1.2 方法
兩組患者均給予營養神經、脫水降顱壓及抗感染等對癥治療。常規組術后立即使用亞低溫治療儀(珠海和佳醫療設備股份有限公司)進行頭部和全身降溫:將冰毯溫度設置在34 ℃左右,墊在病床上直接接觸患者皮膚,另使用毛巾包裹冰袋放在患者前額、腋下及腹股溝等位置,使肛溫控制在33~35 ℃。當顱內壓降至正常水平后維持治療24 h。當亞低溫治療完成后進行高壓氧治療,使用醫用空氣加壓氧艙GY3200治療,治療前20 min緩慢加壓至2.5ATA,穩定氧分壓并維持40 min,后20 min緩慢減壓至患者出艙,80 min/次,1次/d。治療過程護理人員應密切關注患者是否出現皮膚顏色概念、不正常出汗及呼吸困難等情況,若出現應立即停止治療。早期組患者術后同時進行亞低溫和高壓氧治療,操作方法同常規組。療程均為1個月。
1.3 觀察指標
(1)組織氧分壓和顱內壓水平:治療前及治療1個月后分別采用血流灌注及氧分壓監測系統、顱內壓監護儀進行監測。(2)氧化應激指標:治療前和治療1個月后采集患者清晨空腹靜脈血5 mL,離心處理后取血清樣本,采用分光光度法檢測血清還原型谷胱甘肽(GSH)和丙二醛(MDA)水平。還原型谷胱甘肽含量檢測試劑盒高于北京索萊寶科技有限公司,丙二醛酶聯免疫吸附測定試劑盒購于武漢伊萊瑞特生物科技股份有限公司;操作按試劑盒說明書進行。(3)神經功能:治療前及治療1個月后分別用格拉斯哥昏迷量表(GCS)評分、美國國立衛生研究院卒中量表(NIHSS)評分[8]和簡易精神狀態評價量表(MMSE)評分[9]評估患者昏迷狀態、神經功能狀態和認知功能。其中GCS、MMSE評分越高,則患者昏迷程度越輕、認知功能越好;NIHSS評分越低則患者神經功能狀態越好。(4)遠期療效:治療結束后隨訪1年,應用格拉斯哥預后量表(GOS)[10]評分評估,分為病死、植物生存、重度殘疾、中度殘疾和恢復良好5個等級。
1.4 統計學分析
2 結果
2.1 兩組患者組織氧分壓和顱內壓水平比較
治療前,兩組患者組織氧分壓和顱內壓水平比較,差異無統計學意義(P>0.05)。治療1個月后,兩組患者組織氧分壓均升高(P<0.05),且早期組組織氧分壓高于常規組(P<0.05);顱內壓均降低(P<0.05),且早期組低于常規組(P<0.05)。見表1。

表1 兩組患者組織氧分壓和顱內壓水平比較
2.2 兩組患者氧化應激指標比較
治療前,兩組GSH和MDA水平比較,差異無統計學意義(P>0.05)。治療1個月后,兩組患者GSH水平均升高(P<0.05),且早期組高于常規組(P<0.05);MDA水平均降低(P<0.05),且早期組低于常規組(P<0.05)。見表2。

表2 兩組患者氧化應激指標比較
2.3 兩組患者神經功能比較
治療前,兩組患者GCS、NIHSS和MMSE評分比較,差異無統計學意義(P>0.05)。治療1個月后,兩組患者GCS、MMSE評分均升高(P<0.05),且早期組高于常規組(P<0.05);NIHSS評分均降低(P<0.05),且早期組低于常規組(P<0.05)。見表3。
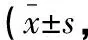
表3 兩組患者神經功能比較分)
2.4 兩組患者遠期療效比較
隨訪1年,早期組患者恢復良好率高于常規組,差異有統計學意義(P<0.05)。見表4。

表4 兩組患者遠期療效比較[n(%)]
3 討論
重型顱腦損傷是急診科常見的疾病種類,其發病急,預后差,有較高的致殘率和死亡率,給家庭和社會帶來了沉重的負擔。近年來,如何降低重型顱腦損傷的殘死率成為國內外醫學界研究的難點和熱點。多項臨床研究證實,亞低溫治療是重型顱腦損傷有效的治療手段之一,分析其作用機制主要為:(1)降低人腦代謝率和氧耗。相關研究[11]表明,機體核心溫度每下降1 ℃,機體代謝率會隨之降低5%左右,低溫環境下氧消耗降低,葡萄糖利用率增加。(2)可減少神經細胞破壞程度,維持神經細胞和神經膠質細胞的完整性。(3)保護血腦屏障,腦損傷后血腦屏障受損導致大量有毒物質進入腦組織,從而誘發血管源性腦水腫,且腦水腫嚴重程度與血腦屏障損傷程度有密切聯系。臨床試驗[12]發現,在30~33 ℃的環境下,動物血腦屏障損壞程度最低,亞低溫可減緩血腦屏障受損程度。(4)降低血漿中神經元特異性烯醇化酶水平、炎性因子水平及細胞毒性產物,對腦組織有一定的保護作用。由于患者發生重型顱腦損傷后,腦細胞缺氧缺血容易形成繼發性腦損傷,除開亞低溫治療外還應聯合高壓氧治療,從而糾正腦部細胞缺血缺氧狀態,促進腦部神經功能恢復[13]。
本研究結果顯示,隨訪1年時間后早期組恢復良好率高于常規組(P<0.05),表明術后同時進行亞低溫和高壓氧治療的臨床效果更為顯著,原因可能是在亞低溫狀態下,患者代謝下降,從而減少腦部氧耗,一定程度降低患者腦細胞缺氧風險,同時采用高壓氧治療,可進一步糾正腦缺氧狀態,從而有利于患者神經功能恢復。有研究[14]表明,造成重型顱腦損傷患者病理改變的主要原因是顱內壓升高,導致腦灌注不足,繼而破壞血腦屏障,引發神經元水腫,故降低顱內壓具有重要臨床意義。本研究結果顯示,治療1個月后,早期組組織氧分壓高于常規組(P<0.05),顱內壓低于常規組(P<0.05),與武希青等[15]研究結果相似,表明術后早期聯合亞低溫和高壓氧治療可有效降低顱內壓,改善腦部氧供和微循環狀況,原因可能在于早期聯合高壓氧治療可盡早糾正腦組織缺氧狀態收縮顱內血管,減輕腦組織水腫,改善了微循環狀況,中斷了惡性循環過程。GSH是細胞內的自然抗氧化劑,可直接清除氧自由基,間接提高抗氧化水平,是減少再灌注過程中氧自由基損傷的重要機制[16];MDA是脂質過氧化反應的產物,可有效反應機體細胞受自由基攻擊的程度[17]。本研究中治療1個月后,早期組GSH水平高于常規組(P<0.05),MDA水平低于常規組(P<0.05),原因可能是進行亞低溫聯合高壓氧治療,腦部耗氧降低,并提高氧分壓,降低顱內壓,從而可改善患者腦部組織供氧,腦組織攝氧完全則刺激GSH水平升高,而GSH水平升高,則可提高機體抗氧化能力,從而可減輕患者腦組織損傷,使血腦屏障得以修復;同時患者腦部組織供氧狀態得以改善,可有效降低機體內自由基水平,MDA水平降低。此外,早期組GCS、MMSE評分高于常規組(P<0.05),NIHSS評分低于常規組(P<0.05),表明術后早期同時行亞低溫和高壓氧聯合治療可有效改善患者體內應激氧化反應和神經認知功能。
綜上,術后同時進行亞低溫和高壓氧治療可有效降低重型顱腦損傷患者顱內壓,改善其腦部供氧和神經功能,減輕氧化應激反應,且遠期療效好。但本研究仍存在一定的局限性,如樣本量少、神經功能評定方式受主觀因素影響等,后續研究可通過擴大樣本量、選取客觀評價指標進一步完善。

